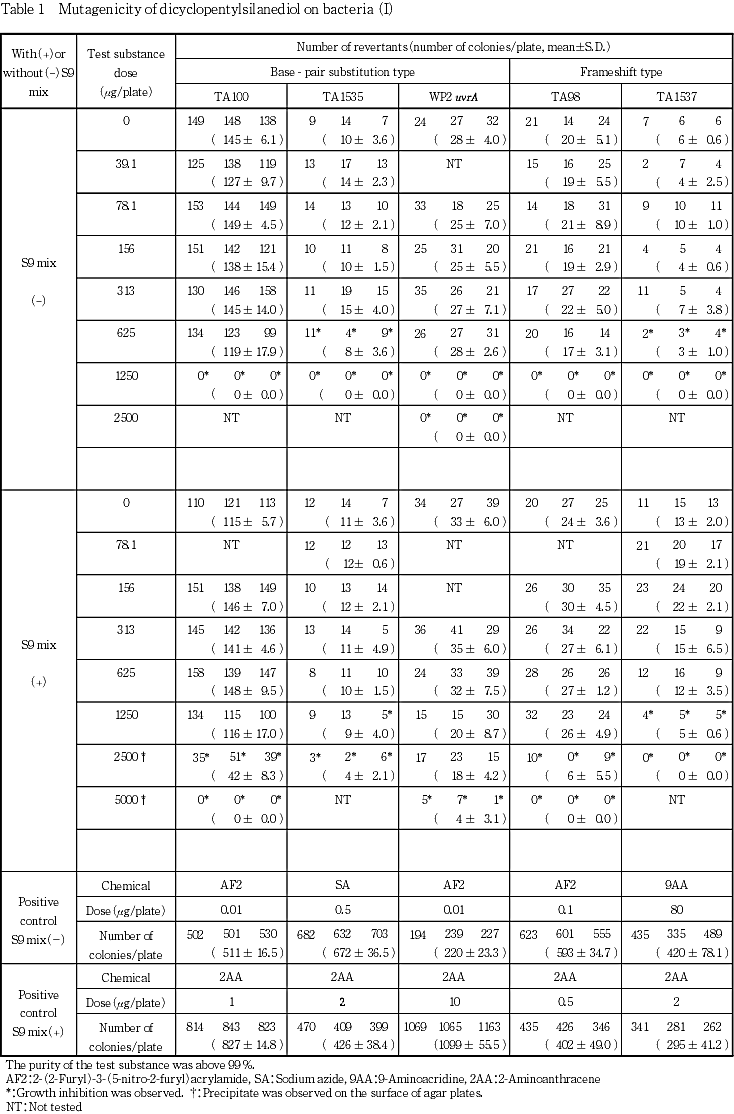
ジシクロペンチルシランジオールについて,細菌を用いる復帰変異試験を実施した.
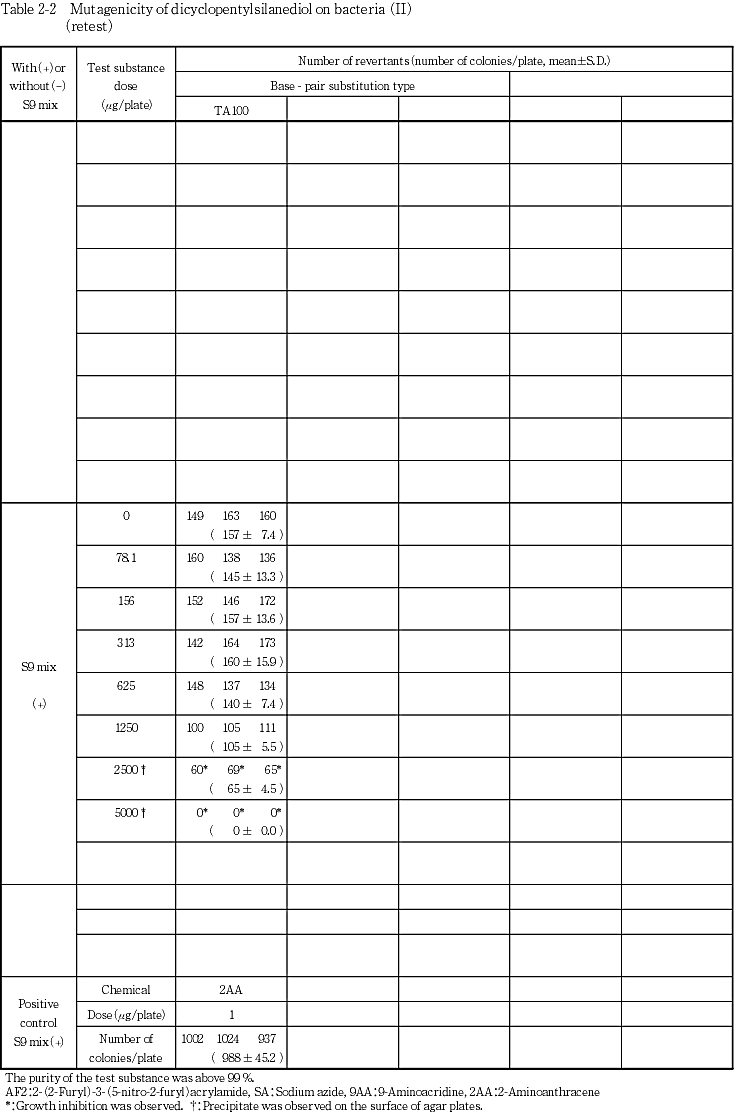
検定菌として,Salmonella typhimuriam TA100,TA1535,TA98,TA1537 1)およびEscherichia coil WP2 uvrA 2)の5菌株を用い,用量設定試験で,WP2 uvrAのS9 mix添加試験以外では抗菌性を示す用量が認められたことから,本試験は用量範囲をS9 mix無添加試験では,Salmonella菌の4菌株では39.1〜1250 μg/plate,WP2 uvrAでは78.1〜2500 μg/plateとし,S9 mix添加試験ではTA1535とTA1537は78.1〜2500 μg/plate,TA100とTA98は156〜5000 μg/plate,WP2 uvrAは313〜5000 μg/plateとして実施した.ただし,TA100のS9 mix添加試験では,本試験IIで抗菌性のない用量が4用量に達しなかったため,78.1〜5000 μg/plateの範囲で本試験IIの再試験を行った.
その結果,2回の本試験で用いた5種類の検定菌のいずれの用量においても,陰性対照値の2倍以上となる復帰変異コロニー数の増加は認められなかった.
以上の結果から,ジシクロペンチルシランジオールは,用いた試験系において変異原性を有しないもの(陰性)と判定した.
ジシクロペンチルシランジオールは,ジメチルスルホキシド(DMSO,ロット番号:ACL5008,和光純薬工業(株))に溶解して最高用量の調製液を調製した後,同溶媒で所定の濃度に希釈して速やかに試験に用いた.
各検定菌ごとに用いた陽性対照物質は,当研究所で十分な蓄積データが得られている物質および用量とし,それぞれTable中に示した.
2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド(AF2,和光純薬工業(株))
アジ化ナトリウム(SA,和光純薬工業(株))
9-アミノアクリジン(9AA, Sigma Chem. Co.)
2-アミノアントラセン(2AA,和光純薬工業(株))
AF2,9AAおよび2AAはDMSOに,SAは超純水に溶解したものを-20 ℃で凍結保存し,解凍後,速やかに試験に用いた.
S. typhimuriamの4菌株は1997年8月7日に,E. coil WP2 uvrA株は1997年4月9日に日本バイオアッセイ研究センターの松島泰次郎博士から分与された.
検定菌は-80 ℃で凍結保存したものを用い,各菌株の特性確認は,凍結保存菌の調製時に,アミノ酸要求性,UV感受性,膜変異(rfa)およびアンピシリン耐性因子pKM 101(プラスミド)の有無について調べ,特性が維持されていることを確認した.
試験に際して,ニュートリエントブロスNo. 2(Oxoid Ltd.)を入れたL字型試験管に解凍した種菌を一定量接種し,37 ℃で10時間往復振とう培養したものを検定菌液とした.分光光度計により660 nmの吸光度を測定し,検定菌液の増殖を確認した.
| 硫酸マグネシウム・7水和物 | 0.2 g |
| クエン酸・1水和物 | 2 g |
| リン酸水素二カリウム | 10 g |
| リン酸一アンモニウム | 1.92 g |
| 水酸化ナトリウム | 0.66 g |
| グルコース | 20 g |
| 大洋寒天(清水食品) | 15 g |
| 径90 mmのシャーレ1枚あたり30 mLを流して固めたものである. | |
| (A) | バクトアガー(Difco Lab.) | 0.6 w/v % |
| 塩化ナトリウム | 0.5 w/v % | |
| (B) | Salmonella typhimuriam用 | |
| L-ヒスチジン | 0.5 mmol/L | |
| D-ビオチン | 0.5 mmol/L | |
| (C) | Escherichia coil用 | |
| L-トリプトファン | 0.5 mmol/L |
| S9* | 0.1 mL |
| 塩化マグネシウム | 8 μmol |
| 塩化カリウム | 33 μmol |
| グルコース-6-リン酸 | 5 μmol |
| NADH | 4 μmol |
| NADPH | 4 μmol |
| ナトリウム-リン酸緩衝液(pH 7.4) | 100 μmol |
小試験管中に,被験物質調製液0.1 mL,リン酸緩衝液0.5 mL(S9 mix添加試験においてはS9 mix 0.5 mL),検定菌液0.1 mLを混合し,37 ℃で20分間プレインキュベーションしたのち,約45 ℃に保温したトップアガー2 mLを加えて混和し,合成培地平板上に流して固めた.また,対照群として被験物質調製液の代わりに使用溶媒,または数種の陽性対照物質溶液を用いた.各検定菌ごとに用いた陽性対照物質の名称および用量は各Table中に示した.同時に実施した試験については,陰性および陽性対照群を共通とした.
培養は37 ℃で48時間行い,生じた復帰変異コロニー数をコロニーアナライザーまたは目視によって算定した.被験物質に由来する沈殿の有無は,肉眼により観察した.また,抗菌性の有無については,肉眼あるいは実体顕微鏡下で,寒天表面の菌叢の状態から判断した.用いた平板は用量設定試験においては,陰性および陽性対照群では3枚ずつ,各用量については1枚ずつとした.また,本試験においては,両対照群および各用量につき,3枚ずつを用い,それぞれの平均値と標準偏差を求めた.
用量設定試験は1回,本試験は2回実施し,結果の再現性を確認した.また,TA100のS9 mix添加試験については,本試験IIの再試験も実施した.
以上の結果から,本試験における最高用量は,S9 mix無添加試験では,Salmonella菌の4菌株では1250 μg/plate,WP2 uvrAでは2500 μg/plateとし,S9 mix添加試験ではTA1535とTA1537は2500 μg/plate,それ以外の検定菌は5000 μg/plateとした.
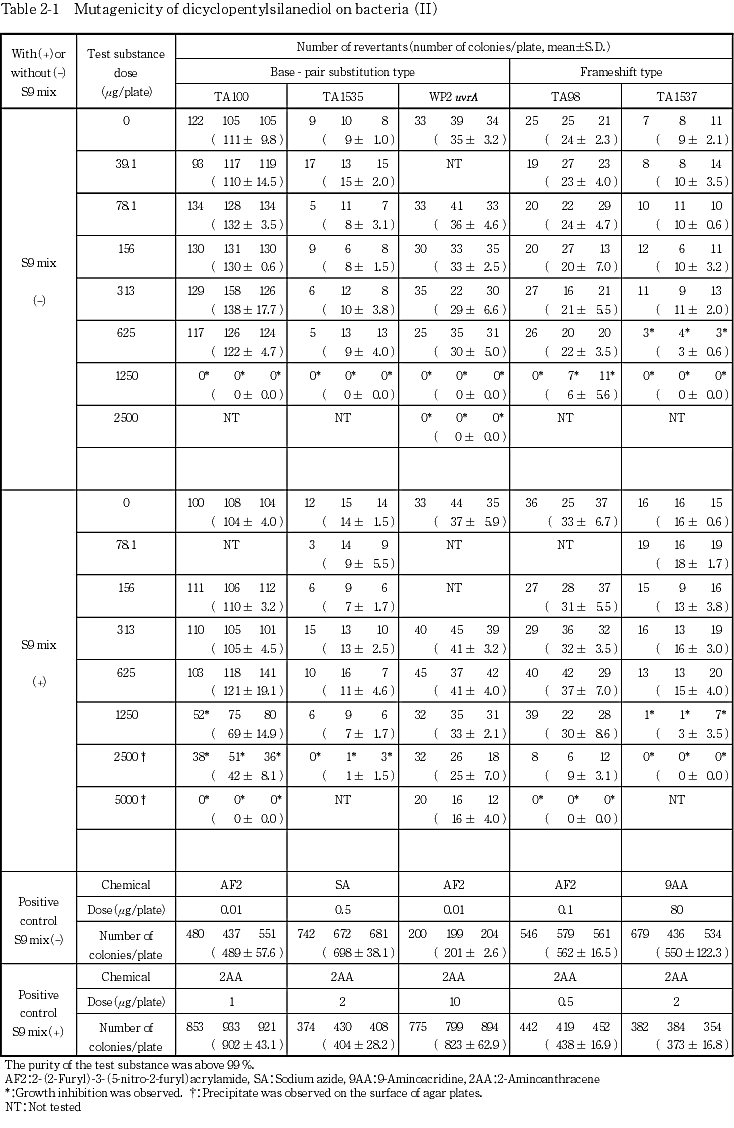
上記の最高用量に基づいて,公比2で5または6用量を設定して2回の本試験(本試験Iおよび本試験II)を実施した(Table 1, 2-1).ただし,TA100のS9 mix添加試験では,本試験IIで抗菌性のない用量が4用量に達しなかったため,用量段階を7用量として本試験IIの再試験を行った(Table 2-2).
その結果,すべての検定菌において,2回の試験とも陰性対照値の2倍以上となる復帰変異コロニー数の増加は認められなかった.
以上の結果に基づき,ジシクロペンチルシランジオールは,用いた試験系において変異原性を有しないもの(陰性)と判定した.
なおジシクロペンチルシランジオールは,当研究所で本試験と並行して実施したチャイニーズ・ハムスター培養細胞を用いる染色体異常試験では陰性であった4).また,関連物質であるシランについては,復帰変異試験で陽性の結果が5),メチルトリクロロシランについては,染色体異常試験で陰性の結果が,ジメチルジクロロシランとトリメチルクロロシランについては,染色体異常試験で陽性の結果が得られている6).

| 1) | D. M. Maron and B. N. Ames, Mutation Research, 113, 173(1983). |
| 2) | M. H. L. Green, “Handbook of Mutagenicity Test Procedures,” eds. by B. J. Kilbey, M. Legator, W. Nichols, C. Ramel, Elsevier, Amsterdam, New York, Oxford, 1984, pp.161-187. |
| 3) | T. Matsushima, T. Sugimura, M. Nagao, T. Yahagi, A. Shirai, M. Sawamura, “Short-term Test Systems for Detecting Carcinogens,” eds. by K. H. Norpoth, R. C. Garner, Springer, Berlin, 1980, pp.273-285. |
| 4) | 山影康次,化学物質毒性試験報告,8, 1179(2001). |
| 5) | A. Araki, et al., Mutat. Res., 307, 355(1994). |
| 6) | A. Isquith, et al., Food Chem. Toxicol., 26, 255(1998). |
| 連絡先 | |||
| 試験責任者: | 澁谷 徹 | ||
| 試験担当者: | 原 巧,川上久美子,須井 哉,山本明子,三枝克彦,加藤初美 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Tohru Shibuya(Study Director) Takumi Hara, Kumiko Kawakami, Hajime Sui, Akiko Yamamoto, Katsuhiko Saegusa, Hatsumi Kato | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai Hadano-shi, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||