その結果、3−ニトロベンゼナミンの15 mg/kg/day以上の用量は、5〜7週間の連続投与によって雌雄ラットに脾の腫大あるいは暗色化を来す反復投与毒性発現量であり、一部の雌では分娩あるいは哺育機能に障害がおよぶ可能性が示唆された。また50 mg/kg/dayは、雌雄ラットに体重増加の抑制あるいは摂餌量の減少を来し、さらに分娩途中の雌1例が死亡したことから、本化合物の妊娠ラットに対する最大耐量を若干凌駕した量と考えられた。なお、本化合物については雄ラットに対する精巣毒性が知られているが、本試験条件下においては、雄ラットの生殖能力に対して明らかな毒性を示さなかった。また、50 mg/kg/dayを親動物に投与してもその出生児の発育、生存性および形態には悪影響を及ぼさなかった。これらのことから、本試験条件下では、3−ニトロベンゼナミンの雌雄ラットに対する反復投与毒性に関する無影響量および雌ラットの生殖能力に対する無影響量は5 mg/kg、雄ラットの生殖能力に対する無影響量および次世代児に対する無影響量は50 mg/kgと判断される。
今回、OECDによる既存化学物質の安全性点検に係わる毒性調査事業の一環として3−ニトロベンゼナミンの簡易生殖毒性試験を行い、本化合物の生殖・発生毒性について検討したのでその結果を報告する。
本被験物質は0.5%CMC-Na水溶液に懸濁し、いずれの用量においても1回の投与液量が5 ml/kgになるように含量を調整して投与検体とし、調製後は冷暗条件下で密閉保管して調製後7日以内に投与した。調製液中の被験物質は、室温・遮光の保管条件下で少なくとも7日間安定であり、均一性も維持された。また、使用した投与検体の含量測定結果にも問題はなかった。
各動物は、温度24±1℃、相対湿度55±5%、換気回数約15回/時間、照明12時間(午前7時〜午後7時)に調節されたバリアーシステムの飼育室で、金属製金網床ケージ(22×27×19 mm、日本ケージ(株))に個別に収容して飼育し、固型飼料(CA-1、日本クレア(株))および水道水を自由に摂取させた。妊娠18日以後の母動物には、飼育ケージの床に金属製床板を敷き、床敷としてホワイトフレーク(日本チャールス・リバー(株))を適宜供給した。
供給した飼料、水、および床敷には試験に支障を来す可能性が考えられる夾雑物の混在はなかった。
各用量の投与検体は、雄に対しては交配前14日間と交配期間14日間および交配期間終了後14日間の連続42日間、また、雌に対しては交配前14日間と交配期間中(交尾成立まで;最長14日間)ならびに交尾成立雌では妊娠期間を通して分娩後の哺育3日まで毎日1回、ラット用胃管を用いて強制的に経口投与した。毎日の投与は、原則として一定時刻の間(通常13時〜16時)に行い、各動物の投与液量は、雄ならびに交配前および交配期間中の雌については週1回の測定体重をもとに、また、交尾成立後の雌については妊娠0日の体重をもとにそれぞれ算出した。
死亡例は、いずれの投与群においても認められなかった。一般状態に関しては、100 mg/kg投与群の全例で投与10〜14日(投与開始日=投与0日、投与14日=剖検日)に末端部体表の褪色がみられたが、この他には、いずれの投与群においても被験物質の投与に起因したと推定される一般状態の変化は認められなかった。
ii) 体重および摂餌量
体重、体重増加量、摂餌量ともに対照群と被験物質投与群との間で有意差は認められなかった。
iii) 剖検所見、精巣および精巣上体重量
脾の腫大あるいは暗色化が、100 mg/kg投与群の5例全例および50 mg/kg投与群の5例中4例にみられたほか、精巣および精巣上体の萎縮が、100 mg/kg投与群の2例および50 mg/kg投与群の1例にみられた。しかし、精巣および精巣上体の重量には、対照群と被験物質投与群との間で有意差は認められなかった。
死亡例は、いずれの投与群においても認められなかった。一般状態に関しては、100 mg/kg投与群の全例および50 mg/kg投与群の5例中4例で投与10〜18日の間に末端部体表の褪色がみられた。
ii) 体重および摂餌量
体重、体重増加量にはいずれの測定時期においても対照群と被験物質投与群との間で有意差は認められなかった。摂餌量が、100 mg/kg投与群において有意な低値を示した。
iii) 剖検所見
各被験物質投与群ともすべての雌で脾の腫大あるいは暗色化が認められた。
雌雄とも、全例について試験期間中毎日観察した。
(2) 体重
雌雄とも、全例について体重を試験期間中週1回〔雄:投与0、7、14、21、28、35、41日、雌:投与0、7、14、21日(投与0日=投与開始日)〕および解剖日に測定した。また、交尾成立雌では、妊娠0、7、14、21日、分娩した雌では、分娩後1および4日(哺育1および4日)の体重を測定した。
(3) 摂餌量
雌雄とも、全例について体重測定日と同日に餌重量を測定し、測定日から次の測定日までの間の摂餌量を算定した。交配期間中の摂餌量は測定しなかった。交尾成立雌では、妊娠0-7、7-14、14-20日および分娩した雌では、哺育1-4日の摂餌量を測定した。
(4) 交配
交配は、投与14日(15回投与日)の夕方から最長2週間、同一群内の雌雄を1対1で終日同居させて行った。交尾成立の確認は、毎朝、腟内の腟栓あるいは腟垢中の精子の存在を調べることにより行い、交尾が確認された雌は、その日を妊娠0日と起算して雄から分離し、個別に飼育した。交配結果から、各群について交尾率[(交尾動物数/同居動物数)×100]、[受胎率(妊娠動物数/交尾動物数)×100]および同居開始日から交尾確認日までの日数を求めた。なお、2週間の交配期間中に交尾を示さなかった雌雄(未交尾雄および雌)は、交配期間終了日(投与28日相当日)に剖検した。
(5) 分娩状態
各群とも交尾成立雌は、全例を自然分娩させた。分娩状態の直接観察は、可能なものについて行った。ただし、直接観察できなかった個体についても、分娩後の徴候から分娩困難や分娩遅延などの分娩障害の有無を判断し、個別に記録した。
(6) 分娩日の算定
分娩の確認は、午前9時〜11時に限定し、この時間帯に分娩が完了していることを確認した個体について、その日を哺育1日、その前日を分娩日(哺育0日)と規定した。午前11時を過ぎて分娩した個体については、翌日を哺育1日とした。
分娩を確認した全例について妊娠期間(妊娠0日〜分娩日の日数)を算定した。また、出産率[(生児出産雌数/妊娠雌数)×100]を求めた。
(7) 剖検
a) 雄動物
未交尾雄は交配期間終了日に、交尾成立雄は全例を42回投与の翌日(投与42日)にエーテル深麻酔下で放血・致死させ、剖検した。また、全例について精巣および精巣上体を摘出し、重量を測定した。精巣および精巣上体は、ブアン液に固定して保存し、50 mg/kg投与群および対照群の全例について病理組織学的検査を行った。剖検において異常を認めた器官は10%ホルマリンに固定して保存した。
b) 雌動物
分娩した雌は哺育4日に、交尾したが分娩しない雌は妊娠25日相当日に、また、未交尾雌は交配期間終了日にそれぞれエーテル深麻酔下で放血・致死させ、剖検した。妊・不妊および未交尾のいずれの例においても卵巣および子宮は摘出し、子宮についてはSalewski法3)を応用して着床痕を染色し着床数を確認した。卵巣はブアン液に固定して保存し、実体顕微鏡下で妊娠黄体数を数えたほか、交尾したが不妊であった雌および未交尾雌について病理組織学的検査を行った。剖検において異常を認めた器官および子宮は10%ホルマリンに固定して保存した。
哺育1日に産児数(生存児+死亡児)を調べ、児の産出率[(産児数/着床痕数)×100]および出生率[(出産生児数/着床痕数)×100]を求めた。産児の性別を調べ、外表異常の有無を観察した。
(2) 死亡児数の算定
死亡児数を毎日調べ、哺育1日の生存率[(生児数/産児数)×100]および哺育4日の生存率[(哺育4日の生児数/哺育1日の生児数)×100]を求めた。死亡児は剖検し、胸腔および腹腔内の器官を除去した後、エタノールに固定して保存した。
(3) 体重測定
哺育1日および4日に一腹単位で雌雄別に体重(litter重量)を測定し、[litter重量/測定児数]を各腹について求めた。
(4) 剖検
哺育4日に全例をエーテル深麻酔下で致死させ、剖検した。胸腔および腹腔内の器官は、一括して摘出し、各腹ごとに10%ホルマリンに固定して保存した。カーカスは、各腹ごとにエタノールに固定して保存した。
(5) 骨格観察
50 mg/kg投与群および対照群について哺育4日に剖検した児の全例および観察可能な死亡児をDawson法4)により骨格標本とし、骨格異常および変異の有無を調べた。なお、死亡児については、対照群には異常、変異ともにみられず50 mg/kg投与群においてのみ骨格変異がみられたことから観察の対象を全群に広げ、すべての観察可能な死亡児について骨格観察を行った。
 法により対照群と各被験物質投与群との間で平均値の差の検定を行った。分散が一様でなかった場合は、Kruskal-Wallisの順位検定を行い、群間に有意性が認められた場合に対照群と各被験物質投与群との差についてDunnett型あるいはScheff
法により対照群と各被験物質投与群との間で平均値の差の検定を行った。分散が一様でなかった場合は、Kruskal-Wallisの順位検定を行い、群間に有意性が認められた場合に対照群と各被験物質投与群との差についてDunnett型あるいはScheff 型の検定を行った。
型の検定を行った。
有意水準は、5%および1%とした。
死亡例は、対照群を含むいずれの投与群においても認められなかった。
(2) 一般状態
50 mg/kg投与群の1例において末端部体表の褪色が、投与36日(37回投与日)から剖検日にかけて認められた。このほかには、5 mg/kg投与群の1例で、立毛、眼周囲の褐色汚れ、糞の小粒化が、投与7日から11日(8回〜12回投与日)にかけて一時的にみられたが、他の投与群に類似の変化は認められなかった。
(3) 体重
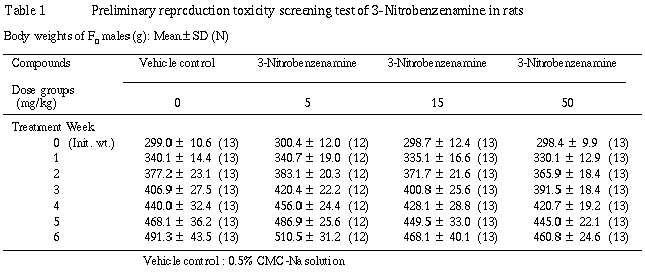
1) 体重(Table 1)
いずれの測定時期においても対照群と各被験物質投与群との間に有意差は認められなかった。
2) 増加量
50 mg/kg投与群において投与開始〜投与第1週の増加量が有意(p<0.05)な低値を示した。15 mg/kg投与群では投与第3〜4週の増加量が有意(p<0.05)な低値を示したが、用量依存的な変化ではなかった。5 mg/kg投与群の増加量にはいずれの測定時期においても対照群と比較して有意差は認められなかった。
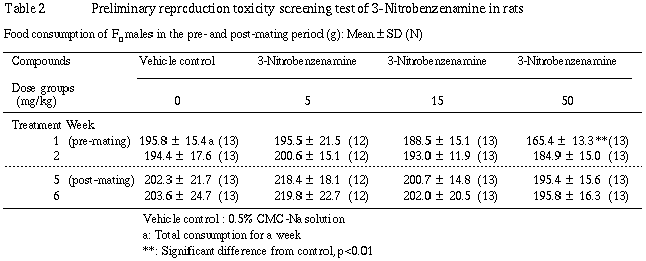
(4) 摂餌量(Table 2)
50 mg/kg投与群において投与第1週の摂餌量が、有意(p<0.05)な低値を示した。15 mg/kg以下の投与群の摂餌量には、被験物質の投与に起因したと推定される変化は認められなかった。
(5) 剖検所見(Table 3)
50 mg/kg投与群の13例中3例に肝の腫大および50 mg/kg投与群の13例全例ならびに15 mg/kg投与群の13例中3例に脾の腫大あるいは暗色化がみられたほかには、被験物質投与に起因すると推定される変化はみられなかった。
(6) 精巣および精巣上体重量
精巣および精巣上体の重量には、被験物質の投与に起因したと推定される変化は認められなかった。
(7) 精巣および精巣上体の病理組織学的所見
対照群と50 mg/kg投与群の全例について観察した結果、被験物質の影響を示唆する異常所見は、いずれの例にもみられなかった。



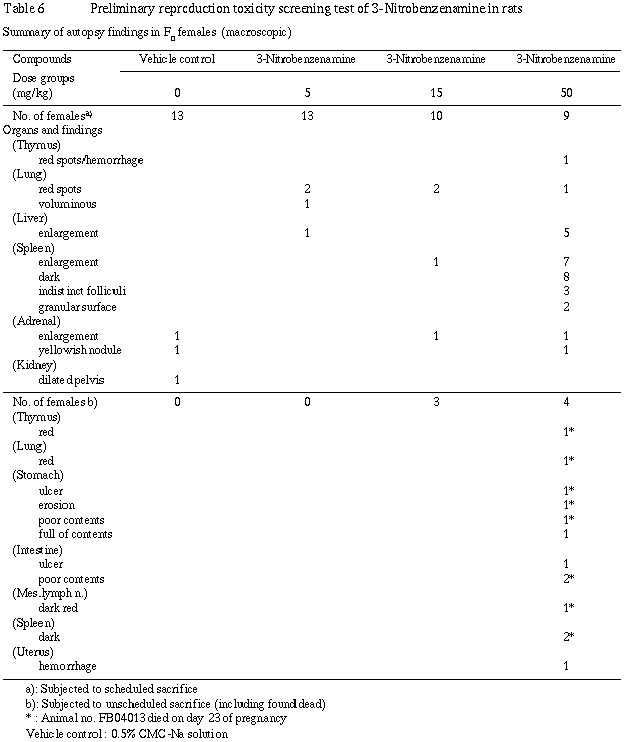
50 mg/kg投与群において1例が、妊娠23日に産児2匹を娩出したまま分娩途中で死亡した。本例の死亡直前の一般状態あるいは分娩状態は観察できなかったが、外表に異常はみられず、また死亡前日までの一般状態にもなんら変化はみられなかった。剖検においては、胸腺の赤色化、肺の浮腫様変化と同辺縁部の赤色化、内容物に乏しい消化管、腸間膜リンパ節および脾の暗色化、胃底部粘膜の潰瘍および糜爛がみられたが、死因は特定できなかった。なお、本例の黄体数および着床数はともに右側12、左側6であり、剖検において右子宮角内に12匹、左子宮角内に4匹の末期胎児を確認した。
(2) 一般状態
50 mg/kg投与群の1例で妊娠期間の後半に末端部体表の褪色がみられた他には、いずれの雌にも被験物質投与に起因したと推定される変化はみられなかった。
(3) 体重(Table 4)
50 mg/kg投与群の体重は、投与開始後一貫して低値に推移した。しかし、交配前、妊娠期間中および分娩後のいずれの測定時期においても、雌の体重および増加量には、対照群と各被験物質投与群との間で有意差は認められなかった。
(4) 摂餌量(Table 5)
交配前において50 mg/kg投与群の投与第1週の摂餌量が有意な低値を示した。妊娠期間中および分娩後の摂餌量には対照群と各被験物質投与群との間で有意差は認められなかった。
(5) 剖検所見(Table 6)
試験を完了し、哺育4日に剖検した雌では50 mg/kg投与群の9例中8例および15 mg/kg投与群の10例中1例、不妊および全児死亡の雌においては50 mg/kg投与群の全児死亡例3例中1例に脾の腫大あるいは暗色化がみられた。また、哺育4日に剖検した雌において50 mg/kg投与群の9例中5例および5 mg/kg投与群の13例中1例に肝の腫大がみられたが、同様の変化は15 mg/kg投与群の雌では認められなかった。このほかには、被験物質投与に起因すると推定される変化はみられなかった。
(6) 卵巣の病理組織学的所見
50 mg/kg投与群の死亡例1例、全児死亡例3例および15 mg/kg投与群の不妊例1例、全児死亡例2例について観察した結果、被験物質の影響を示唆する異常所見はいずれの例にもみられなかった。


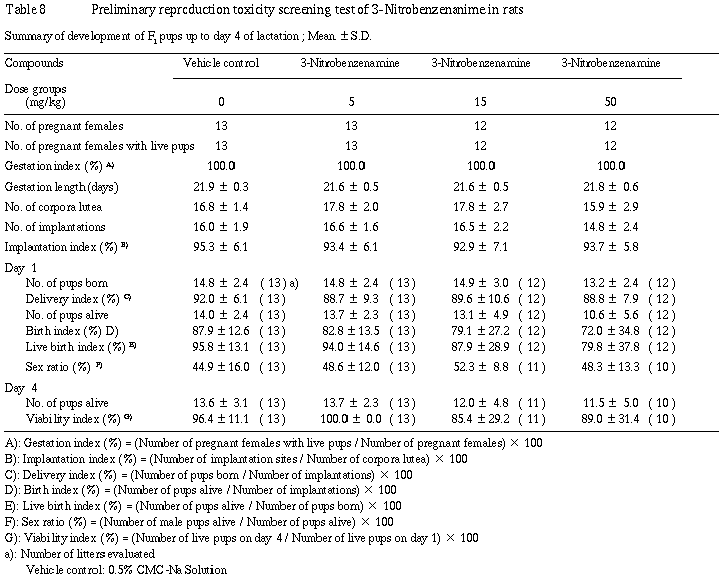

15および50 mg/kg投与群では、哺育1日の全児死亡がそれぞれ1および2例存在したことにより、児の産出率および出生率が低値を示したが、有意な変化ではなかった。哺育1日の産児数、生児数、生存率ならびに哺育4日の生児数および生存率にも対照群と被験物質投与群との間で有意差は認められなかった。
2) 体重(Table 9)
出生児の体重には、哺育1および4日のいずれにおいても雌雄ともに対照群と被験物質投与群との間で有意差は認められなかった。
3) 剖検所見(哺育4日)
a. 外表所見
対照群の出生児1例に鎖肛および尾欠損がみられた他には、いずれの出生児においても外表異常は観察されなかった。なお、出生日の外表観察においても同様の所見が得られたほかには異常は認められなかった。
b. 内臓所見
内臓異常については、5 mg/kg投与群の出生児1例に横隔膜ヘルニアが、また、内臓変異については、対照群の1例に腎盂拡張がみられたが、15および50 mg/kg投与群の出生児には、内臓異常、変異ともに認められなかった。
c. 骨格所見
骨格異常としては、50 mg/kg投与群の2例に胸骨分節癒合、対照群の1例(外表異常個体)に仙・尾椎欠損、1例に肋骨欠損、1例に胸椎椎体・椎弓欠損がみられた。骨格変異については、頚肋骨、腰椎数変異、腰肋骨が50 mg/kg投与群と対照群で、過剰胸骨分節が対照群で、13肋骨短小が50 mg/kg投与群でそれぞれ低率に観察された。しかし、骨格異常および変異ともに発生頻度には、対照群と50 mg/kg投与群との間で有意差は認められず、また、特定の型の異常あるいは変異が、50 mg/kg投与群において増加する傾向も認められなかった。
4) 死亡児の剖検所見
骨格変異として頚肋骨、ダンベル型胸椎椎体および腰椎数変異が各被験物質投与群に散見された他には、いずれの投与群の死亡児においても外表異常、内臓異常、内臓変異および骨格異常は認められなかった。
与群においてもその出生児の発生・発育および生存性に変化はみられず、少なくとも3−ニトロベンゼナミンの50 mg/kg以下の量には次世代児に対する直接的な毒性は認められなかった。また、出生児の形態についても、死亡児を含めて被験物質投与に起因したと考えられる異常はみられなかったことから催奇形作用も認められなかった。なお、本化合物については雄ラットに対する精巣毒性が知られており、予備試験においては50 mg/kgの2週間の投与で5例中1例に精巣および精巣上体の萎縮が発現した。しかし、本試験においては雌雄ラットの交尾および受胎能力にはなんら影響はみられず、精巣および精巣上体の病理組織学的検査においても異常は認められなかった。従って、50 mg/kgは、精巣毒性の発現に関する臨界量に近接した量とも考えられる。本実験条件下では、雌雄ラットに対する反復投与毒性に関する無影響量および雌ラットの生殖能力に対する無影響量は5mg/kg、雄ラットの生殖能力に対する無影響量および次世代児に対する無影響量は50 mg/kgと判断される。
| 1) | 小野寺博志、他, 本書, p. 147. |
| 2) | 河合昭宏、他:脂肪族および芳香族ニトロ化合物の変異原性−工業材料およびその関連物質.産業医学,29:34-54 (1987). |
| 3) | E. Salewski, Naunyn-Schmiedeberg's Arch. Exp.Pathol. Pharmakol. , 247, 367 (1964). |
| 4) | A. B. Dawson, Stain Technol. , 1, 123 (1926). |
| 連絡先: | |||
| 試験責任者 | 水谷正寛 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257 神奈川県秦野市落合 729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence: | |||
| Mizutani, Masahiro | |||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257, Japan | |||
| Tel 81-463-82-4751 | Fax 81-463-82-9627 | ||