雌雄各30匹を同数で6群に分け、4群は投与終了後屠殺群、2群は回復群とした。
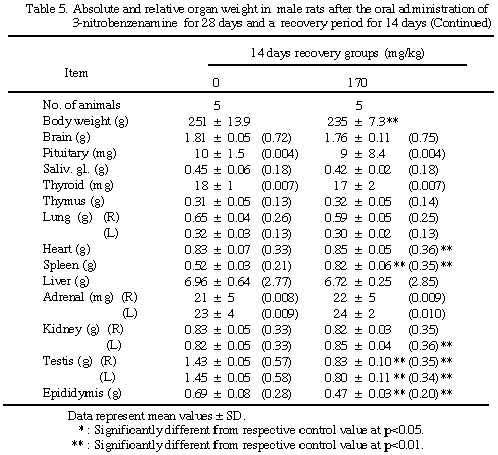
実験期間中死亡例はなかったが、最高用量群の雌雄に体重増加抑制、チアノーゼ、メトヘモグロビン血症が観察された。精巣萎縮が同群に出現したが、卵巣に対する影響はなかった。これらに加え、溶血性貧血及び肝、脾、腎重量の増加が用量に相関して認められた。組織学的には、最高用量群の精巣に多核性巨細胞出現を伴う精子形成低減が、近位尿細管にリポフスチン沈着が、また肝にヘモジデリン沈着及び髄外造血亢進が認められた。脾のヘモジデリン沈着、骨髄の過形成及び肝細胞腫大が投与群で用量相関的にみられた。14日間の休薬後、これらの組織変化は完全ではないが改善された。
本実験条件下で得られたこれらの所見より、3−ニトロベンゼナミンはラットに対し溶血性貧血及び精巣毒性を惹起させ、その無作用量は15 mg/kg/day未満と判断された。
投与4週目及び休薬2週目に新鮮尿を採取し、尿検査用試験紙(マルティスティックSG:マイルス・三共社)を用い、pH、蛋白質、ウロビリノーゲン、ビリルビン、潜血、ケトン体、ブドウ糖及び比重について検査した。
最終投与日及び休薬14日目の夕刻から一夜絶食させ、翌日エーテルによる深麻酔下で腹部大動脈から採血した。採取血液の一部は塗抹標本及び血液学的検査に供し、残りを室温に放置後3000 rpmで10分間遠心分離したのち、血清を生化学的検査に供した。
血液学的検査項目のうち赤血球数、白血球数、ヘモグロビン量、ヘモトクリット値、MCV、MCH、MCHCおよび血小板数は多項目自動血球計数装置(Sysmex M-2000:東亜医用電子社)を用いて算出した。また、白血球分類及び赤芽球の計数は血液塗抹標本にWright's染色を施し、血液細胞自動分析装置(Microx HEG-120A)を用いて計測した。なお予備試験で貧血が確認されたことからBrecher's new methylene blue染色を施した血液塗抹標本を作製し、同装置を用い網状赤血球数を測定した。またメトヘモグロビン量はシアンメトヘモグロビン法7)に準じ測定した。
血液生化学的検査はGOT、GPT、アルカリフォスファターゼ、γ-GTP、コリンエステラーゼ、総コレステロール、総蛋白、アルブミン、A/G、尿素窒素、クレチアニン、Ca、P、Na、K、Clの各項目について実施した。
剖検時、脳、下垂体、唾液腺、甲状腺、胸腺、心、肺、腎、副腎、脾、肝、卵巣、精巣及び精巣上体の重量測定を行った。また上記臓器に加え脊髄、三叉神経、胸骨、大腿骨、骨格筋、胃、小腸、大腸、膵、膀胱、精嚢腺、前立腺、乳腺、舌、眼球、ハーダー氏腺、気管、食道、リンパ節、副鼻腔、皮膚、卵管、子宮及び腟を10%緩衝中性ホルマリン液にて固定した。諸臓器は常法に従って薄切切片を作製し、Hematoxylin-Eosin(HE)染色を施して病理組織学的検査を行なった。なお組織沈着物質を同定するため、肝及び脾はBerulin blue染色を、腎はBerulin blue染色のほかAzan染色およびSchmorl法による染色を施し病理組織学的に検索した。
 型でそれぞれ対照群と各投与群間で有意差検定を行った。なお、回復群は雌雄ともt-検定を行った。
型でそれぞれ対照群と各投与群間で有意差検定を行った。なお、回復群は雌雄ともt-検定を行った。
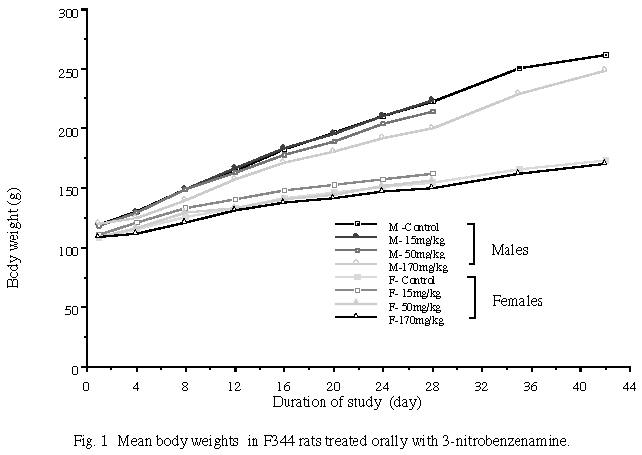
摂餌量は雌雄とも170 mg/kg群で1週目に顕著な低値を示し、雄は投与終了まで対照群よりやや低値で推移したが、雌はその後対照群とほぼ同様な推移を示した。一方、休薬2週目の摂餌量は雌雄とも170 mg/kg群が対照群を上回った。

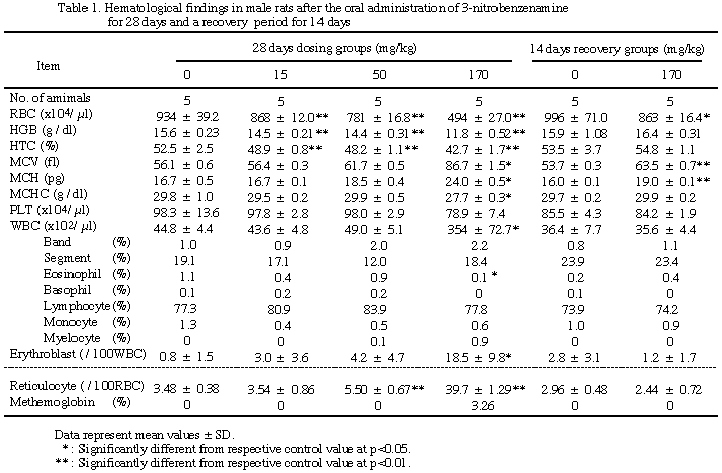
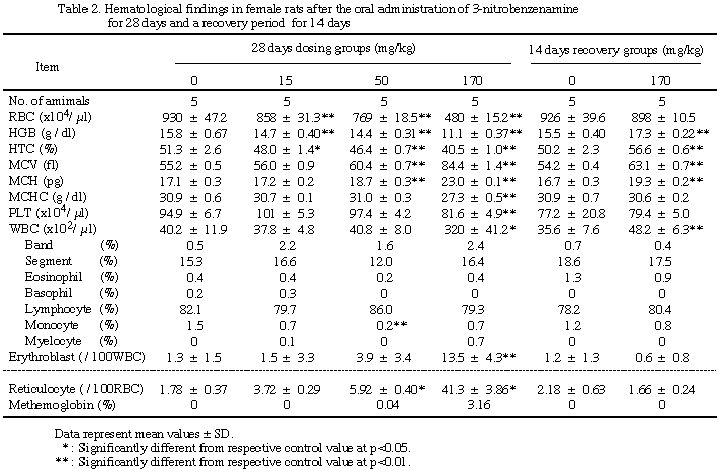
雌雄とも赤血球数、ヘモグロビン量及びヘマトクリット値の減少が15 mg/kg以上の投与群で、またMCV及びMCHの増加並びに赤芽球数及び網状赤血球数の増加が50 mg/kg以上の投与群でそれぞれ用量相関的にみられ、50 mg/kg群の雄のMCVおよびMCH並びに雌雄の赤芽球数を除き各項目とも対照群との間に有意差が認められた。またMCHCの減少、血小板数の減少及びメトヘモグロビン含有率の増加は雌雄170 mg/kg群でみられ、雄の血小板数と雌雄のメトヘモグロビンを除きそれぞれ対照群との間に有意差が認められた。白血球数は170 mg/kg群の雌雄で対照群より有意に増加したが、他の群を含め白血球分類では各構成要素の比率に群間差は認められなかった。休薬によりこれらの所見のうち雌雄のMCV、MCH及び雄の赤血球数は依然対照群との間に有意差が認められたが、雌のヘモグロビン量及びヘマトクリット値は対照群より高値を、赤芽球数及び網状赤血球数は対照群より低値を示し、メトヘモグロビン含有率は全群とも0%となった。
総タンパク質及びアルブミンの増加が15 mg/kg群から雌雄とも用量相関的にみられ、雌は投与全群、雄は50 mg/kg以上の投与群で対照群との間に有意差が認められた。またA/G比も170 mg/kgの雌雄で有意に増加した。総コレステロールは雄では用量に相関して、雌では15及び50 mg/kg群で増加した。その他いくつかの項目で数値の変動がみられたが、用量相関性は認められなかった。
これらの所見は休薬により回復傾向が認められた。


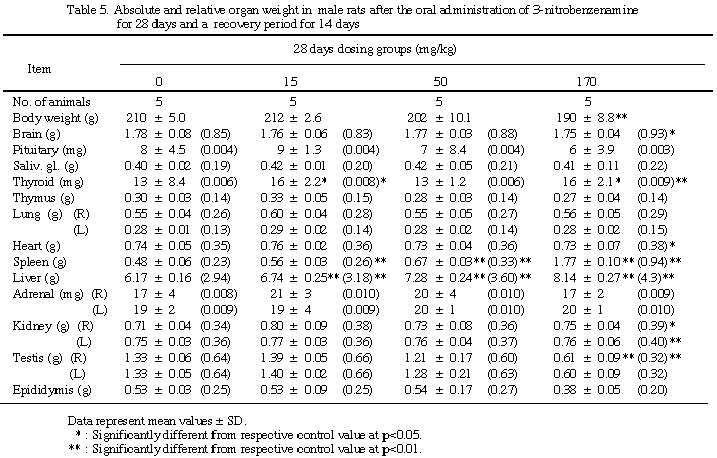
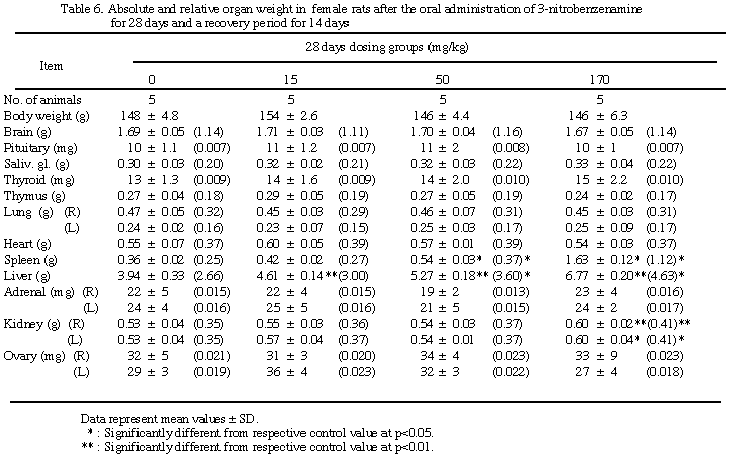
脾及び肝臓では雌雄とも用量相関的な重量増加を示し、雌15 mg/kg群の脾を除き対照群との間に有意差が認められた。腎重量の増加、精巣及び精巣上体の重量減少は170 mg/kg群の動物でみられ、精巣上体を除き対照群との間に有意差が認められた。その他甲状腺、脳、心臓または卵巣の重量に有意差が散見されたが用量相関性はなかった。一方、休薬群では脾、肝、腎、精巣、精巣上体等で依然対照群との間に有意差は残るものの、回復する傾向が認められた。
脾臓:赤脾髄に褐色色素沈着、髄外造血の亢進及びうっ血が15 mg/kg群より用量相関的に認められた。なお褐色色素はBerulin blue陽性であったことからヘモジデリンと同定した。
骨髄:赤血球系の造血亢進が15 mg/kg以上の投与群で用量相関的に認められた。
肝臓:軽〜中等度の肝細胞腫大が50 mg/kg以上の投与群に、軽〜中程度のKupffer細胞及び肝細胞の褐色色素沈着並びに髄外造血像が170 mg/kg群に認められた。なお褐色色素はBerulin blue陽性であったことからヘモジデリンと同定した。
腎臓:170 mg/kg群の雌雄で主に近位尿細管上皮内に小顆粒状褐色色素沈着がみられた。この色素はBerulin blue陰性、Schmorl反応陽性(暗緑色)を示したためリポフスチンと同定した。また50 mg/kg以上の投与群の雄にEosin好性、Azan陽性のEosinophilic body8)の増加が認められた。
精巣:170 mg/kg群の雄全例に精細管の萎縮、多核性巨細胞の出現、精母細胞・精子細胞・精子の変性、Leydig細胞の増生等が認められた。
精巣上体:50 mg/kg群の1例及び170 mg/kg群の全例の精巣上体管内に精子は認められず、変性した精上皮細胞、多核性巨細胞等の集簇が認められた。
上記以外の臓器においては対照群と比べ特記すべき所見は認められなかった。また、2週間の休薬によりこれらの所見は回復する傾向を示し、すべて可逆性の変化であると考えられる。
3−ニトロベンゼナミン投与により変化の認められた臓器は腎、脾、肝、精巣及び精巣上体であった。腎は近位尿細管上皮内にリポフスチン沈着がみられた以外に形態学的変化はなく、投与群で重量が増加した原因については不明であった。脾の重量増加は溶血に伴う赤脾髄のうっ血、髄外造血の亢進が原因と考えられた。肝では溶血に起因するヘモジデリン沈着及び髄外造血以外に肝細胞腫大も認められた。血液生化学検査でのT-cho等増加がみられ、類似化合物の1, 3-dinitrobenzeneに酵素誘導作用10)があることを考慮すれば、肝の蛋白合成能が亢進していることも考えられた。精巣では精母細胞より成熟段階の進んだ精上皮の殆どが変性または脱落し、また精巣上体で精子が認められなかったことから、精細管の萎縮及び精子形成障害が重量の減少した原因と考えられた。1, 3-dinitrobenzeneの精巣毒性が報告され10)て以来、その機序を解析するためにいくつかの研究がなされている。Blackburnらは経口投与後精巣の変化を経時的に観察し14)Fosterらは精祖細胞とSertoli細胞をco-cultureし15)、また篠田らはBrdU免疫組織化学及びランタント・レーサー法を用い16)て検索した結果、最初に障害を受けるのはSertoli細胞であることが明らかにされた。しかし今回用いた用量の3−ニトロベンゼナミンではSertoli細胞に変化はなく、1, 3-dinitrobenzeneと比べ精巣毒性の弱いことが判明したが、機序について1, 3-dinitrobenzeneと同じか否かは解明されなかった。
血液検査で白血球数の異常な高値が170 mg/kg群の雌雄で観察された。今回測定に用いた装置及び溶血剤は本来ヒトの臨床検査用に開発されたものである。松本は同機種を用いて同溶血剤の効果を検討した結果、マウスでは多染性赤血球に対し溶血作用のないことを明らかにし、残存したこの血球が加算されて計測されるため、白血球数が異常高値となる可能性を報告している13)。今回も溶血性貧血があり、特定の白血球が増加した所見もないことから、同様の理由で白血球の増加が示されたものと考えられた。
以上の結果より3−ニトロベンゼナミンのラットに対する主な標的臓器は1, 3-dinitrobenzeneと同様赤血球と精巣であるが、その毒性の強さは1, 3-dinitrobenzeneより弱いことが判明した。また本実験条件下における3−ニトロベンゼナミンの無影響量は15 mg/kg未満と考えられた。


| 1) | D.V. Parke, J.Biochem, 78, 262 (1961). |
| 2) | R.P. Mason, P.D.Josephy, "Free radical mechanism of nitroreductaze.: Rickert DE(ed) Toxicity of nitro-aromatic compounds," Hemisphere, Washington, 1984, pp.121-140 |
| 3) | J. Santodonato, S.Bosch, W.Meylan, J.Becker, M,Neal, "Monograph on human exposure to chemicals in the workplace : Nitroanilines. Center for chemical hazard assessment," Syracuse Research Corporation, Syracuse, New York, Report No.SRC-TR-84-1046, 1985, p.26,33 |
| 4) | E.H.Vernot, J.D.MacEwen, C.CHaun, E.R.Kinkead, Toxicol. Appl. Pharmacol., 42, 417 (1977). |
| 5) | C.W.Chiu, L.H.Lee, C.Y.Wang, G.T.Bryan, Mutation Res., 58, 11(1978). |
| 6) | M. Shimizu, E.Yano, Mutation Res., 170, 11 (1986). |
| 7) | 宮地隆興, 藤沢桂子, " 赤血球 メトヘモグロビン測定法、血液学研究検査法," 青木延雄, 柴田昭編, 中外医学社 , 1980 , p210. |
| 8) | 小野寺博志, 谷川廣行, 松島裕子, 前川昭彦, 黒川雄二林裕造, 衛生試報, 103, 15(1985). |
| 9) | V. Facchini, L.A.Griffiths, Biochem.Pharmacol., 30,931(1981). |
| 10) | T.E.Cody, S.Witherup, L.Hastings, K.Stemmer, R.T. Christian, J.Tocxicol.Environ.Health, 7, 829 (1981). |
| 11) | K.M.Abdo, M.P.Jokinen, J.Toxicol.Environ. Health, 29,77 (1990). |
| 12) | 宮地隆興, 日本臨床, 37, 3942 (1979). |
| 13) | 松本清司, J.Toxicol. Sci., 14 Supplement III, 67 (1989). |
| 14) | D.M.Blackburn, A.J.Gray, S.C. Lloyd, C.M.Sheard, P.M.D.Foster. Toxicol. Appl.Pharmacol., 92, 54 (1988). |
| 15) | P.M.D.Foster, S.C.Lloyd, M.S.Prout, Toxic. in Vitro. 1, 31 (1987). |
| 16) | 篠田和俊, 岡宮英明, 今沢孝喜, 古川文夫, 豊田和, 佐藤秀隆, 高橋道人, 衛生試報, 107, 63(1989). |
| 連絡先: | |||
| 試験責任者 | 小野寺博志 | ||
| 国立衛生試験所安全性生物試験研究センター 病理部 | |||
| 〒158東京都世田谷区上用賀1-18-1 | |||
| Tel 03-3700-1141 | Fax 03-3700-2348 | ||
| Correspondence: | |||
| Onodera, Hiroshi | |||
| Division of Pathology, Biological Safety Research Center, National Institute of Health Sciences, Japan | |||
| 1-18-1 Kamiyoga, Setagaya-ku, Tokyo, 158, Japan | |||
| Tel 81-3-3700-1141 | Fax 81-3-3700-2348 | ||