3-メチル安息香酸のラットを用いる
反復経口投与毒性・生殖発生毒性併合試験
Combined Repeat Dose and Reproductive/Developmental
Toxicity Screening Test of 3-Methylbenzoic acid by Oral Administration in Rats
要約
3-メチル安息香酸は,感光色素,蛍光染料,防錆剤,顔料,農薬などに使用されている化学物質で,m-キシレンを酸化して製造される1).また,本被験物質は,m-キシレンの生体内中間代謝物として知られており2),m-キシレンはラットへの反復投与により肝臓に対して毒性影響を有することが報告されている3).しかし,3-メチル安息香酸の毒性については,単回経口投与毒性についての報告4)は認められるが,反復経口投与毒性および生殖発生毒性については明らかにされていない.
今回,3-メチル安息香酸について,反復経口投与毒性・生殖発生毒性併合試験を,SD系〔Crj:CD(SD)〕ラットを用い,0,30,100,300および1000 mg/kg用量で実施した.動物は1群雌雄各10匹とし,被験物質は交配開始14日前から雄は44日間,雌は分娩後哺育3日(41〜45日間)まで投与した.
1. 反復投与毒性
雄親について,1000 mg/kg群で自発運動の低下,血液プロトロンビン時間の延長,血小板数の減少,血清GOTの増加並びに下垂体の相対重量の増加が認められた.一方,雌親について,病理組織学検査において300 mg/kg以上の群で肝細胞の空胞変性が認められ, 1000 mg/kg群では肝臓の絶対および相対重量の増加が認められた.以上の結果から,3-メチル安息香酸のラットにおける主な反復投与毒性は肝臓に対する影響で,血液凝固系および下垂体重量に対する影響も認められた.無影響量は雄で300 mg/kg/day,雌で100 mg/kg/dayと推定された.
2. 生殖発生毒性
雌雄親の生殖能および児動物の発生について,変化は認められなかった.したがって,雌雄親の生殖能および児動物の発生に対する無影響量は,1000 mg/kg/dayと推定された.
方法
1. 被験物質
3-メチル安息香酸は,融点111.7℃,沸点263℃,有機溶剤に易溶,植物油にほとんど不溶,水に難溶な弱い刺激臭のある無色ないし淡黄色の粒状物である.試験には,三菱瓦斯化学(株)(東京)製造のもの(ロット番号7N24,純度98.79 %)を入手し,冷暗所(4℃)で密栓保管し使用した.投与終了後に供給元にて分析を行い,試験期間中安定であったことを確認した.投与液は,被験物質を1 %メチルセルロース水溶液〔メチルセルロース100cP:和光純薬工業(株);局方精製水:共栄製薬(株)〕に懸濁して調製し,使用時まで冷暗所(4℃)で密栓保管し,調製後7日以内に使用した.なお,投与開始前に投与液中の被験物質について分析し,均一性および7日間の安定性を確認した.試験に供した投与液については,ほぼ所定濃度で調製されていたことを確認した.
2. 供試動物および飼育条件
日本チャールス・リバー(株)より搬入したSD系〔Crj:CD(SD)〕ラットを5日間試験環境に馴化させ,その間に検疫を行い,発育が順調で一般健康状態の良好なものを雄は9週齢(342〜372 g),雌は8週齢(209〜237 g)で,1群雌雄各10匹として試験に供した.ラットは,温度21〜23℃,湿度53〜60 %,換気回数10回以上/時,照明12時間(6〜18時)に制御した飼育室で,金網ケージに個体別に収容し,固型飼料〔ラボMRストック,日本農産工業(株)〕および水を自由に摂取させた.ただし,交尾確認後の雌は,巣作り材料〔ホワイトフレーク,日本チャールス・リバー(株)〕を入れたポリカーボネート製ケージに収容した.
3. 投与量および投与方法
投与量設定試験として,ラットを1群雌雄各4匹とし,3-メチル安息香酸を0,80,150,300,600および1000 mg/kgで14日間反復経口投与した.投与7日の夕方から交尾が成立するまで,雌雄各1匹ずつを同居させた.その結果,1000 mg/kg群で,雌に投与の後半において体重増加の抑制傾向および摂餌量の減少傾向が認められ,さらに雌雄に血小板数の減少が認められた.尿検査では,600 mg/kg以上の群で雌雄に尿の酸性化傾向が認められた.一般状態,血液生化学検査,剖検,器官重量および交配成績には,被験物質の投与による変化は認められなかった.以上の結果から,本試験における投与量については,反復投与毒性が確実に発現すると予測される1000 mg/kgを最高用量,投与の影響が発現しないと予測される30 mg/kgを最低用量とし,それらの間に300および100 mg/kgを設定した.投与方法は,投与液量を体重100g当たり0.5mLとし,テフロン製胃ゾンデを装着した注射筒を用いて1日1回,交配開始14日前から雄は44日間,雌は分娩後の哺育3日(41〜45日間)まで,経口投与した.対照群には,被験物質の溶媒として用いた1 %メチルセルロース水溶液を同様に投与した.
4. 観察および検査
1) 親動物に関する項目
(1) 一般状態観察
投与期間中毎日,動物の生死,外観,行動等について観察した.
(2) 体重および摂餌量測定
体重の測定は,投与開始日(投与開始直前)およびその後は7日間隔で行い,さらに最終投与日と屠殺日に測定した.ただし,雌の妊娠後は,妊娠0,7,14および20日と哺育0および4日に測定した.摂餌量は,体重測定日に合わせて翌日までの24時間の飼料消費量を測定した.雌の哺育4日の摂餌量は,前日からの24時間消費量を測定した.
(3) 交配および分娩状態観察
投与15日の午後に,雄のケージに同一群内の雌を入れ(1対1),交尾が確認されるまで14日間を限度として連続同居させた.交尾の確認は毎朝一定時刻(9:30分頃)に行い,膣栓形成あるいは膣垢中に精子が確認された日を妊娠0日とした.分娩状態の観察も同じ時刻に行い,1腹ごとに分娩の終了が確認された日を哺育0日とした.交配および分娩の観察結果から,各群について同居開始から交尾までの日数,交尾率〔(交尾動物数/同居動物数)×100〕,受胎率〔(受胎雌数/交尾成立雌数)×100〕および出産率〔(生児出産雌数/生存受胎雌数)×100〕ならびに分娩の確認された例について妊娠期間(妊娠0日から分娩が確認された日までの日数)を算定した.
(4) 雄の臨床病理学検査
尿検査:投与39日あるいは42日に新鮮尿を採取して,pH,潜血,タンパク,糖,ケトン体,ビリルビンおよびウロビリノーゲン〔以上,バイエル・三共(株),マルティスティックス®〕を,またラットを代謝ケージに収容(約3時間)して得た蓄尿について,外観の観察,比重の測定〔エルマ光学(株),屈折計〕ならびに尿沈渣の検査〔URI-CELL®液(ケンブリッジケミカルプロダクト社)で染色して鏡検〕を行った.
血液学検査:採血は,投与期間終了翌日にエーテル麻酔下で開腹して腹大動脈より行なった.動物は採血前日の午後5時より除餌し,水のみを給与した.採取した血液は3分割し,その一部は,EDTA-2Kで凝固防止処理し,多項目自動血球計数装置〔東亜医用電子(株),E-4000〕により,赤血球数(電気抵抗検出方式),血色素量(ラウリル硫酸ナトリウム-ヘモグロビン法),ヘマトクリット値(パルス検出方式),平均赤血球容積(MCV),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC,以上計算値),白血球数および血小板数(以上,電気抵抗検出方式)を,また塗抹標本を作製して網状赤血球数(Brilliant cresyl blueで染色して鏡検)を測定した.また 一部は,3.8 %クエン酸ナトリウム液で凝固阻止処理して血漿を得,血液凝固自動測定装置(アメルング社:KC-10A)により,プロトロンビン時間(PT,Quick一段法)および活性化部分トロンボプラスチン時間(APTT,エラジン酸活性化法)を測定した.
血液生化学検査:採取した血液の一部から血清を分離し,生化学自動分析装置〔日本電子(株),JCA-VX-1000型クリナライザー〕により,総タンパク(Biuret法),アルブミン(BCG法),A/G比(計算値),グルコース,トリグリセライド,総コレステロール(以上,酵素法),総ビリルビン(Jendrassik法),尿素窒素(Urease-UV法),クレアチニン(Jaff 法),GOT,GPT,γ-GTP,LDH(以上,SSCC法),アルカリホスファターゼ(ALP, GSCC法),コリンエステラーゼ(ChE, BTC-DTNB法),カルシウム(OCPC法)および無機リン(酵素法)を,また電解質自動分析装置〔東亜電波工業(株),NAKL-132〕により,ナトリウム,カリウムおよび塩素を測定した.
法),GOT,GPT,γ-GTP,LDH(以上,SSCC法),アルカリホスファターゼ(ALP, GSCC法),コリンエステラーゼ(ChE, BTC-DTNB法),カルシウム(OCPC法)および無機リン(酵素法)を,また電解質自動分析装置〔東亜電波工業(株),NAKL-132〕により,ナトリウム,カリウムおよび塩素を測定した.
(5) 病理学検査
雄は採血に続いて,また雌は計画殺動物は哺育4日の観察終了後に,対照群,300および1000 mg/kg群で各1匹認められた妊娠の成立しなかった雌,および30 mg/kg群で1匹認められた分娩予定日を過ぎても分娩が認められなかった雌については分娩予定日の4日後に,300および1000 mg/kg群で各1匹認められた交尾しなかった雌については交配期間終了日に,それぞれエーテル麻酔下で放血屠殺して剖検し,脳,下垂体,心臓,肝臓,腎臓,脾臓,副腎,胸腺ならびに雄の精巣,精巣上体を秤量(絶対重量)し,対体重比(相対重量)を算出した.雌については,卵巣の黄体数および子宮の着床痕数を調べ,着床率〔(着床痕数/黄体数)×100〕を算定した.病理組織学検査は,採取した器官を10 %中性リン酸緩衝ホルマリン液(精巣および精巣上体のみブアン液)で固定後,対照群および1000 mg/kg群の全例,ならびに他の群の交尾あるいは妊娠の成立しなかった雌雄の脳,下垂体,胸腺,心臓,肺,肝臓,腎臓,副腎,脾臓,膀胱,骨髄,その他肉眼的異常部位,さらに,雄では精巣,精巣上体について実施した.また,交尾・妊娠不成立の雌雄および分娩予定日を過ぎても分娩が認められなかった雌について,雄は前立腺および精嚢,雌は卵巣および子宮についても検査した.30,100および300 mg/kg群で交尾および妊娠が成立し,哺育も順調であった雌雄については,1000 mg/kg群で毒性影響と考えられる変化の認められた雌の肝臓および肉眼的異常部位を検査した.検査は常法に従いパラフィン切片を作製し,H・E染色を施して鏡検した.また,沈着物を同定するため一部の例の肝臓および腎臓についてPAS染色,脾臓について鉄染色(ベルリンブルー法)を行ったほか,肝臓については凍結切片を作製し脂肪染色(スダン )も行った.
)も行った.
2) 新生児に関する項目
(1) 産児数および性比の観察
分娩の終了後各腹の産児数(生児と死亡児の合計)を調べ,分娩率〔(総出産児数/着床痕数)×100〕を算定した.また,性別を肛門と生殖突起の距離の長短により判定し,群ごとの性比を算出した.
(2) 外表異常および一般状態観察
新生児について口腔内を含む外表の異常を観察した.また,毎日一般状態および生死を確認し,出生率〔(出産確認時生児数/総出産児数)×100〕および新生児の4日の生存率〔(哺育4日生児数/出産確認時生児数)×100〕を求めた.
(3) 体重測定
新生児について哺育0日および4日に雌雄別に各腹ごとの総体重を測定し,1匹当たりの平均体重を算出した.
(4) 病理学検査
死亡例はその都度,生存例は雌親の解剖時(哺育4日) にエーテル・クロロホルムで麻酔死させ,胸腹部における主要器官を肉眼的に観察した.
5. 統計解析
パラメトリックデータは,Bartlettの分散検定を行い,分散が一様な場合は一元配置の分散分析を行った.分散が一様でない場合およびノンパラメトリックデータは,Kruskal-Wallisの順位検定を行った.それらの結果有意差を認めた場合,Dunnett法またはScheffe法(群の大きさが異なる場合)により対照群に対する各群の比較検定を行った.カテゴリカルデータは,生殖発生毒性に関するパラメータはχ^2検定を,病理学的検査における異常例の出現率にはFisherの直接確率法を用いた.なお,新生児に関するデータは,1腹当たりの平均を1標本とした.
結果
1. 反復投与毒性
1) 一般状態および死亡
死亡は,各群の雌雄とも認められなかった.一般状態については,1000 mg/kg群で雄4匹に自発運動の低下が投与16日以降認められた.雌には,変化は認められなかった.なお,被験物質の投与とは無関係に,脱毛が100 mg/kg群の雌3匹(いずれも両前腕),300 mg/kg群の雄2匹(両あるいは右前腕),1000 mg/kg群の雌1匹(両前腕)に,紅涙が30 mg/kg群および1000 mg/kgの雌で各1匹に認められた.また,痂皮形成/脱毛(右肩部)が300 mg/kg群の雌1匹に認められた.
2) 体重(Fig. 1, 2)
雌雄とも,被験物質の投与による有意な変化は認められなかった.また,投与期間中の体重増加量にも有意な差は認められなかった.なお,雌では1000 mg/kg群で哺育0〜4日間の体重増加量が有意に低値を示したが,これは哺育0日の体重が対照群に比べ高値傾向にあったための変化で,哺育4日の体重には対照群と差は認められなかった.
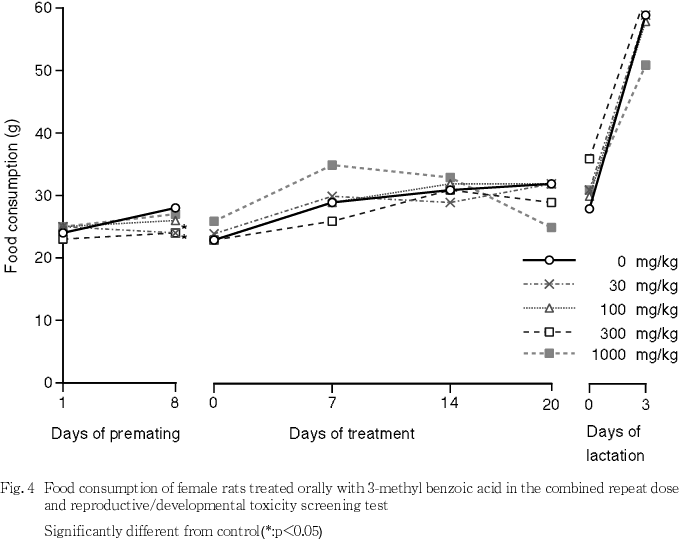
3) 摂餌量(Fig. 3, 4)
雌雄とも,被験物質の投与による有意な変化は認められなかった.なお,雌の30および300 mg/kg群で投与8日の摂餌量が対照群に比べ有意に低値を示したが,用量依存性のない変化であった.
4) 雄の尿検査
各検査項目とも,被験物質の投与による有意な変化は認められなかった.
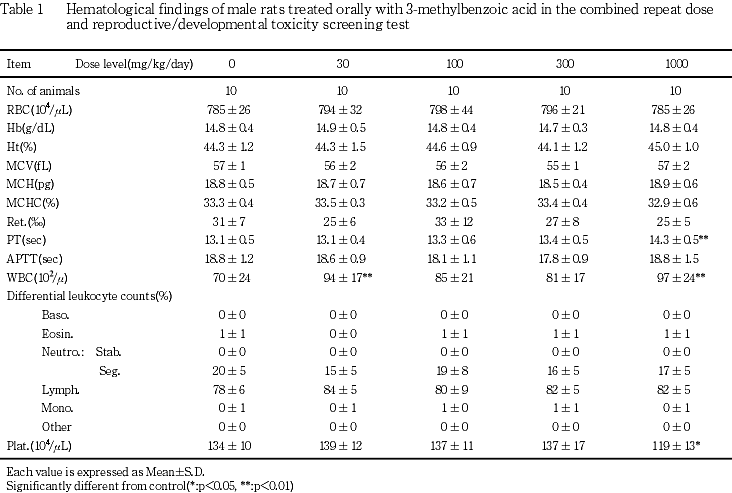
5) 雄の血液学検査(Table 1)
1000 mg/kg群で,プロトロンビン時間の有意な延長および血小板数の有意な減少が認められた.なお,30および1000 mg/kg群で白血球数が対照群に比べ有意に高値を示したが,用量依存性が認められず,また背景データにおける正常範囲内の変動であった.
6) 雄の血液生化学検査(Table 2)
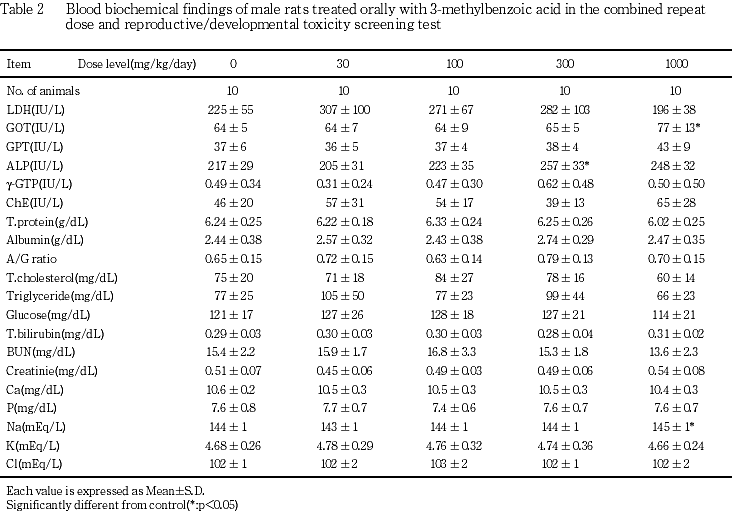
1000 mg/kg群でGOTおよびナトリウムの有意な増加が認められた.ナトリウムの増加はごく軽微な変化であった.なお,300 mg/kg群でアルカリフォスファターゼが対照群に比べ有意に高値を示したが,1000 mg/kg群では変化は認められず,また背景データにおける正常範囲内の変動であった.
7) 剖検
雌雄とも,被験物質の投与と関連性がみられる変化は認められなかった.被験物質の投与とは無関係に,雌において肺の赤/黒色点が対照群,30および300 mg/kg群の各1匹,胸腺の赤色点/域が対照群,100および300 mg/kg群の各1匹,ならびに脾臓の隆起部が30 mg/kg群の1匹に認められた.また,30 mg/kg群で分娩予定日を過ぎても分娩が認められなかった1匹には,子宮に出血を伴った胎盤遺残が認められた.
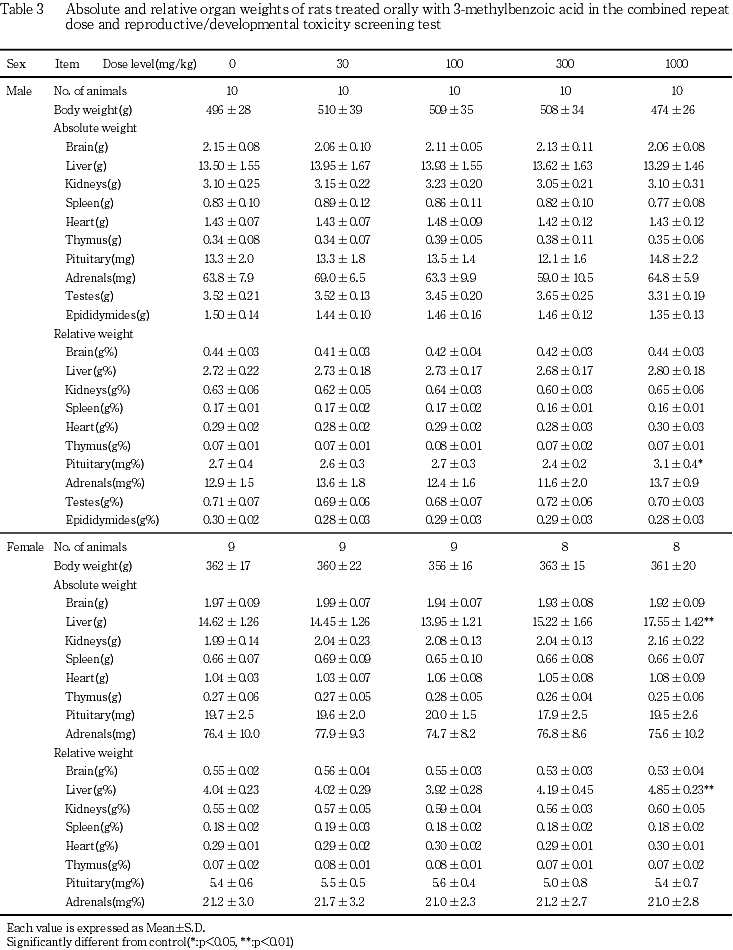
8) 器官重量(Table 3)
雄では,1000 mg/kg群で最終体重の減少傾向および下垂体の相対重量の有意な増加が認められた.雌では,1000 mg/kg群で肝臓の絶対および相対重量の有意な増加が認められた.
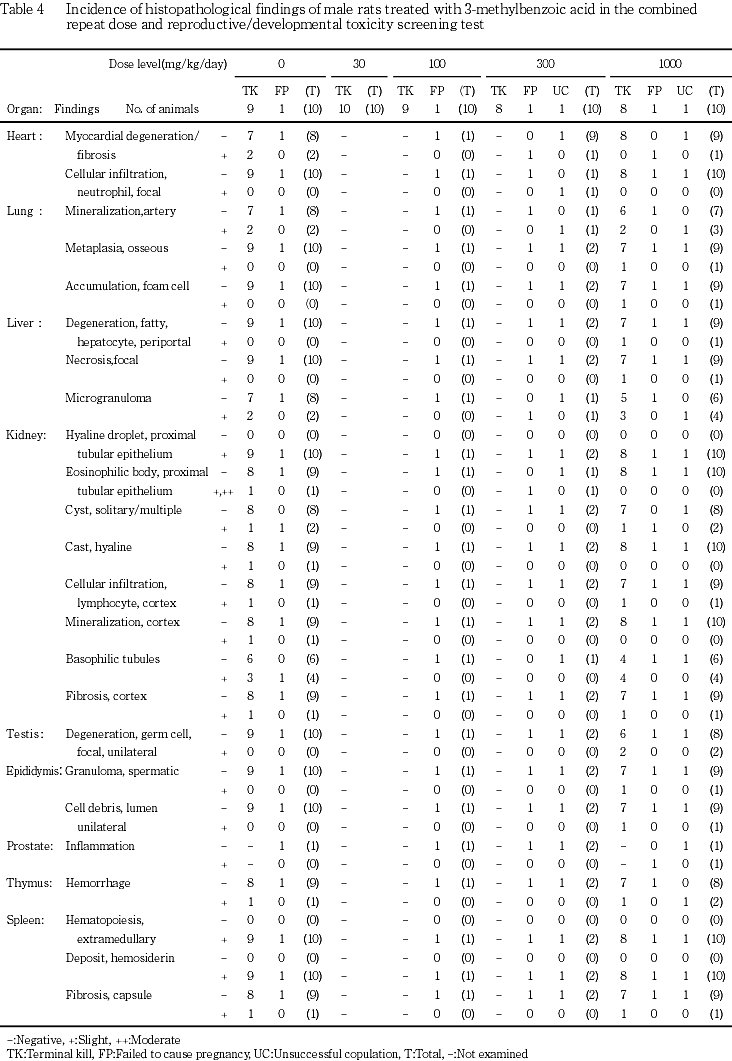
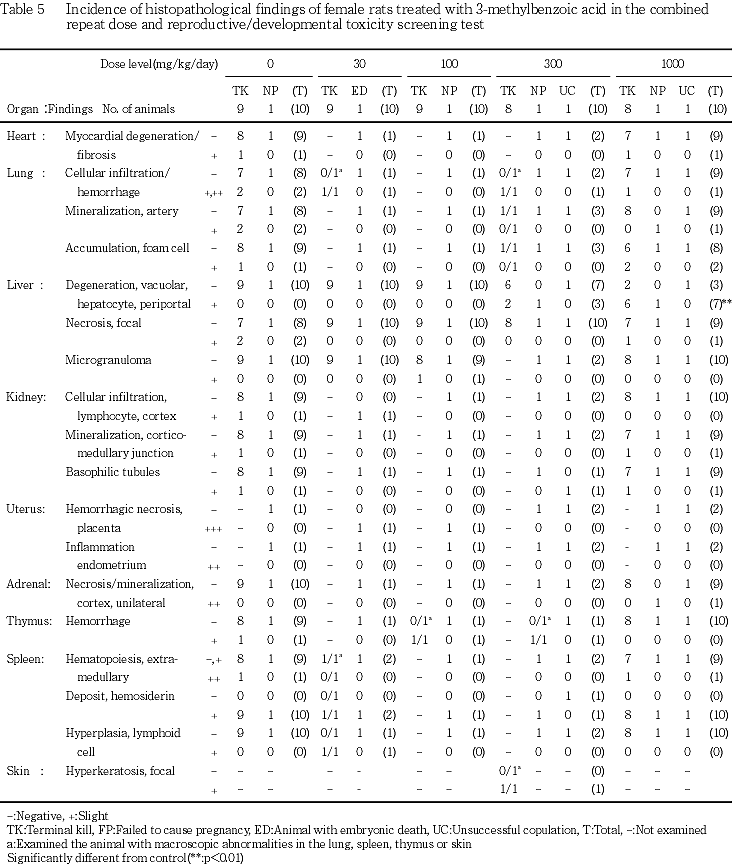
9) 病理組織学検査(Tables 4, 5)
雄では,被験物質の投与と関連する変化は認められなかった.雌では,被験物質の投与に起因すると考えられる変化として,肝臓に門脈周囲性の肝細胞空胞変性が300 mg/kg群で3匹にみられ,1000 mg/kg群では7匹と有意に増加した.この空胞はズダン 染色陰性で,PAS染色によりグリコーゲンの蓄積を示唆する所見も認められなかった.被験物質の投与とは無関係と考えられる変化として,雄で腎臓の近位尿細管上皮におけるPAS染色陽性硝子滴の出現,ならびに雌雄に脾臓における髄外造血巣およびベルリンブルー陽性ヘモジデリン沈着が,対照群および1000 mg/kg群の全例に認められた.しかし,変化の程度は両群間に差は認められなかった.また,1000 mg/kg群の雄で精巣の精細胞変性が2匹に認められたが,限局性,かつ,片側性の変化であった.一般状態の観察で認められた脱毛部位には皮膚の角化亢進が,剖検で認められた肺の赤/黒色点および胸腺の赤色点/域には出血が,また隆起した脾臓にはリンパ様増生が認められた.また,各群に散発的に認められた妊娠不成立の雌雄で,妊娠不成立と関連すると考えられる変化としては,雄で前立腺の炎症が1000 mg/kg群の1匹に,雌で子宮内膜の炎症が100 mg/kg群の1匹に認められた.また,分娩予定日が過ぎても分娩が認められず,剖検で胎盤遺残が認められた30 mg/kg群の雌の1匹には,胎盤の出血性壊死が認められた.これらの変化以外にも,検査した各器官に変化が認められたが,散発的なあるいは用量依存性の認められない所見であった.
染色陰性で,PAS染色によりグリコーゲンの蓄積を示唆する所見も認められなかった.被験物質の投与とは無関係と考えられる変化として,雄で腎臓の近位尿細管上皮におけるPAS染色陽性硝子滴の出現,ならびに雌雄に脾臓における髄外造血巣およびベルリンブルー陽性ヘモジデリン沈着が,対照群および1000 mg/kg群の全例に認められた.しかし,変化の程度は両群間に差は認められなかった.また,1000 mg/kg群の雄で精巣の精細胞変性が2匹に認められたが,限局性,かつ,片側性の変化であった.一般状態の観察で認められた脱毛部位には皮膚の角化亢進が,剖検で認められた肺の赤/黒色点および胸腺の赤色点/域には出血が,また隆起した脾臓にはリンパ様増生が認められた.また,各群に散発的に認められた妊娠不成立の雌雄で,妊娠不成立と関連すると考えられる変化としては,雄で前立腺の炎症が1000 mg/kg群の1匹に,雌で子宮内膜の炎症が100 mg/kg群の1匹に認められた.また,分娩予定日が過ぎても分娩が認められず,剖検で胎盤遺残が認められた30 mg/kg群の雌の1匹には,胎盤の出血性壊死が認められた.これらの変化以外にも,検査した各器官に変化が認められたが,散発的なあるいは用量依存性の認められない所見であった.
2. 生殖発生毒性
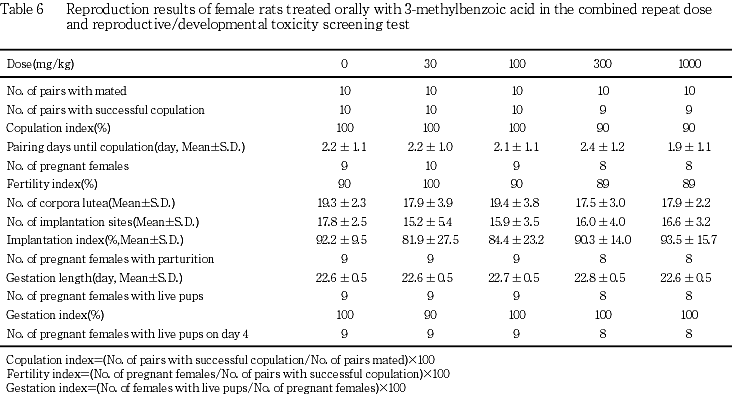
1) 親動物に及ぼす影響(Table 6)
(1) 交尾率および受胎率
交尾しなかった例が300および1000 mg/kg群で,また交尾したが妊娠の成立しなかった例が対照群,100,300および1000 mg/kg群で認められたが,いずれも各々1対のみで,交尾率および受胎率には有意な変化は認められなかった.また,交配開始から交尾までの日数にも有意な変化は認められなかった.
(2) 黄体数,着床痕数および着床率
黄体数,着床痕数および着床率について,有意な変化は認められなかった.
(3) 出産率および妊娠期間
妊娠は成立したが分娩が認められない例が30 mg/kg 群で1匹認められたのみで,出産率に有意な変化は認められなかった.また,妊娠期間についても有意な変化は認められなかった.
(4) 分娩および哺育状態
被験物質の投与に起因する分娩および哺育状態の変化は認められなかった.被験物質の投与とは無関係と考えられる変化として,分娩状態については,30 mg/kg群の1匹は妊娠26日においても分娩せず,剖検では,左子宮角内に胎児のない1個の胎盤が認められ,他に着床痕は認められなかった.また,300 mg/kg群の1匹は17匹出産したが,その内7匹は死産であった.哺育状態については,対照群の1匹が哺育0日に新生児1匹,1000 mg/kg群の1匹が哺育0日に新生児3匹および同群の他の2匹が哺育1日に各々新生児1匹を食殺した.しかし,哺育1〜2日以降はいずれも哺育状態に変化は認められなかった.
2) 新生児に及ぼす影響
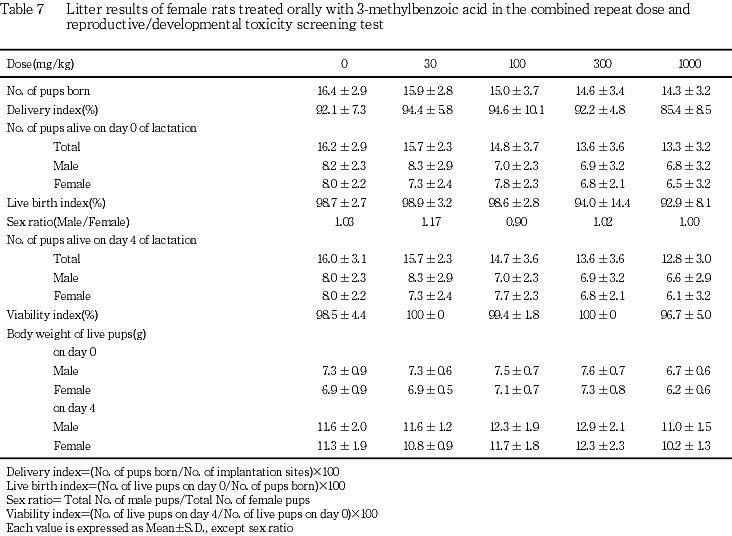
(1) 生存性および体重(Table 7)
新生児の生存性に関する各指標および体重について, 1000 mg/kg群で総出産児数,生児数,分娩率,出生率および哺育0日の新生児体重は対照群と比べやや低値を示したが,いずれも統計学的に有意な差ではなかった.出産児の性比,哺育4日の体重および哺育4日の生存率には変化は認められなかった.
(2) 形態
被験物質の投与に起因する外表および内臓異常ならびに内臓変異は認められなかった.被験物質の投与とは無関係な変化として,30 mg/kg群の1匹に痕跡尾,癒合腎および精巣低形成など外表および内臓にわたる複合異常が認められた.また,内臓変異について,300 mg/kg群で胸腺の頚部遺残,1000 mg/kg群で左臍動脈遺残が対照群と比べ高値を示し,またこれらに伴い300 mg/kg以上の群で内臓変異数が高値を示したが,いずれも統計学的に有意な変化ではなかった.その他に,1000 mg/kg群で腎盂拡張が1匹に認められた.
考察および結論
1. 反復投与毒性
3-メチル安息香酸のラットへの反復投与において,主に肝臓に対する毒性影響が認められた.すなわち,雌において,肝臓の絶対および相対重量の増加が1000 mg/kg群に認められ,病理組織学的に肝細胞の空胞変性が300 mg/kg以上の群に観察された.雄においては,肝臓に重量および病理組織学的変化は認められなかったが,血液生化学検査でGOTの増加が1000 mg/kg群に認められ,肝臓に対する影響が窺われた.また,血液学検査で1000 mg/kg群の雄に認められたプロトロンビン時間の延長も,肝臓に対する影響と関連する変化と考えられる.
3-メチル安息香酸はm-キシレンの中間代謝物として知られており2),m-キシレンは肝毒性を有することが報告3)されているが,本試験では3-メチル安息香酸も肝臓に対する毒性影響の有ることが確認された.また,類縁化合物であるメチル化ベンゼン類のラットへの反復投与により発現する肝障害は肝細胞における空胞形成を特徴とする5)が,3-メチル安息香酸においても雌で類似した形態的変化が観察された.
肝臓に対する影響に加えて,1000 mg/kg群で血小板数の減少,血清ナトリウムの増加,下垂体の相対重量の増加並びに自発運動の低下が,いずれも雄に認められた.
血小板数の減少については,14日間反復投与による投与量設定試験では雌雄に認められており6),プロトロンビン時間の延長と併せて,3-メチル安息香酸の血液凝固系に対する影響が示唆された.しかし,病理組織学検査では骨髄や脾臓の造血細胞に変化は認められず,また血小板数の減少の程度も軽度なものであった.
以上の結果から,3-メチル安息香酸の主な反復投与毒性は肝臓に対する影響であり,血液凝固系および下垂体重量に対する影響も認められた.無影響量は,雄で300 mg/kg/day,雌で100 mg/kg/dayと推定された.
2. 生殖発生毒性
雄親および雌親の生殖能に対する被験物質の投与による影響について,観察した各指標とも対照群と比べ有意な変化は認められなかった.
児動物の発生に対する影響については,1000 mg/kg群で総出産児数,生児数,分娩率,出生率および哺育0日の新生児体重が減少傾向を示し,軽微な影響が認められたが,いずれも統計学的には対照群と比べ有意な差は認められなかった.
したがって,無影響量は,雌雄親に対する生殖能および児動物の発生に対して,いずれも1000 mg/kg/dayと推定された.
文献
| 1) | 化学工業日報社編,"12394の化学商品,"化学工業日報社,東京,1994, p. 610. |
| 2) | 山本郁男,"薬物代謝学辞典,"廣川書店,東京,1994, p. 110. |
| 3) | L. W. Condie, J. R. Hill and J. F. Borzelleca, Drug and Chemical Toxicology, 11(4), 329(1988). |
| 4) | M. L. Richardson and S. Gangolli, "The dictionary of substances and their effects," vol. 7(S-Z), The royal society of chemistry, Cambridge, 1994, pp. 487-488. |
| 5) | D. E. Bowers, M. S. Cannon and D. H. Jones, Am. J. Vet. Res., 43(4), 67(1982). |
| 6) | 山本 譲,「3-メチル安息香酸のラットを用いる経口投与による反復投与毒性・生殖発生毒性併合試験のための投与量設定試験」,所内資料,1998. |
| 連絡先 |
| 試験責任者: | 山本 譲 |
| 試験担当者: | 伊藤義彦,野田 篤,伊藤雅也,赤木 博,星 史子 |
| (財)畜産生物科学安全研究所 |
| 〒229-1132 神奈川県相模原市橋本台3-7-11 |
| Tel 042-762-2775 | Fax 042-762-7979 | |
| Correspondence |
| Authors: | Yuzuru Yamamoto(Study director)
Yoshihiko Ito, Atushi Noda, Masaya Ito, Hiroshi Akagi, Satoko Hoshi |
| Research Institute for Animal Science in Biochemistry and Toxicology |
| 3-7-11 Hashimotodai, Sagamihara-shi, Kanagawa, 229-1132, Japan |
| Tel +81-42-762-2775 | Fax +81-42-762-7979 | |
 法),GOT,GPT,γ-GTP,LDH(以上,SSCC法),アルカリホスファターゼ(ALP, GSCC法),コリンエステラーゼ(ChE, BTC-DTNB法),カルシウム(OCPC法)および無機リン(酵素法)を,また電解質自動分析装置〔東亜電波工業(株),NAKL-132〕により,ナトリウム,カリウムおよび塩素を測定した.
法),GOT,GPT,γ-GTP,LDH(以上,SSCC法),アルカリホスファターゼ(ALP, GSCC法),コリンエステラーゼ(ChE, BTC-DTNB法),カルシウム(OCPC法)および無機リン(酵素法)を,また電解質自動分析装置〔東亜電波工業(株),NAKL-132〕により,ナトリウム,カリウムおよび塩素を測定した.
 法),GOT,GPT,γ-GTP,LDH(以上,SSCC法),アルカリホスファターゼ(ALP, GSCC法),コリンエステラーゼ(ChE, BTC-DTNB法),カルシウム(OCPC法)および無機リン(酵素法)を,また電解質自動分析装置〔東亜電波工業(株),NAKL-132〕により,ナトリウム,カリウムおよび塩素を測定した.
法),GOT,GPT,γ-GTP,LDH(以上,SSCC法),アルカリホスファターゼ(ALP, GSCC法),コリンエステラーゼ(ChE, BTC-DTNB法),カルシウム(OCPC法)および無機リン(酵素法)を,また電解質自動分析装置〔東亜電波工業(株),NAKL-132〕により,ナトリウム,カリウムおよび塩素を測定した.
 )も行った.
)も行った.







 染色陰性で,PAS染色によりグリコーゲンの蓄積を示唆する所見も認められなかった.被験物質の投与とは無関係と考えられる変化として,雄で腎臓の近位尿細管上皮におけるPAS染色陽性硝子滴の出現,ならびに雌雄に脾臓における髄外造血巣およびベルリンブルー陽性ヘモジデリン沈着が,対照群および1000 mg/kg群の全例に認められた.しかし,変化の程度は両群間に差は認められなかった.また,1000 mg/kg群の雄で精巣の精細胞変性が2匹に認められたが,限局性,かつ,片側性の変化であった.一般状態の観察で認められた脱毛部位には皮膚の角化亢進が,剖検で認められた肺の赤/黒色点および胸腺の赤色点/域には出血が,また隆起した脾臓にはリンパ様増生が認められた.また,各群に散発的に認められた妊娠不成立の雌雄で,妊娠不成立と関連すると考えられる変化としては,雄で前立腺の炎症が1000 mg/kg群の1匹に,雌で子宮内膜の炎症が100 mg/kg群の1匹に認められた.また,分娩予定日が過ぎても分娩が認められず,剖検で胎盤遺残が認められた30 mg/kg群の雌の1匹には,胎盤の出血性壊死が認められた.これらの変化以外にも,検査した各器官に変化が認められたが,散発的なあるいは用量依存性の認められない所見であった.
染色陰性で,PAS染色によりグリコーゲンの蓄積を示唆する所見も認められなかった.被験物質の投与とは無関係と考えられる変化として,雄で腎臓の近位尿細管上皮におけるPAS染色陽性硝子滴の出現,ならびに雌雄に脾臓における髄外造血巣およびベルリンブルー陽性ヘモジデリン沈着が,対照群および1000 mg/kg群の全例に認められた.しかし,変化の程度は両群間に差は認められなかった.また,1000 mg/kg群の雄で精巣の精細胞変性が2匹に認められたが,限局性,かつ,片側性の変化であった.一般状態の観察で認められた脱毛部位には皮膚の角化亢進が,剖検で認められた肺の赤/黒色点および胸腺の赤色点/域には出血が,また隆起した脾臓にはリンパ様増生が認められた.また,各群に散発的に認められた妊娠不成立の雌雄で,妊娠不成立と関連すると考えられる変化としては,雄で前立腺の炎症が1000 mg/kg群の1匹に,雌で子宮内膜の炎症が100 mg/kg群の1匹に認められた.また,分娩予定日が過ぎても分娩が認められず,剖検で胎盤遺残が認められた30 mg/kg群の雌の1匹には,胎盤の出血性壊死が認められた.これらの変化以外にも,検査した各器官に変化が認められたが,散発的なあるいは用量依存性の認められない所見であった.



