200 mg/kg群においても,雌雄で肝臓および腎臓,雌で胸腺に同様な組織変化が,雄で GPTの上昇が認められた.雄の血液学検査では被験物質の影響は認められなかった.
新生児の検査において,1000 mg/kg群で体重がやや小さく,また2腹の全新生児死亡のため4日生存率が若干低下した.出産児数,出産生児数,性比,出生率,外表,一般状態,出生後の体重増加量および剖検においては被験物質の影響は認められなかった.
以上の結果より,1-メチルエテニルベンゼンの反復投与毒性に関する無影響量は雌雄とも40 mg/kg/day, 生殖発生毒性に関する無影響量は,親動物に対して雄が1000 mg/kg/day,雌が200 mg/kg/day,児動物に対しては200 mg/kg/dayと考えられる.
検疫・馴化期間を含めた全飼育期間中,温度20〜25℃,湿度40〜70%R.H.,換気約12回/時,照明12時間/日(7:00〜19:00)に自動調節された飼育室を使用した.動物は実験動物用床敷(ベータチップ:日本チャールス・リバー)を敷いたポリカーボネート製ケージに,1ケージあたり投与開始後は1匹,交配期間中は雌雄各1匹,哺育期間は1腹で収容し, 飼育した.
動物には,オートクレーブ滅菌した実験動物用固型飼料(CRF-1:オリエンタル酵母工業) および5μmのフィルター濾過後,紫外線照射した水道水をそれぞれ自由摂取させた.
投与期間は,雌雄とも交配前14日間,交配期間中,および雄は計画殺前日までの計43日間,雌は交尾成立後分娩を経て哺育3日までとし,オリーブ油に溶解させた被験物質を胃管を用いて1日1回,午前中に強制経口投与した.投与液量は5 ml/kgとし,至近測定日の体重を基に算出した.
投与液の調製はイエローランプ照明下で行い, 投与に供するまで冷蔵・遮光保存した.また, 投与開始前に投与液の安定性および濃度を確認した.
 ),総ビリルビン(Jendrassik改良法),総蛋白(Biuret法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出), カルシウム(O-CPC法),無機リン(UV法),ナトリウム, カリウム, クロライド(イオン選択電極法)を自動分析装置(日立736-10形:日立製作所)により測定した.
),総ビリルビン(Jendrassik改良法),総蛋白(Biuret法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出), カルシウム(O-CPC法),無機リン(UV法),ナトリウム, カリウム, クロライド(イオン選択電極法)を自動分析装置(日立736-10形:日立製作所)により測定した.
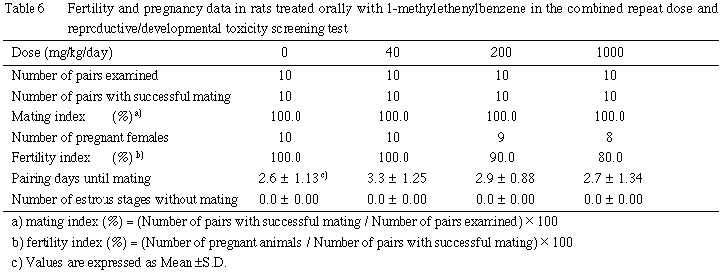
哺育4日の解剖時に卵巣,子宮を摘出して黄体数および着床数を検査した.交尾確認後25日を経ても分娩しない雌は剖検し,肉眼的に着床が認められない動物の子宮については,2%KOH水溶液に浸漬し,着床の有無を確認した. これらの結果から, 妊娠期間(妊娠0日から出産が確認された日までの期間), 出産率([生児出産雌数/受胎雌数]×100),着床率([着床数/黄体数]×100),分娩率([総出産児数/着床数]×100)を算出した.
哺育0日に出産児数,出産生児数,死産児数,性別および外表異常の有無を検査した.その後,一般状態,死亡の有無を毎日観察した.死亡動物は食殺等で検査に耐えないものを除き,10%リン酸緩衝中性ホルマリン液に浸漬・固定後,実体顕微鏡下で剖検した.哺育0および4日の生存児数から出生率([出産生児数/総出産児数]×100),4日生存率([哺育4日生児数/出産生児数]×100)を算出した.
(2)体重
哺育0日および4日に1腹毎に雌雄単位でまとめて測定し,それぞれの平均値を算出した.また,哺育0日の体重を基準に体重増加量を算出した.
(3)剖検
全ての生存児について哺育4日に口腔を含む外表を検査した後,チオペンタールナトリウムの腹腔内投与による麻酔下で開腹し,腹大動脈切断により放血致死させ剖検した.
 法またはScheff
法またはScheff 型により多重比較を行った.ただし,下記 * 印の項目については,Kruskal-Wallisの検定から行った.計数データはFisherの直接確率法により検定した.有意水準は5%以下とした.新生児に関するデータについては,各母動物毎に算出した平均値を統計単位とした.以下に検定の対象となる項目を示す.
型により多重比較を行った.ただし,下記 * 印の項目については,Kruskal-Wallisの検定から行った.計数データはFisherの直接確率法により検定した.有意水準は5%以下とした.新生児に関するデータについては,各母動物毎に算出した平均値を統計単位とした.以下に検定の対象となる項目を示す.
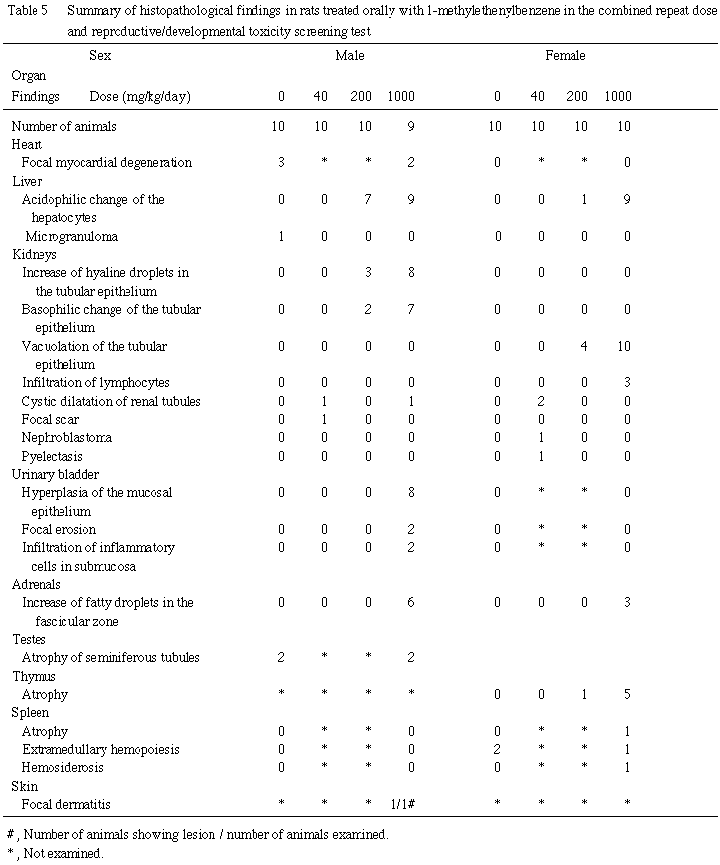
その他,偶発性と考えられる所見として,脱毛,外傷あるいは痂皮が対照および1000 mg/kg群の雄各1例,200 mg/kg群の雌1例に観察された.

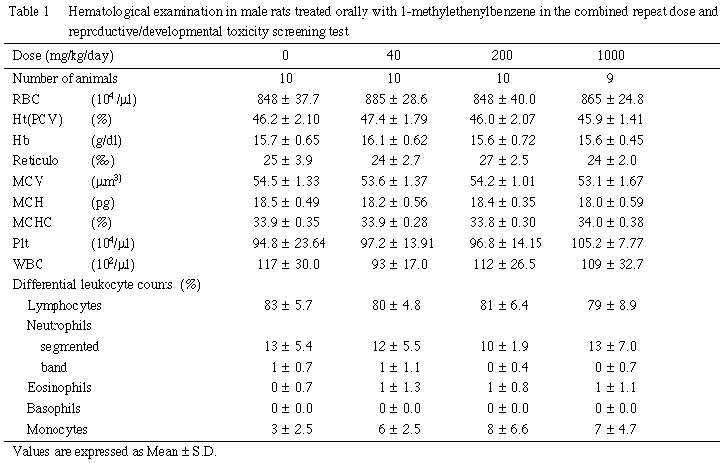
その他に,200 mg/kg群の総コレステロールが高値を,1000 mg/kg群のグルコースおよびクロライドが低値を示したが,用量との関係が不明確か,または生理的変動範囲内の変化であることから偶発的な変化と判断した.
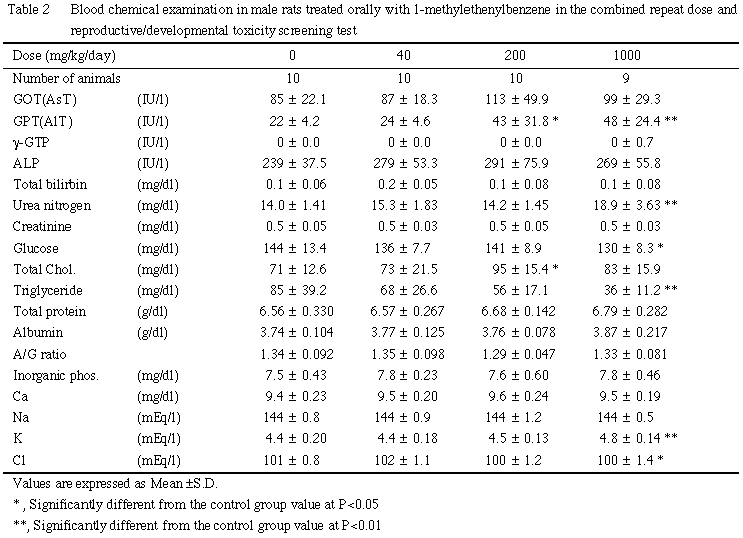
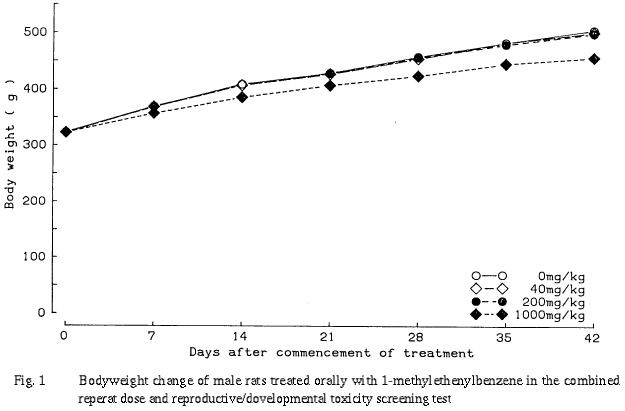
なお,1000 mg/kg群の精巣の対体重比が高値を示したが,実重量では対照群と有意な差がなく,また組織検査および生殖機能検査においても被験物質に起因する変化が認められなかったことから,体重増加抑制が反映した見掛け上の変化と判断した.
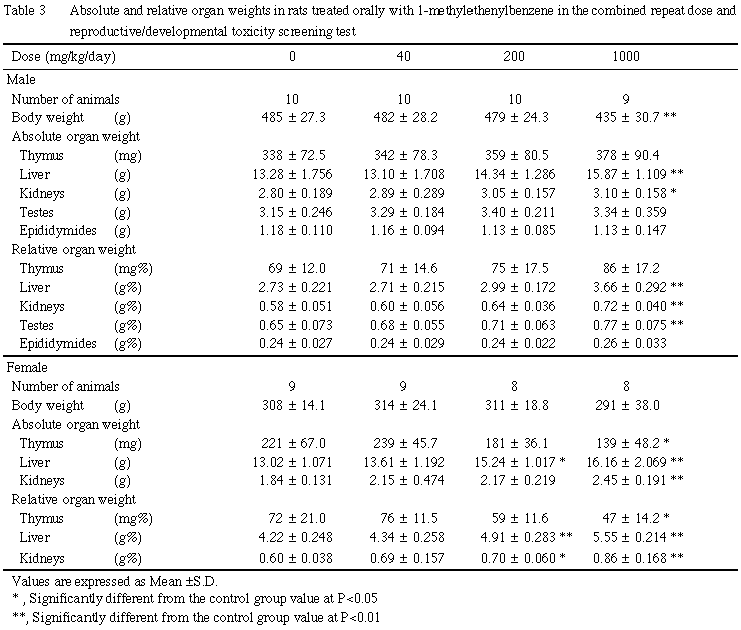
肝臓では腫大が1000 mg/kg群の雌雄に,暗赤色化が200 mg/kg以上の群の雄のみに認められた.
腎臓では腫大が1000 mg/kg群の雌雄に,皮髄境界部の褪色が200 mg/kg以上の群の雌のみに認められた.なお,40 mg/kg群の雌1例にも腫大がみられたが,片側のみであったことから偶発病変と判断した.
膀胱では黄色の微細砂粒状の結石が1000 mg/kg群の雄のみに認められた.
副腎では腫大および灰白色化,胸腺では萎縮がそれぞれ1000 mg/kg群の雌に認められた.胸腺の萎縮が認められた1例では,脾臓の萎縮を伴っていた.
その他,片側精巣の萎縮が対照群の雄1例,皮膚の痂皮形成が1000 mg/kg群の雄1例に認められたが,その発現状況から偶発病変と判断した.
死亡した1000 mg/kg群の雄の1例では,膀胱が血様尿を大量に貯留して膨満し,直径1〜2 mm大の膀胱結石が7〜8個認められた.腎臓は腫大し,腎盂腔,尿管,膀胱ならびに膀胱に接している精嚢および前立腺に顕著な出血が認められ,尿閉を起こしていたと思われた.その他肺水腫,脾臓の萎縮が認められた.
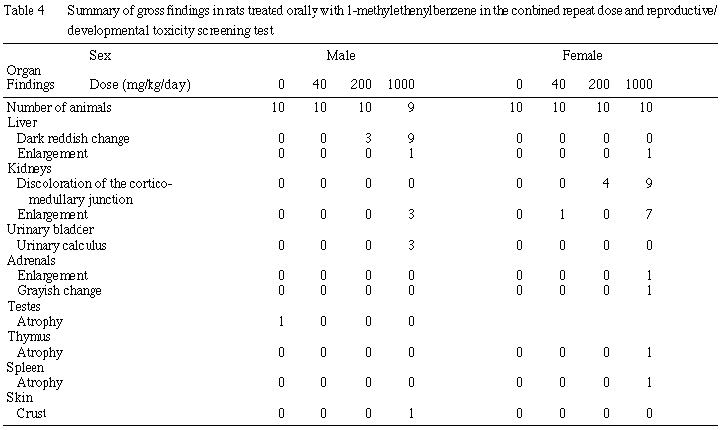
肝臓では肝細胞の好酸性変化が200 mg/kg以上の群の雌雄に認められた.雄では微細顆粒状を呈した好酸性細胞が小葉全体にび漫性に認められ,それに伴って通常みられる脂肪滴が消失していた.一方,雌では小葉中心部に顕著にみられ,肝細胞はやや肥大していた.
腎臓では尿細管上皮の硝子滴の増加が200 mg/kg以上の群の雄に認められ,そのほとんどの例が尿細管上皮の好塩基性変化を伴っていた.また,尿細管上皮の空胞化が200 mg/kg以上の群の雌に認められ,その周囲にリンパ球の浸潤がみられる例が数例あった.この空胞はオイルレッドO染色の結果,赤褐色に染まる脂肪滴であった.なお,剖検で腫大が認められた40 mg/kg群の雌1例の腎臓には本変化は認められなかった.
副腎では束状帯の微細あるいは粗大な脂肪滴の増加が1000 mg/kg群の雌雄に認められた.
膀胱では粘膜上皮の増生が1000 mg/kg群の雄に認められ,粘膜上皮層は正常な例の2〜3倍に肥厚し,びらんと粘膜下織への炎症性細胞の浸潤を伴う例もあった.
胸腺では萎縮が200 mg/kg以上の群の雌に認められ,皮質と髄質の境界が不明瞭になっていた.
その他に認められた変化については,いずれも少数例であり,その発現状況から非特異的な偶発病変と考えられた.なお,非妊娠雌の卵巣には組織学的な変化は認められなかった.
死亡例では腎臓,尿管,膀胱,精嚢および前立腺に出血がみられ,腎臓ではさらに尿細管の拡張および腎乳頭の壊死が認められた.その他肺水腫および脾臓の萎縮も認められた.
哺育期間の観察において,1000 mg/kg群の2例で哺育1日に全新生児の死亡が観察された.これらの母動物のうち1例では新生児への授乳量が少なく,翌日には全新生児を食殺していた.また他の1例では,分娩日の哺育行動には異常はなく,授乳も観察されたが,全新生児が死亡した哺育1日に膣からの出血がみられ,翌日以降は膣と肛門周囲の汚れと哺育4日には自発運動の減少,削痩,立毛が認められた.なお,この2例のうち1例は妊娠後期の体重増加抑制が顕著であり,他の1例も分娩後に著しい体重減少を示した.その他の母動物には異常は認められなかった.
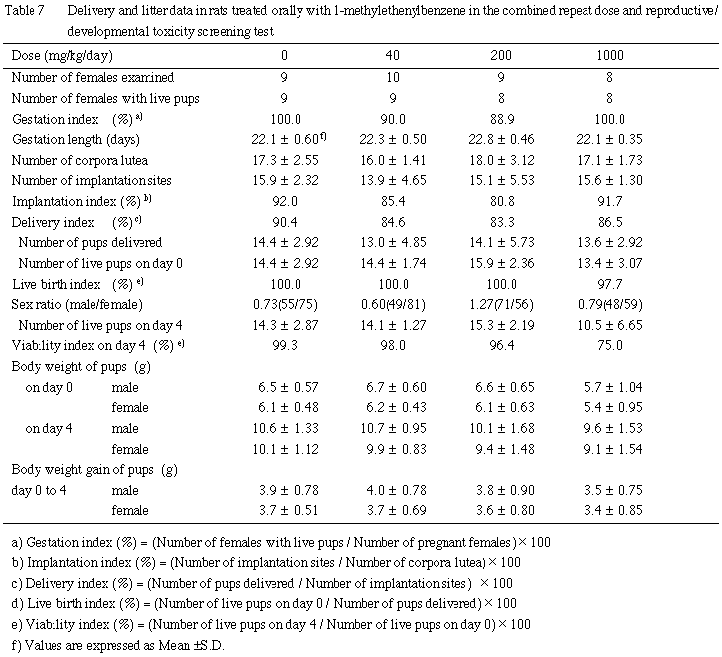
1000 mg/kg群では2腹の全新生児が死亡したため,有意差は認められなかったものの,4日生存率が若干低値を示した.しかし,他の腹では生後の死亡は認められなかった.出産児数,出産生児数,性比および出生率には,対照群と被験物質投与群との間に有意な差は認められなかった.
(2)出生児の観察
いずれの群でも外表異常を示す新生児は認められなかった.生後の一般状態では200 mg/kg群の1例で哺育1日に体色の白色化と喘ぎ呼吸が観察されたのみで,その他の新生児には異常は認められなかった.
(3)体重(Table 7)
1000 mg/kg群において,哺育0日および4日の体重が,有意差は認められなかったものの,雌雄とも若干低値を示した.生後の体重増加量については,各被験物質投与群とも対照群とほぼ同様な値を示した.
(4)剖検
生存動物では,脳の出血点が40 mg/kg群の1例,腎盂拡張が1000 mg/kg群の1腹の2例,尿管の拡張が200 mg/kg群の1例,1000 mg/kg群の1腹の7例に認められた.また,死亡動物では,全新生児が死亡した1000 mg/kg群の2腹で腎盂拡張が18例中7例に観察された.
腎臓および膀胱への影響として,腎臓では重量増加と組織変化が200 mg/kg以上の群の雌雄で,膀胱では粘膜上皮の増生が1000 mg/kg群の雄で認められた.腎臓の尿細管上皮に認められた硝子滴の増加は雄ラットに特異的な変化であり,炭化水素化合物の投与により生じることが知られている2, 3).また,硝子滴が過剰に沈着すると上皮は変性・壊死・脱落を生じ,その反応として好塩基性の再生性上皮が出現する2, 3).本試験においてもこれと同様な一連の変化が認められたことから,他の炭化水素化合物と同様な現象が生じたものと考えられる.また,雄の膀胱において認められた粘膜上皮の増生は,剖検時に観察された結石に起因する上皮の損傷に対する修復像と考えられる1, 4).雄の血液生化学検査で認められた尿素窒素およびカリウムの上昇については,膀胱結石による尿路障害,あるいは腎臓の組織変化に伴った機能障害に起因した変化である可能性が考えられる.
肝臓への影響として,雌雄で肝臓重量の増加および組織変化が,また雄でGPTの上昇が,200 mg/kg以上の群で認められた.一般に,本試験で認められた肝細胞の肥大および好酸性変化は,薬物投与によって薬物代謝酵素の誘導が惹起された際に認められることが知られており,生体の適応現象と考えられている5, 6).しかし,雄では肝臓の脂肪滴の消失および血液生化学検査でトリグリセライドの低下が認められていることから,肝臓での適応範囲を超えて脂質代謝に何らかの影響を及ぼしている可能性が考えられる.また,雌で腎臓の尿細管上皮の脂肪化および雌雄で副腎束状帯の脂肪滴の増加も認められており,これらも脂質代謝への影響に関連した変化7, 8)と考えられる.
その他,胸腺の萎縮が200 mg/kg以上の群の雌で認められた.本変化についてはストレスにより認められる変化でもあり9).本試験の雌では妊娠後期の体重増加抑制に加えて,分娩を経過することにより,動物が過剰なストレス状態にあった可能性が考えられる.
投与直後の流涎が,全被験物質投与群の雄および200 mg/kg以上の群の雌で認められたが,一部には投与直前から反射的に発現する例も観察されたことから,被験物質が有する刺激性10) あるいは物理的性状に起因したもので,毒性学的意義に乏しい変化と判断した.
新生児の検査において,出産児数,出産生児数,性比および出生率には被験物質の影響は認められなかったが,1000 mg/kg群で低体重および4日生存率低下の傾向が認められた.4日生存率の低下については,顕著な母体毒性を示した母動物2例の全新生児が死亡したことによるもので,それ以外の新生児には死亡は認められなかった.また,生存し得た新生児の体重はほぼ順調に増加したことから,新生児の死亡は,被験物質の新生児への直接的な影響よりも,母体毒性による二次的な影響である可能性が高いと考えられる.剖検において,1000 mg/kg群で腎盂拡張および尿管拡張が観察されたが,腎盂拡張は自然発生的にも認められる所見であり,また尿管拡張は1腹のみの発現であったことから,被験物質との関連は明らかでなかった.外表および一般状態では被験物質に起因する異常は認められなかった.
以上のように,本試験では反復投与による影響として,200 mg/kg以上の群で雌雄の腎臓,肝臓および雌の胸腺の組織変化が,また,1000 mg/kg群では雌雄の体重増加抑制,雄の死亡,雄の膀胱および雌雄の副腎の組織変化が認められた.生殖・発生に及ぼす影響として,親動物の生殖機能および分娩には異常は認められなかったが,1000 mg/kg群で母動物の哺育機能および新生児の発育への影響を示唆する変化が認められた.従って,本試験条件下における反復投与毒性に関する無影響量は雌雄とも40 mg/kg/day,生殖発生毒性に関する無影響量は親動物に対して雄が1000 mg/kg/day,雌が200 mg/kg/day,児動物に対しては200 mg/kg/dayと考えられる.
| 1) | C. Gopinath et al., "Atlas of experimental toxicological pathology," MTP Press Limited, Lancaster, 1987, pp.87-90. |
| 2) | P. Greaves, "Histology of preclinical toxicity studies," Elsevier, Amsterdam, 1990, pp. 532-538. |
| 3) | 渡辺満利, "毒性病理学(前川昭彦,林裕造編)," 地人書館, 東京, 1991, pp. 267-293. |
| 4) | E. Kunze, "Urinary system(Jones,T.C. ed.)," Springer-Verlag, Berline, 1986, pp. 291-310. |
| 5) | P. Greaves, "Histology of preclinical toxicity studies, "Elsevier, Amsterdam, 1990, pp. 393-441. |
| 6) | H.W. Altmann, "Drug-induced pathology(Grundmann, E. ed.)," Springer-Verlag, Berlin, 1980, pp. 71-76. |
| 7) | J.E. Fitzgerald et al., Fund.Appl.Toxicol., 6, 520-531(1986). |
| 8) | 榎本 眞, 赤崎兼義, "毒性病理学," ソフトサイエンス社, 東京, 1987, pp. 211-224. |
| 9) | C. Gopinath et al., "Atlas of experimental toxicological pathology," MTP Press Limited, Lancaster, 1987, pp. 122-126. |
| 10) | M.A. Wolf et al., Arch.Ind.Health, 14, 387-398 (1956). |
| 連絡先 | |||
| 試験責任者: | 松浦郁夫 | ||
| 試験担当者: | 藤井佳代,土谷 稔,涌生ゆみ, 豊田直人,高野克代 | ||
| (株)三菱化学安全科学研究所鹿島研究所 | |||
| 〒 314-02 茨城県鹿島郡波崎町砂山14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence | |||
| Authors: | Ikuo Matsuura (Study director) Kayo Fujii, Minoru Tsuchitani, Yumi Wako, Naoto Toyota, Katsuyo Takano | ||
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory | |||
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-02 Japan | |||
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | ||