以上の結果から,本試験条件下では,ρ-tert-ブチルフェノールは雄マウスの骨髄細胞において染色体異常誘発作用あるいは紡錘体形成阻害作用を示さず,さらに骨髄細胞の増殖抑制作用も有しないものと結論した.
投与検体は,被験物質を各濃度ごとに秤量し,乳鉢で磨砕後,0.5 w/v%メチルセルロース水溶液(以下0.5 %MCと略す)を少量ずつ加えながら練り混ぜて懸濁液とし,さらにあわとり練太郎((株)シンキー,AR-360M)を用いて公転速度2000 rpm,自転速度600 rpmで1分間ミキシング後,所定の濃度に調製した.0.5 %MCは,メチルセルロース(50 cP,和光純薬工業(株),ロット番号:KSF7837)を日局注射用水(光製薬(株),製造番号:9912ST)に溶解して調製した.0.500 mg/mLおよび20.0 mg/mLの調製検体については,冷蔵,遮光条件下で24時間安定であることが確認されたことから,投与前日に調製し,遮光条件で気密容器で冷蔵し,24時間以内に投与に用いた.なお,各濃度の投与検体について被験物質の含量を測定した結果,平均含量が調製指示値の90.0〜110 %の範囲内にあることが確認された.
動物は,全飼育期間を通じて,許容温度:21.0〜25.0 ℃,許容湿度:40.0〜75.0 %,換気回数:約15回/時間,照明12時間(7時〜19時)に設定された飼育室内で,床敷として木製チップ(ホワイトフレーク,日本チャールス・リバー(株))を入れたTPX樹脂製ケージに1匹ずつ収容し,固型飼料(CE-2,日本クレア(株))と水道水(秦野市水道局給水)を自由摂取させて飼育した.
以上の結果から,一般状態の変化および最大耐量に著しい性差はないと判断し,小核試験は,雄マウスのみを用いて行うこととした.また,本被験物質の最大耐量は50 mg/kgであることから,小核試験に用いる高用量を50 mg/kgとした.すなわち,被験物質投与群は12.5,25および50 mg/kgの3用量群とし,陰性対照群および陽性対照群を加え,標本作製時期を投与後24および48時間として,各群5匹からなる9群を設けた.なお,陰性対照物質は被験物質の媒体である0.5 %MCを,陽性対照物質はシクロホスファミド(以下CPAと略す)をそれぞれ選択した.被験物質および陰性対照物質はいずれも,注射筒および注射針を用いて,投与直前に測定した体重をもとに個体別の投与液量(10 mL/kg)を算出し,正確な量を腹腔内に単回投与した.陽性対照物質(CPA,Sigma Chemical Co. USA,Lot. No. 108H0568)は,日局生理食塩液((株)大塚製薬工場,製造番号:7H92N)に溶解して所定濃度(5 mg/mL)に調製後,10 mL/kgの液量で強制経口投与した.
陰性対照群と陽性対照群の小核出現頻度が,背景データのばらつきの範囲内(平均値 ± 3 × 標準偏差)にあるか否かを調べた.
小核出現頻度については,陰性対照群と被験物質投与群の間および陰性対照群と陽性対照群の間で,Fisherの正確確率検定法5)(片側検定)により有意差検定を行った.なお,検定にあたっては,多重性を考慮してBonferroniの補正6)を行った.また,小核出現頻度の用量(対数値)依存性について,Cochran-Armitageの傾向検定7)(片側検定)を行った.
(赤血球中に占める幼若赤血球の比率)
骨髄細胞の増殖抑制の指標としての幼若赤血球の比率について,まずBartlett検定5)により陽性対照群を除く各群の分散の一様性の検定を行った.その結果,いずれも等分散であったことからDunnett検定8)を用いて陰性対照群と各被験物質投与群との平均値の差の検定を行った.陰性対照群と陽性対照群との比較については,F検定5)により分散の一様性の検定を行い,等分散であったことからStudentのt検定5)を行った.
(判定)
被験物質が骨髄細胞において,染色体異常誘発作用または紡錘体形成阻害作用を示すか否かの判定は,統計解析の結果をもとに,用量反応性および陰性対照の背景 データ,骨髄細胞増殖への影響等を参考にして総合的に行った.
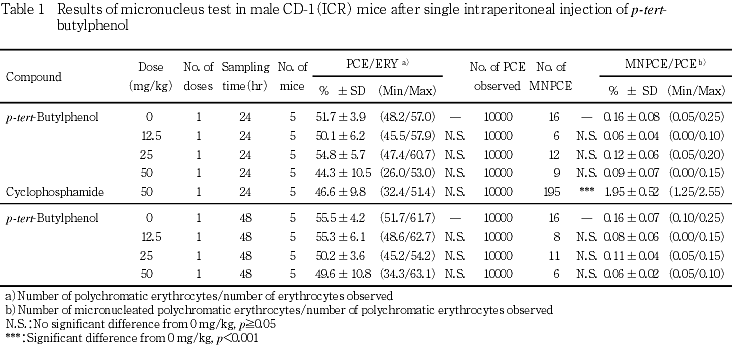
投与後24および48時間における小核出現頻度と,全赤血球中の幼若赤血球の比率をTable 1に示す.投与後24および48時間の陰性対照群と,陽性対照群(投与後24時間のみ)の小核出現頻度は,背景データのばらつきの範囲内であった.
投与後24および48時間の小核出現頻度は,被験物質のいずれの投与群においても,陰性対照群と比較して有意な増加は示さず,用量依存性も認められなかった.一方,CPA 50 mg/kgを投与した陽性対照群では,0.1 %水準で有意な小核出現頻度の増加が認められた.
また,投与後24および48時間の赤血球中に占める幼若赤血球の比率は,被験物質の各投与群および陽性対照群(投与後24時間)のいずれにおいても,陰性対照群との間に有意差は認められなかった.

以上の結果から,本試験条件下ではρ-tert-ブチルフェノールは,マウス骨髄細胞において染色体異常誘発作用あるいは紡錘体形成阻害作用を示さず,また,骨髄細胞の増殖抑制作用も示さないと結論した.
| 1) | National Institute of Occupational Safety and Health(NIOSH)Registry of Toxic Effects of Chemical Substances(RTECS). |
| 2) | W. Schmid, Mutat. Res., 31, 9(1975). |
| 3) | W. Schmid, "Chemical Mutagens," Vol. 4, ed. by A. Hollaender, Plenum Press, N. Y. -London, 1976, pp. 76-78. |
| 4) | M. Hayashi, T. Sofuni, M. Jr. Ishidate, Mutat. Res., 120, 241(1983). |
| 5) | G. W. Snedecor, W. G. Cochran, "Statistical methods," 7, Iowa State University Press, 1980. |
| 6) | B. H. Margolin, M. A. Resnick, J. Y. Rimpo, P. Archer, S. M. Galloway, A. D. Bloom, E. Zeiger, Environ. Mutagen., 8, 183(1986). |
| 7) | B. H. Margolin, K. J. Risko, "Evaluation of Short-Term Tests for Carcinogens," Vol. 1, eds. by J. Ashby, et al., Cambridge Univ. Press, 1988, pp. 29-42. |
| 8) | C. W. Dunnet, J. Am. Statist. Assoc., 50, 1096(1955). |
| 9) | 澁谷徹,化学物質毒性試験報告,4, 295(1996). |
| 10) | 田中憲穂,化学物質毒性試験報告,4, 301(1996). |
| 連絡先 | |||
| 試験責任者: | 原 巧 | ||
| 試験担当者: | 関 剛幸,松本浩孝,太田 亮,堀内伸二,稲田浩子,三枝克彦,安生孝子 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Takumi Hara(Study director) Takayuki Seki, Hirotaka Matsumoto, Ryo Ohta, Shinji Horiuchi, Hiroko Inada, Katsuhiko Saegusa, Takako Anjo | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||