雌においては,死亡例が15 mg/kg群で1例と50 mg/kg群で6例認められた.一般状態では,15 mg/kg群で体温低下および自発運動の低下,50 mg/kg群で体温低下,腹臥,自発運動の低下,よろめき歩行,立毛,被毛の汚れ,流涙,呼吸緩徐,下痢および筋弛緩がみられた.体重は,5および15 mg/kg群で妊娠期および哺育期に低値あるいは低値傾向がみられた.50 mg/kg群では,交配前に低値がみられた.摂餌量は,5 mg/kg群で哺育期に低値がみられた.剖検では,死亡例において15 mg/kg群で腺胃粘膜暗赤色斑,50 mg/kg群で肝臓の白色化および胸腺の萎縮がみられた.生存例では,投与による変化はみられなかった.器官重量では,投与による変化はみられなかった.病理組織学検査では,卵巣に投与による変化はみられなかった.
児動物では,15 mg/kg群で総出産児数,哺育0日の新生児数,分娩率,児の産出率,出生率,哺育4日の生存児数および哺育4日の生存率の低値あるいは低値傾向,死産児数の高値傾向がみられた.投与による外表異常はみられなかった.5および15 mg/kg群では,哺育0および4日の雌雄体重の低値あるいは低値傾向がみられた.剖検では,投与による変化はみられなかった.
以上のように,ρ-tert-ブチルトルエンの一般毒性学的無影響量は,雄では15 mg/kg投与により精子検査成績,精巣および精巣上体の病理組織学検査成績に影響が認められたことから5 mg/kg/day,雌では5 mg/kg投与により妊娠期および哺育期に体重の低値,哺育期に摂餌量の低値が認められたことから1.5 mg/kg/dayと考えられる.生殖発生毒性学的な無影響量は,雄では15 mg/kg投与により精子,精巣および精巣上体に影響が認められたことから5 mg/kg/day,雌では15 mg/kg投与により受胎率の低値が認められたことから5 mg/kg/day,児動物では5 mg/kg投与により哺育0および4日に新生児体重の低値が認められたことから1.5 mg/kg/dayと考えられる.
ρ-tert-ブチルトルエンは,コーンオイルで希釈溶解して調製した.なお,調製に際して,被験物質の純度による換算を実施した.0.2,2,20および200 mg/mLの調製液は,室温・遮光条件下で7日間保存しても安定性に問題のないことが確認されていたため,各濃度の調製液は調製後,室温・遮光条件下で保管し,調製後7日以内に使用した.投与開始日および雄投与終了日に使用した各投与検体中の被験物質濃度を測定した結果,被験物質濃度に問題はなかった.
動物は,室温20〜26 ℃,湿度40〜70 %,明暗各12時間(照明:午前6時〜午後6時),換気回数12回/時に維持されている飼育室で飼育した.検疫・馴化期間中はステンレス製ケージを用いて1ケージ当たり5匹までの群飼育とし,群分け後はステンレス製ケージを用いて個別飼育した.ただし,交配は雄のケージ内で行った.母動物は,妊娠18日以降オートクレーブ処理した床敷(サンフレーク,日本チャールス・リバー(株))を入れたプラスチック製ケージで個別飼育し,自然分娩および哺育させた.
飼料は,固型飼料(CRF-1,オリエンタル酵母工業(株))を自由に摂取させた.飲料水は,水道水を自由に摂取させた.
当試験の投与量設定に際して,ラットにおける経口投与による一般毒性に関する資料が得られなかったため,最初にρ-tert-ブチルトルエンのラットにおける単回経口投与毒性試験(投与段階:0,250,500,1000および2000 mg/kg,使用動物数:各群雌雄各5例)を実施した.その結果を参考にして,ρ-tert-ブチルトルエンのラットを用いる経口投与による簡易生殖毒性試験の予備試験(投与段階:0,125,250,500および750 mg/kg,使用動物数:各群雄5例,投与期間:14日間)を実施し,その結果に基づき決定した.すなわち,ρ-tert-ブチルトルエンのラットを用いる経口投与による簡易生殖毒性試験の予備試験において,死亡例が125 mg/kg群で3例,250,500および750 mg/kg群で各5例認められた.また,125 mg/kg群では,体重および摂餌量の低値,精巣および精巣上体の萎縮がみられた.そこで,当試験では,予備試験において死亡例の認められた125 mg/kgのほぼ半量に相当する50 mg/kgを最高用量とし,以下公比約3により15,5および1.5 mg/kgとした.また,対照として媒体(コーンオイル)のみを同容量投与する群を設けた.各群の動物数は,雌雄それぞれ12例とした.
投与期間は,雄では交配前14日間とその後36〜38日間(精子検査に3日間必要なため,雄の剖検を3日間に分けて実施)の合計50〜52日間とし,雌では交配前14日間,交配期間中(最長14日間),妊娠期間中および哺育3日までの合計41〜45日間とした.なお,投与開始日を投与1日とした.
一般状態および死亡の有無は,投与前・後の1日2回観察した.
死亡例は,発見後速やかに剖検した.
(2) 体重測定
体重は,1週間に2回測定した.
(3) 摂餌量測定
摂餌量は,交配開始前14日間および交配期間終了後に1週間に2回測定した.
(4) 剖検
最終投与の翌日(投与51〜53日)にエーテル麻酔下で腹大動脈から放血致死させた後に剖検し,精巣,精巣上体および精巣上体の尾部重量を測定した.精巣および精巣上体の頭部は,ブアン液で2〜3時間固定後,90 %アルコールに再固定した.前立腺および精嚢は,20 %中性緩衝ホルマリンで固定した.
(5) 精子検査
右精巣上体の尾部は,37 ℃に加温した精子培養液(0.5 %牛血清アルブミン加Medium199)中で分割し,約5分間静置後,精子原液を作製した.この精子原液を用いて精子の活動性,精子の生存性および精子の形態の各検査を実施した.
精子の活動性は,精子原液を精子培養液で希釈し,約30分間培養後に精子希釈液をサンプルチャンバー(MICROSLIDES,#HTR1099, VitroCom, Inc.)に入れ,HTM-IVOS(Hamilton Thorne Research)を用いて,活動精子率を算出するとともに,活動精子について基準点移動速度,最短距離移動速度,総移動速度および頭部の横切り回数を算出した.
精子の生存性として,加藤らの方法1)に従い,マイクロウェルプレート内で精子原液を精子培養液にて約2〜3倍希釈した後,Calcein acetoxy methyl esterとEthidium homodimer-1とで約2時間培養・染色した後,蛍光顕微鏡下で300個の精子を生存精子,途中死亡精子と死滅精子に分類し,生存精子率と生き残り精子率を求めた.なお,生存,途中死亡および死滅精子の判定は,頭部〜尾部にかけて緑色の蛍光発色が認められるものを生存精子,頭部には赤色の蛍光発色が,尾部には緑色の蛍光発色が認められるものを途中死亡精子,頭部には赤色の蛍光発色が認められるが,尾部には蛍光発色が認められないものを死滅精子とした.
精子の形態は,精子原液をスライドガラスに塗抹し,10 %中性緩衝ホルマリンで固定後,1 %エオジン染色液で染色し,顕微鏡下で300個の精子について観察した.奇形精子率は,精子300個当たりの奇形精子の割合を求めることにより算出した.
精子数は,左精巣上体尾部を凍結(-80 ℃)保存後,0.1 %Triton X-100中でホモジナイズして作製した精子懸濁液をサンプルチャンバー(CELL-VU, Fertility Technologies, Inc.)に入れ,HTM-IVOS(Hamilton Thorne Research)を用いて算出した.なお,左精巣上体尾部1 g当たりの精子数も算出した.
(6) 病理組織学検査
精巣,精巣上体の頭部,精嚢および前立腺は,常法に従ってパラフィン包埋標本を作製した.
対照群および50 mg/kg群の精巣,精巣上体の頭部,精嚢および前立腺についてHE染色組織標本を作製し,病理組織学検査を実施した.50 mg/kg群の検査で対照群と比べて異常を示す動物数に差があると考えられた精巣および精巣上体の頭部については,1.5,5および15 mg/kg群についてもHE染色組織標本を作製し,病理組織学検査を実施した.
一般状態および死亡の有無は,投与前・後の1日2回観察した.
死亡例は,発見後速やかに剖検した.
(2) 性周期
性周期は,投与開始日から交尾確認日あるいは交配期間終了日まで毎日1回観察した.なお,発情期が連続2日間にわたって観察された場合は1回として発情回数を計数した.
(3) 体重測定
体重は,交配開始前14日間および交配期間中は1週間に2回,妊娠期間中は妊娠0,7,14および21日に,哺育期間中は哺育0および4日にそれぞれ測定した.
(4) 摂餌量測定
摂餌量は,交配開始前14日間までは1週間に2回,妊娠期間中は妊娠2,9,16および21日に,哺育期間中は哺育4日に測定した.
(5) 交尾不成立雌
交尾不成立雌は,交配期間終了後にエーテル麻酔下で腹大動脈から放血致死させた後に剖検した.
(6) 分娩状態の観察
交尾雌は自然分娩させ,分娩状態の異常の有無,分娩終了の確認を妊娠21日から妊娠25日の午前10時まで毎日行った.午前10時に分娩が終了していた場合,その日を哺育0日とした.
(7) 妊娠25日の午前10時までに分娩しなかった雌
妊娠25日の午前10時までに分娩しなかった雌は,エーテル麻酔下で腹大動脈から放血致死させた後に剖検し,着床の有無により妊娠の成否を確認した.
(8) 哺育状態の観察および剖検
母動物は,哺育状態を哺育4日まで毎日観察し,新生児が全例死亡した日あるいは哺育4日にエーテル麻酔下で腹大動脈から放血致死させた後に剖検し,着床数および妊娠黄体数を数えた.卵巣は重量を測定し,卵巣,子宮および腟を20 %中性緩衝ホルマリンで固定した.
(9) 病理組織学検査
卵巣は,常法に従ってパラフィン包埋標本を作製した.対照群および50 mg/kg群の卵巣についてHE染色組織標本を作製し,病理組織学検査を実施した.
交尾確認は毎朝ほぼ一定時刻に行い,腟垢内に精子または腟栓を確認した雌を交尾成立動物として,その日を妊娠0日として起算した.
出産時に総出産児数と性,死産児数,新生児数および外表異常の有無を観察した.
(2) 新生児の観察
新生児は,一般状態および死亡の有無を毎日1回観察した.
(3) 体重測定
体重は,哺育0日(出生日)および4日に測定した.
(4) 剖検
生存児は,哺育4日にエーテル麻酔下で腹大動脈から放血致死させた後に剖検した.
体重,摂餌量,器官の絶対重量および相対重量,精子の活動性の各項目,奇形精子率,生存精子率,生き残り精子率,精子数,左精巣上体尾部1 g当たりの精子数,発情回数,交尾所要日数,妊娠期間,妊娠黄体数,着床数,着床率,総出産児数,死産児数,新生児数,分娩率,児の産出率,出生率,哺育4日の生存児数,哺育4日の生存率,性比,外表異常の出現率および哺育4日の生存児の剖検での異常の出現率は,各群で平均値および標準偏差を算出した.その後,Bartlett法による等分散性の検定を行い,等分散の場合には一元配置法による分散分析を行い,有意ならばDunnett法により行った.一方,等分散と認められなかった場合は,順位を利用した一元配置法による分析(Kruskal-Wallisの検定)を行い,有意ならば順位を利用したDunnett型の検定法により行った.
交尾率,受胎率および出産率は,χ2検定により行った.
なお,病理組織学検査において,50 mg/kg群で毒性学的影響が示唆され他の用量群についても検査を実施した精巣および精巣上体の所見については,対照群との群間比較を上記の順位を利用したDunnett型の検定法を用いて行った.
死亡例は,50 mg/kg群で1例認められた.死亡例では,一過性の流涎,自発運動の低下,被毛の汚れ,赤色尿および体温低下がみられた.
生存例の一般状態観察において,対照群では異常はみられなかった.1.5 mg/kg以上の群では,一過性の流涎がみられた.50 mg/kg群では,被毛の汚れが1例みられた.
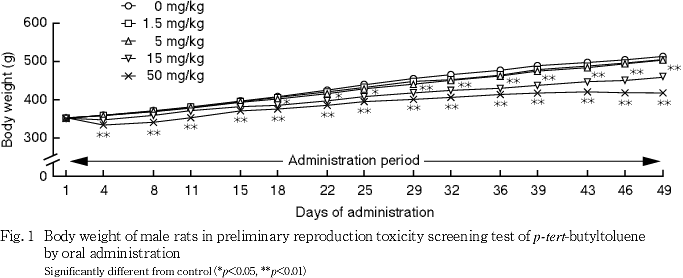
(2) 体重(Fig. 1)
1.5および5 mg/kg群では,対照群と比べていずれの測定日の体重にも有意差はみられなかった.15 mg/kg群では,対照群と比べて投与18〜49日に体重の有意な低値がみられた.50 mg/kg群では,対照群と比べて投与4〜49日に体重の有意な低値がみられた.

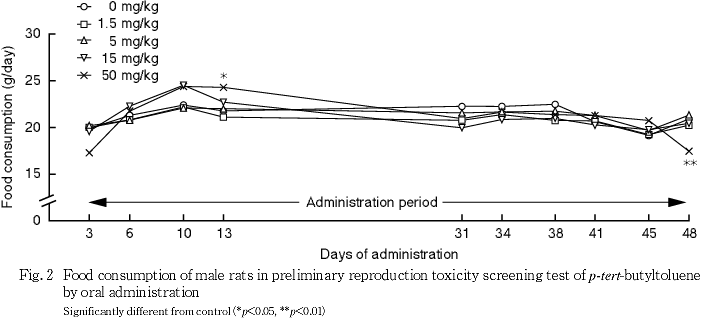
(3) 摂餌量(Fig. 2)
1.5,5および15 mg/kg群では,対照群と比べていずれの測定日の摂餌量にも有意差はみられなかった.50 mg/kg群では,対照群と比べて投与48日に摂餌量の有意な低値がみられた.なお,同群では,対照群と比べて投与13日に摂餌量の有意な高値がみられたが,一過性の変化であり,投与によるものではないと考えられる.
(4) 剖検
生存例においては,対照群,1.5および5 mg/kg群ではいずれにも異常はみられなかった.15 mg/kg群では,両側精巣の萎縮および両側精巣上体の萎縮が1例みられた.50 mg/kg群では,両側精巣の萎縮および両側精巣上体の萎縮がいずれも11例全例みられた.
50 mg/kg群の死亡例においては,胸腺の萎縮,前胃粘膜の潰瘍,両側精巣の萎縮,両側精巣上体の萎縮,精嚢の萎縮および前立腺の萎縮がみられた.
(5) 器官重量(Table 1)
剖検日の体重において,1.5および5 mg/kg群では対照群と比べて有意差はみられなかった.15および50 mg/kg群では,対照群と比べて剖検日の体重の有意な低値がみられた.
器官重量において,1.5および5 mg/kg群では対照群と比べて精巣および精巣上体の絶対ならびに相対重量に有意差はみられなかった.15 mg/kg群では,対照群と比べて精巣上体の絶対重量の有意な低値,精巣の絶対重量の低値傾向がみられた.50 mg/kg群では,対照群と比べて精巣および精巣上体の絶対ならびに相対重量の有意な低値がみられた.
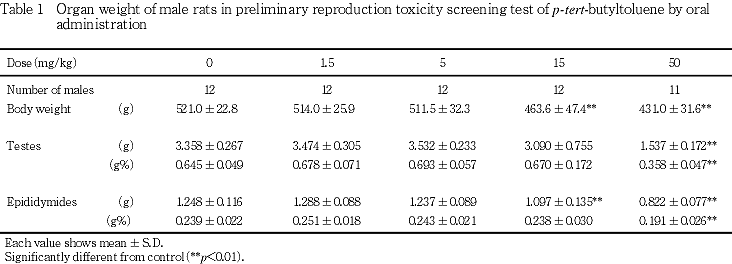
(6) 精子検査(Table 2)
1.5および5 mg/kg群では,対照群と比べて活動精子率,基準点移動速度,最短距離移動速度,総移動速度,頭部の横切り回数,奇形精子(頭部,尾部およびそれらの合計)率,生存精子率,生き残り精子率,精子数,左精巣上体尾部1 g当たりの精子数に有意差はみられなかった.
15 mg/kg群では,対照群と比べて活動精子率,基準点移動速度,最短距離移動速度,総移動速度,生存精子率,生き残り精子率,精子数および左精巣上体尾部1 g当たりの精子数の有意な低値がみられた.また,同群では,頭部の横切り回数,奇形精子(頭部,尾部およびそれらの合計)率の有意な高値がみられた.
50 mg/kg群では,対照群と比べて活動精子率,精子数および左精巣上体尾部1 g当たりの精子数の有意な低値がみられた.また,活動精子が少なく,基準点移動速度,最短距離移動速度,総移動速度および頭部の横切り回数,生存精子率,生き残り精子率の測定が可能であった動物は1例のみであったが,いずれの項目も低値であった.50 mg/kg群では,精子の形態観察が可能な動物は5例のみであったが,奇形精子(頭部,尾部およびそれらの合計)率の有意な高値がみられた.
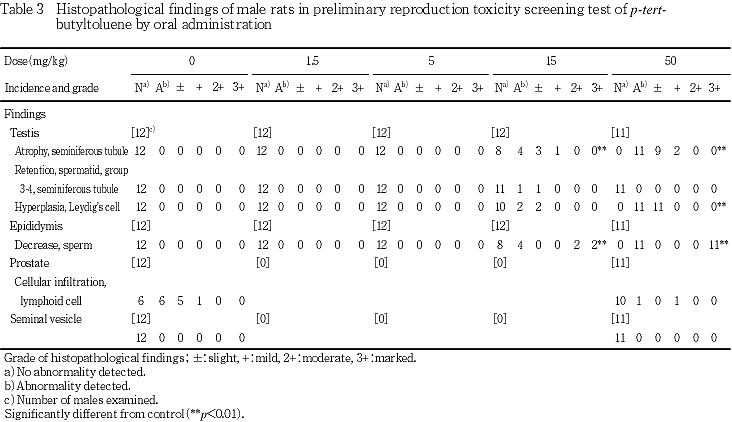
(7) 病理組織学検査(Table 3)
精巣:対照群,1.5および5 mg/kg群では,異常はみられなかった.15 mg/kg群では,精細管の萎縮が4例,ライディヒ細胞の過形成が2例,グループ3〜4の精細管にステップ19精子細胞の残留が1例みられた.50 mg/kg群では,精細管の萎縮およびライディヒ細胞の過形成が各11例みられた.
精巣上体(頭部):対照群,1.5および5 mg/kg群では,異常はみられなかった.15 mg/kg群では,精子の減少が4例みられた.50 mg/kg群では,精子の減少が11例みられた.
なお,精巣における精細管の萎縮および精巣上体における精子の減少は15および50 mg/kg群で,精巣におけるライディヒ細胞の過形成は50 mg/kg群でいずれも対照群と比べて有意差が認められた.しかし,15 mg/kg群で観察されたグループ3〜4の精細管での精子細胞の残留は1例のみであること,50 mg/kg群で認められないことから,偶発例と考えられる.
その他には,前立腺においてリンパ様細胞浸潤がみられたが,偶発的変化と判断される.
死亡例は,15 mg/kg群で1例と50 mg/kg群で6例認められた.死亡例では,15 mg/kg群で体温低下,自発運動の低下および一過性の流涎がみられた.50 mg/kg群では,体温低下,腹臥,自発運動の低下,立毛,被毛の汚れ,呼吸緩徐,一過性の流涎がみられた.
生存例の一般状態観察において,対照群,1.5および5 mg/kg群では異常はみられなかった.15 mg/kg群では,一過性の流涎がみられた.50 mg/kg群では,一過性の流涎,体温低下,自発運動の低下,よろめき歩行,流涙,下痢および筋弛緩が認められた.
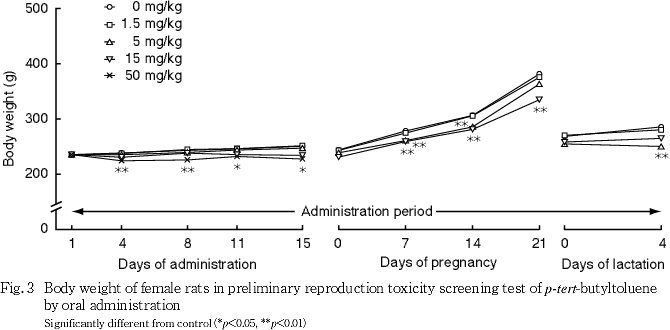
(2) 体重(Fig. 3)
交配開始前において,1.5,5および15 mg/kg群では対照群と比べていずれの測定日の体重にも有意差はみられなかった.50 mg/kg群では,対照群と比べて投与4〜15日に体重の有意な低値がみられた.
妊娠期間中において,1.5 mg/kg群では対照群と比べていずれの測定日の体重にも有意差はみられなかった.5 mg/kg群では,対照群と比べて妊娠7および14日に体重の有意な低値がみられた.15 mg/kg群では,対照群と比べて妊娠7〜21日に体重の有意な低値がみられた.
哺育期間中において,1.5 mg/kg群では対照群と比べていずれの測定日の体重にも有意差はみられなかった.5 mg/kg群では,対照群と比べて哺育4日に体重の有意な低値がみられた.15 mg/kg群の1例では,哺育4日に体重の低値傾向がみられた.
(3) 摂餌量(Fig. 4)
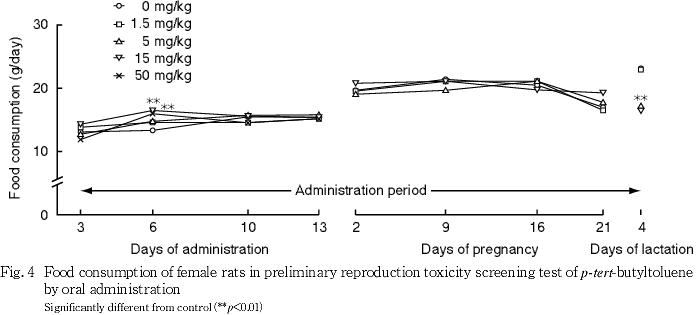
交配開始前において,1.5および5 mg/kg群では対照群と比べていずれの測定日の摂餌量にも有意差はみられなかった.15および50 mg/kg群では,対照群と比べて投与6日に摂餌量の有意な高値がみられたが,一過性の変化であり,毒性学的影響とは考えられない.
妊娠期間中において,1.5,5および15 mg/kg群では対照群と比べていずれの測定日の摂餌量にも有意差はみられなかった.
哺育期間中において,1.5 mg/kg群では対照群と比べて摂餌量に有意差はみられなかった.5 mg/kg群では,対照群と比べて哺育4日に摂餌量の有意な低値がみられた.15 mg/kg群の1例では,哺育4日に摂餌量の低値傾向がみられた.
(4) 剖検
生存例においては,いずれの群とも異常はみられなかった.
死亡例においては,15 mg/kg群で腺胃粘膜暗赤色斑が1例みられた.50 mg/kg群では,肝臓の白色化および胸腺の萎縮が各1例みられた.なお,交尾後に死亡した3例はいずれも不妊であった.
(5) 器官重量(Table 4)
剖検日の体重において,1.5 mg/kg群では対照群と比べて有意差はみられなかった.5,15および50 mg/kg群では,対照群と比べて剖検日の体重の有意な低値がみられた.
器官重量において,1.5,5,15および50 mg/kg群とも対照群と比べて卵巣の絶対ならびに相対重量に有意差はみられなかった.

(6) 病理組織学検査
卵巣:対照群および50 mg/kg群とも異常はみられなかった.
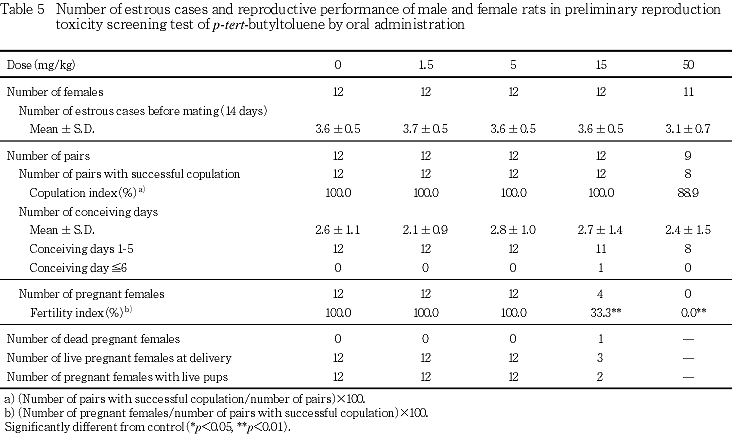
交配前の投与期間(14日間)の発情回数は,各投与群とも対照群と比べて有意差はみられなかった.
交尾所要日数は,各投与群とも対照群と比べて有意差はみられなかった.
50 mg/kg群では,1組が交尾しなかった.交尾率は,各投与群とも対照群と比べて有意差はみられなかった.
不受胎雌は,15 mg/kg群で8例認められ,50 mg/kg群では受胎雌は1例も得られなかった.受胎率は,15および50 mg/kg群で対照群と比べて有意な低値がみられた.
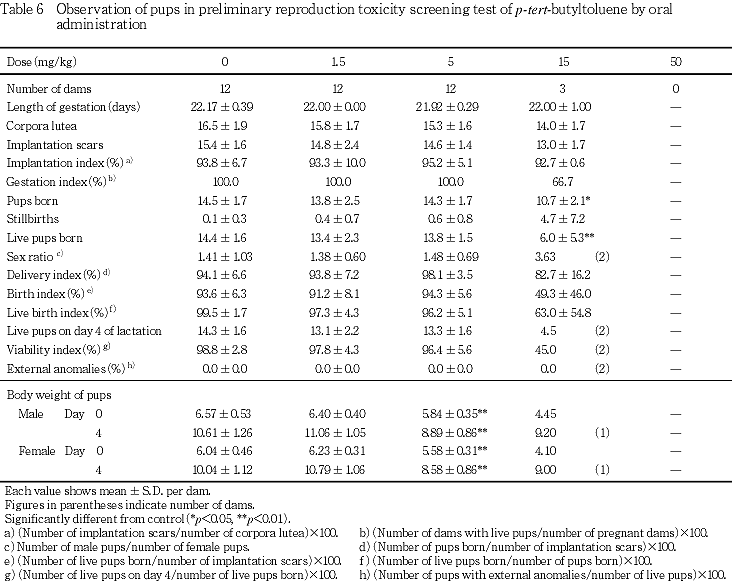
(2) 妊娠期間,分娩状態,妊娠黄体数,着床率および出産率(Table 6)
妊娠期間は,1.5,5および15 mg/kg群では対照群と比べて有意差はみられなかった.
分娩状態は,対照群,1.5および5 mg/kg群では異常はみられなかった.15 mg/kg群の1例では,出産児が全例死亡したため,新生児は得られなかった.
1.5,5および15 mg/kg群では,対照群と比べて妊娠黄体数,着床数および着床率に有意差はみられなかった.
対照群,1.5および5 mg/kg群では出産率は100 %であった.15 mg/kg群では,1母動物で新生児が得られなかったため出産率は66.7 %であった.
哺育状態において,対照群,1.5および5 mg/kg群では異常はみられなかった.15 mg/kg群では,1例で哺育1日までに全新生児が死亡した.
1.5および5 mg/kg群では,対照群と比べて総出産児数,死産児数,哺育0日の新生児数,性比,分娩率,児の産出率および出生率に有意差はみられなかった.15 mg/kg群では,対照群と比べて総出産児数および哺育0日の新生児数の有意な低値,分娩率,児の産出率および出生率の低値傾向,死産児数の高値傾向がみられた.
(2) 児動物の一般状態および生存率(Table 6)
1.5および5 mg/kg群では,対照群と比べて哺育4日の生存児数および哺育4日の生存率に有意差はみられなかった.15 mg/kg群では,哺育1日までに全新生児が死亡した母動物が1例みられ,哺育4日の生存児数および哺育4日の生存率の低値傾向が認められた.
新生児の外表観察では,いずれの群とも異常はみられなかった.
新生児の一般状態では,対照群,5および15 mg/kg群では異常はみられなかった.1.5 mg/kg群では,尾の壊死が1例みられたが,偶発例と考えられる.
(3) 児動物の体重推移(Table 6)
1.5 mg/kg群では,対照群と比べて哺育0および4日の雌雄体重に有意差はみられなかった.5 mg/kg群では,対照群と比べて哺育0および4日の雌雄体重の有意な低値がみられた.15 mg/kg群では,対照群と比べて哺育0および4日の雌雄体重の低値傾向がみられた.
(4) 児動物の剖検
対照群,5および15 mg/kg群では,異常はみられなかった.1.5 mg/kg群では,一般状態観察時に認められた尾の壊死が雄1例みられたが,対照群と比べて有意差は認められず,また投与量に依存したものではなかった.
雄に関しては,死亡は50 mg/kg群で1例認められた.一般状態では,1.5,5および15 mg/kg群で流涎,50 mg/kg群で体温低下,自発運動の低下,被毛の汚れ,流涎および赤色尿がみられた.なお,各投与群で認められた流涎は,一過性に認められたのみであることから,被験物質の刺激性に基づく変化と判断され,毒性症状とはみなさなかった.体重において,15および50 mg/kg群で低値がみられた.また,摂餌量においては,50 mg/kg群で一過性の低値がみられた.剖検において,15および50 mg/kg群で精巣および精巣上体の萎縮がみられた.器官重量においても,15 mg/kg群で精巣および精巣上体の絶対重量の低値あるいは低値傾向,50 mg/kg群で精巣および精巣上体の絶対ならびに相対重量の低値がみられた.精子検査では,15および50 mg/kg群で活動精子率,基準点移動速度,最短距離移動速度,総移動速度,生存精子率,生き残り精子率,精子数および左精巣上体尾部1 g当たりの精子数の低値,奇形精子率の高値がみられた.また,15 mg/kg群では,頭部の横切り回数の高値もみられた.病理組織学検査において,15および50 mg/kg群で精巣に精細管の萎縮とライディヒ細胞の過形成,精巣上体に精子減少がみられた.以上のように,ρ-tert-ブチルトルエンの一般毒性学的影響としては,雄では精巣および精巣上体への影響が顕著であった.
雌に関しては,死亡は15 mg/kg群で1例と50 mg/kg群で6例認められた.一般状態では,15 mg/kg群で体温低下,自発運動の低下および流涎,50 mg/kg群で体温低下,腹臥,自発運動の低下,よろめき歩行,流涎,立毛,被毛の汚れ,流涙,呼吸緩徐,下痢および筋弛緩がみられた.なお,15および50 mg/kg群で認められた流涎は,雄と同様に毒性症状とはみなさなかった.体重において,5および15 mg/kg群で妊娠期および哺育期に低値あるいは低値傾向,50 mg/kg群で交配前に低値がみられた.摂餌量では,5 mg/kg群で哺育期に低値,15 mg/kg群で哺育期に低値傾向がみられた.死亡例の剖検において,15 mg/kg群では腺胃粘膜暗赤色斑,50 mg/kg群では胸腺の萎縮および肝臓の白色化がみられたが,生存例では投与に起因する変化はみられなかった.また,生存例の卵巣の重量および病理組織学検査においても,投与に起因する変化はみられなかった.
したがって,当試験条件下におけるρ-tert-ブチルトルエンの一般毒性学的無影響量は,雄が5 mg/kg/day,雌が1.5 mg/kg/dayと考えられる.
親動物の生殖発生に対しては,前述したように15および50 mg/kg群で精子検査成績に影響がみられ,精巣および精巣上体に病理組織学変化も認められた.発情回数,交尾率,交尾所要日数,妊娠期間,分娩状態および哺育状態では投与に起因する変化はみられなかった.15 mg/kg群では受胎雌数が少なく,また,50 mg/kg群では受胎雌は1例も得られず,15および50 mg/kg群とも受胎率の低値が認められた.1.5,5および15 mg/kg群では,妊娠黄体数,着床数,着床率および出産率に影響はみられなかった.したがって,当試験条件下におけるρ-tert-ブチルトルエンの生殖発生毒性学的な無影響量は,雌雄とも5 mg/kg/dayと考えられる.なお,他の類縁物質(2,4-ジクロロ-1-メチルベンゼン2))でも,受胎率の低下が報告されている.
児動物に対しては,1.5および5 mg/kg群では総出産児数,死産児数,哺育0日の新生児数,性比,分娩率,児の産出率,出生率,一般状態,哺育4日の生存児数,哺育4日の生存率には投与による影響はみられなかった.15 mg/kg群では,総出産児数,哺育0および4日の新生児数,分娩率,児の産出率,出生率ならびに哺育4日の生存率の低値あるいは低値傾向,死産児数の高値傾向がみられた.新生児の外表観察において,投与に関連した変化はみられなかった.児動物の体重では,1.5 mg/kg群では対照群との間に差はみられなかった.5 mg/kg群では,哺育0および4日の雌雄体重の低値がみられた.15 mg/kg群では,哺育0および4日の雌雄体重の低値傾向がみられた.児動物の剖検では,投与に起因する変化はみられなかった.
したがって,当試験条件下におけるρ-tert-ブチルトルエンの生殖発生毒性学的な無影響量は,児動物では1.5 mg/kg/dayと考えられる.
以上のように,ρ-tert-ブチルトルエンの一般毒性学的無影響量は,雄では15 mg/kg投与により精子検査成績,精巣および精巣上体の病理組織学検査成績に影響が認められたことから5 mg/kg/day,雌では5 mg/kg投与により妊娠期および哺育期に体重の低値,哺育期に摂餌量の低値が認められたことから1.5 mg/kg/dayと考えられる.生殖発生毒性学的な無影響量は,雄では15 mg/kg投与により精子,精巣および精巣上体に影響が認められたことから5 mg/kg/day,雌では15 mg/kg投与により受胎率の低値が認められたことから5 mg/kg/day,児動物では5 mg/kg投与により哺育0および4日に新生児体重の低値が認められたことから1.5 mg/kg/dayと考えられる.
| 1) | M. Kato, Congenital Anomalies, 35, 394(1995). |
| 2) | 釜田悟ほか,化学物質毒性試験報告,1, 113(1994). |
| 連絡先 | |||
| 試験責任者: | 古橋忠和 | ||
| 試験担当者: | 長瀬孝彦,内藤一嘉,岡田雅昭,木村 均,吉島賢一 | ||
| (株)日本バイオリサーチセンター羽島研究所 | |||
| 〒501-6251岐阜県羽島市福寿町間島6-104 | |||
| Tel 058-392-6222 | Fax 058-392-1284 | ||
| Correspondence | ||||
| Authors: | Tadakazu Furuhashi(Study director) Takahiko Nagase, Kazuyoshi Naito, Masaaki Okada, Hitoshi Kimura, Ken-ichi Yoshijima | |||
| Nihon Bioresearch Inc. | ||||
| 6-104, Majima, Fukuju-cho, Hashima, Gifu, 501-6251, Japan | ||||
| Tel +81-58-392-6222 | Fax +81-58-392-1284 | |||