今回,テトラヒドロフルフリルアルコールについて,SD系[Crj:CD(SD)IGS]ラットを用い,0(溶媒),10,40,150および600 mg/kg用量で,28日間反復経口投与毒性試験を実施した.動物数は1群雌雄各5匹とし,投与期間終了後屠殺の5群,ならびに対照および600 mg/kgの14日間回復群を設定した.
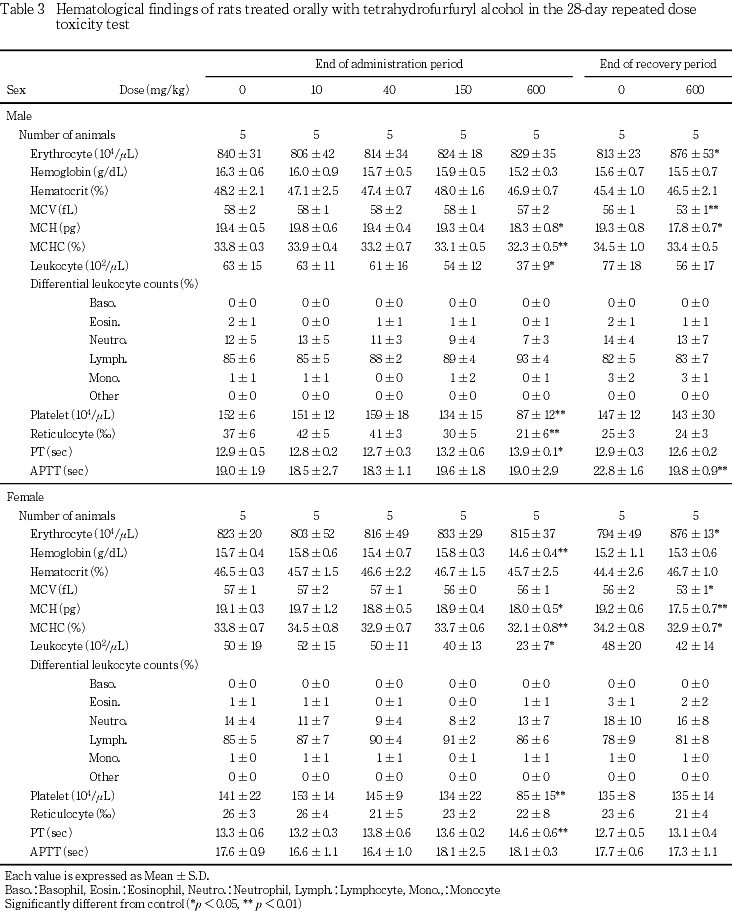
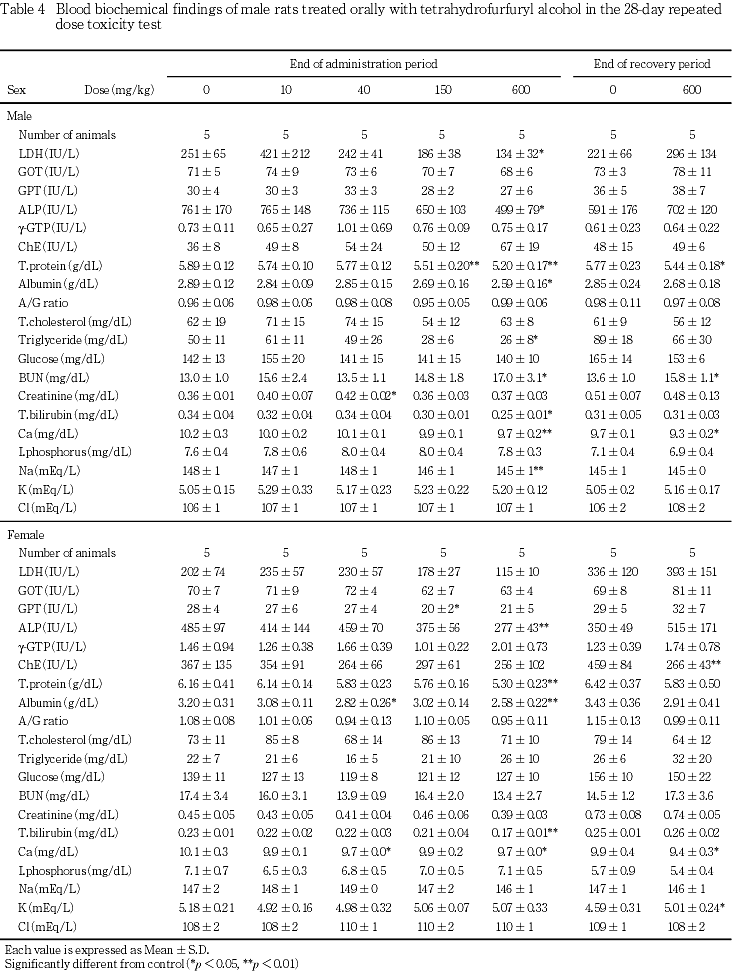
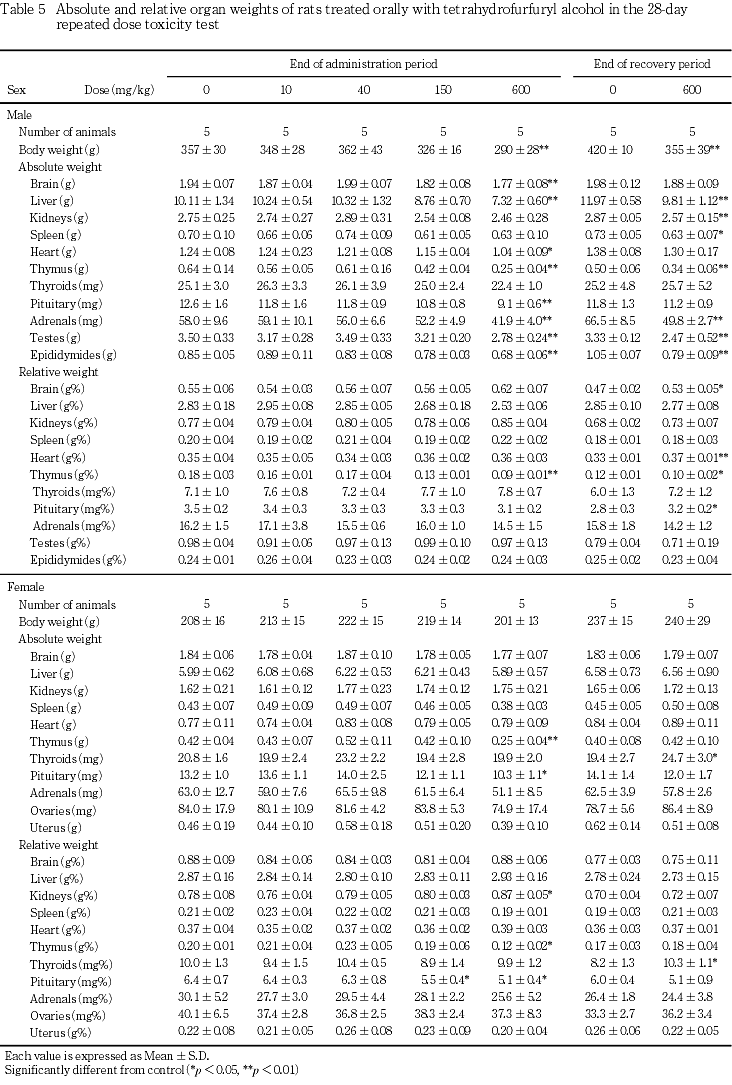
その結果,600 mg/kg群で,雌雄に自発運動亢進,続いて自発運動低下および腹臥姿勢,さらに雄には後肢握力の低下,摂餌量の減少および体重増加の抑制,雌には投与1週のみの摂餌量の減少が認められた.150 mg/kg群では,雌に自発運動亢進が認められた.尿検査では,600 mg/kg群で雄にpHの低下が認められた.血液学検査では,600 mg/kg群で雌雄に平均赤血球血色素量,平均赤血球血色素濃度,白血球数および血小板数の減少並びにプロトロンビン時間の延長,さらに雄には網状赤血球数,雌には血色素量の減少が認められた.血液生化学検査では,600 mg/kg群で雌雄にALP,総タンパク,アルブミン,総ビリルビンおよびカルシウム,さらに雄にはLDH,トリグリセライドおよびナトリウムのいずれも減少並びに尿素窒素の増加が認められた.150 mg/kg群では,雄に総タンパクの減少が認められた.器官重量では,600 mg/kg群で雌雄に胸腺,雌に下垂体の絶対および相対重量に共通した減少,雄で脳絶対重量の減少,雌で腎臓相対重量の増加が認められた.150 mg/kg群では,雌に下垂体相対重量の減少が認められた.病理組織学検査では,600 mg/kg群で雌雄に胸腺の萎縮,雄に脾臓の髄外造血低下による赤脾髄萎縮および被膜炎症並びに精巣の精上皮細胞壊死,150 mg/kg群で雄に脾臓の被膜炎症並びに精巣の精上皮細胞壊死が認められ,精巣の精子形成サイクル検査では,600 mg/kg群でセルトリ細胞に対する精子細胞の比率の減少が認められた.
回復群においては,これらの投与期間中或いは投与期間終了時の観察および検査で認められた変化のうち,精巣の変化は増強する傾向にあり,精子細胞に加えてパキテン期精母細胞の比率も減少したが,その他の変化は回復或いは回復傾向を示した.
以上の結果から,テトラヒドロフルフリルアルコールのラットへの28日間反復投与による主な毒性は,胸腺,脾臓,腎臓および精巣に対する影響並びに血液学的および血液生化学的影響であった.無影響量は,雌雄とも40 mg/kg/dayであると考えられた.
 法),GOT,GPT,γ-GTP,ALP(以上,JSCC法),LDH(SFBC法),コリンエステラーゼ(BTC-DTNB法),カルシウム(OCPC法)および無機リン(酵素法)を,また電解質自動分析装置〔東亜電波工業,NAKL-132〕により,ナトリウム,カリウムおよび塩素を測定した.
法),GOT,GPT,γ-GTP,ALP(以上,JSCC法),LDH(SFBC法),コリンエステラーゼ(BTC-DTNB法),カルシウム(OCPC法)および無機リン(酵素法)を,また電解質自動分析装置〔東亜電波工業,NAKL-132〕により,ナトリウム,カリウムおよび塩素を測定した.
 -
- ,
, ,
, および
および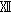 )の検査11, 12)も行なった.さらに,沈着物を同定するため,対照群の雄の2匹の腎臓にもPAS染色を行なった.
)の検査11, 12)も行なった.さらに,沈着物を同定するため,対照群の雄の2匹の腎臓にもPAS染色を行なった.
 群間で標本数が異なる場合)の方法により対照群に対する各群の比較検定を行った.カテゴリカルデータにはFisherの直接確率法を用いた.ただし,回復群のパラメトリックデータはF検定を行い,その結果分散が一様な場合はStudentのt検定を,一様でない場合は Aspinn-Welchのt検定を行った.ノンパラメトリックデータには,Mann-WhitneyのU検定を用いた.有意水準は,いずれの場合も5 %とした.
群間で標本数が異なる場合)の方法により対照群に対する各群の比較検定を行った.カテゴリカルデータにはFisherの直接確率法を用いた.ただし,回復群のパラメトリックデータはF検定を行い,その結果分散が一様な場合はStudentのt検定を,一様でない場合は Aspinn-Welchのt検定を行った.ノンパラメトリックデータには,Mann-WhitneyのU検定を用いた.有意水準は,いずれの場合も5 %とした.
回復期間においては,一般状態の変化は認められなかった.
死亡は,投与および回復期間を通じて認められなかった.
回復期間中の測定においては,着地開脚幅,握力および自発運動量ともに,有意な変化は認められなかった.

回復期間において,600 mg/kg群の雄の体重に有意差は残るものの,対照群と概ね平行して推移した.
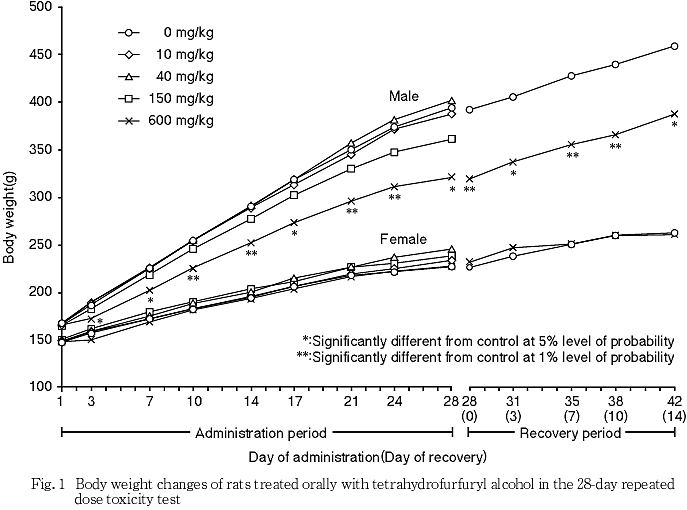
回復期間において,600 mg/kg群の雌雄の摂餌量は,対照群と比べて有意差は認められなかった.
回復期間中の検査において,各検査項目に有意な変化は認められなった.
回復期間終了時屠殺動物において,投与期間終了時屠殺動物で認められた変化は認められなかった.なお,回復期間終了時屠殺動物では,投与期間終了時屠殺動物で認められなった赤血球数の有意な増加が雌雄に認められ,雌雄の平均赤血球容積および平均赤血球血色素量並びに雌の平均赤血球血色素濃度はいずれも有意な低値を示した.また,雄に活性化部分トロンボプラスチン時間の有意な短縮が認められた.
回復期間終了時屠殺動物においては,投与期間終了時屠殺動物において認められた変化のうち,雌雄のカルシウム並びに雄の総タンパクおよび尿素窒素に有意差が残るものの,その他の変化は回復し,また総タンパクおよび尿素窒素の変化にも回復傾向が認められた.なお,回復期間終了時屠殺動物では,雌のカリウムが有意な高値を示したほか,投与期間終了時屠殺動物において有意差は認められなかったものの低値傾向にあった雌のコリンエステラ−ゼにも有意差が認められた.
回復期間終了時屠殺動物において,雄の胸腺の絶対および相対重量の減少に有意差が残るものの,投与期間終了時屠殺動物と比べて変化の程度は軽減する傾向にあった.また,雄の最終体重は対照群と比べて約15 %少なく,肝臓,腎臓,脾臓,副腎,精巣および精巣上体は絶対重量のみの有意な低値,脳,心臓および下垂体は相対重量のみの有意な高値を示した.さらに,雌では甲状腺の絶対および相対重量の有意な高値が認められた.
胸腺では,600 mg/kg群の雌雄の全例で,皮質および髄質領域のリンパ球が低形成となり,軽度な萎縮が認められた.
脾臓では,対照群の雄の全例の赤脾髄に中等度な髄外造血が認められた.一方,600 mg/kg群の雄の髄外造血は全例が軽度であり,赤脾髄の萎縮が認められた.また,被膜の一部に細胞浸潤や線維化等を伴う軽度な炎症が,150 mg/kg群で雄の1匹および600 mg/kg群で雄の3匹に認められた.
精巣では,精上皮細胞の壊死が150 mg/kg群の2匹および600 mg/kg群の5匹に認められた.精子形成サイクル検査によりセルトリ細胞に対する生殖細胞の比率を算定した結果,ステージ -
- ,
,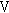 および
および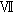 において,精子細胞(round)の比率が減少傾向にあり,ステージ
において,精子細胞(round)の比率が減少傾向にあり,ステージ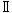 -
- および
および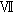 で有意差が認められた.
で有意差が認められた.
回復期間終了時屠殺動物では,雌雄の胸腺,雄の脾臓の変化には回復傾向が認められた.しかしながら,精巣の精上皮細胞の壊死の程度は増強する傾向にあり,精子形成サイクル検査ではステージ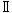 -
- および
および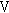 でパキテン期精母細胞および精子細胞(round)の比率の有意な減少が認められた.
でパキテン期精母細胞および精子細胞(round)の比率の有意な減少が認められた.
なお,被験物質の投与とは無関係と考えられえる変化として,肺の動脈壁鉱質沈着,肝臓の微小肉芽腫および巣状壊死,腎臓の嚢胞,好塩基性尿細管および皮質リンパ球浸潤,脾臓の褐色色素沈着,胸腺の出血が認められたが,対照群にも認められ,被験物質投与群の発現率や変化の程度に差は認められなかった.肺の泡抹細胞は,対照群には認められず,600 mg/kg群の雌の1匹に認められたが,この変化はラットに自然発生的にしばしば認められる病変であることから,被験物質の投与とは無関係な所見と判断された.また,剖検で被験物質の投与とは無関係に認められた子宮の子宮腔水腫の例では,子宮腔の拡張が認められた.
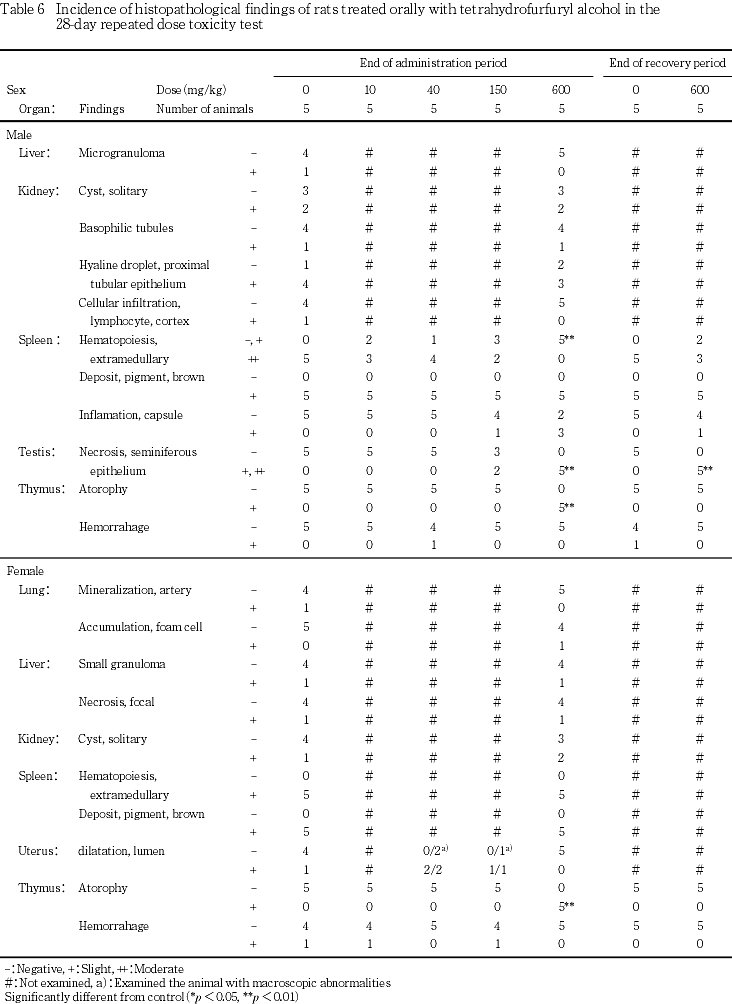
胸腺に対する影響について,600 mg/kg群で雌雄に胸腺重量の減少が認められ,病理組織学的には,胸腺の萎縮が認められた.この胸腺の変化は,副腎の肥大を伴っていないことから,毒性によるストレスに伴う二次的影響ではなく,被験物質の胸腺に対する直接的な毒性影響によるものと推察される.
血液学検査では,600 mg/kg群で雌に血色素濃度,雌雄に平均赤血球血色素量および平均赤血球血色素濃度並びに白血球数および血小板数の減少が認められた.これに関連して,骨髄造血細胞には変化は認められなかったものの,雄で脾臓の髄外造血低減による赤脾髄の萎縮および末梢血中網状赤血球数の減少が認められ,被験物質の造血機能に対する抑制的影響が示唆された.また,雌雄で血小板数の減少に加えてプロトロンビン時間の延長も認められ,血液凝固系に対する影響も認められた.なお,脾臓の病理組織学的変化として,赤脾髄の萎縮に加えて,脾臓の被膜の炎症が150および600 mg/kg群の雄に認められた.この変化は,本物質のラットにおける簡易生殖・発生毒性試験13)では雌雄に認められており,雄に特有の変化ではないと思われるが,その病理発生については不明である.
腎臓に対する影響について,600 mg/kg群で,雄では尿素窒素の増加,雌では腎臓相対重量の増加が認められた.病理組織学検査では,腎臓に被験物質の投与に起因する変化は認められなかった.しかしながら,血液生化学検査におけるナトリウムの減少や600 mg/kg群の雄に認められた尿pHの低下も腎臓に対する影響を示唆する変化である可能性も考えられ,テトラヒドロフルフリルアルコールは腎臓に対しても軽度な影響を有するものと思われる.
精巣に対する影響について,150および600 mg/kg群で精上皮細胞の壊死が認められ,14日間の回復群では精上皮細胞の壊死は増強する傾向にあった.精子形成サイクル検査では,600 mg/kg群でセルトリ細胞に対するパキテン期精母細胞および精子細胞(round)の比率が減少していることが確認され,精祖細胞の比率には明らかな変化が認められなかった.しかしながら,簡易生殖毒性試験13)でテトラヒドロフルフリルアルコールを47日間経口投与したラットや亜慢性毒性試験3)で3か月間混餌投与したラットの精巣では,セルトリ細胞のみを残して萎縮した精細管が認められており,精祖細胞を含む生殖細胞全般に影響を及ぼすものと考えられる.
血液生化学検査では,600 mg/kg群で雌雄に総タンパク,アルブミン,カルシウム,ALP,総ビリルビン,さらに雄にLDH,トリグリセライドおよびナトリウムの減少が認められ,総タンパクの減少は150 mg/kg群の雄にも認められた.総タンパクおよびカルシウムの減少は,テトラヒドロフルフリルアルコールのラットへの90日間混餌投与による亜慢性毒性試験3)においても認められており,総タンパクの減少と関連するアルブミンの減少も含めて,テトラヒドロフルフリルアルコールによる特徴的な変化と考えられる.ALP,LDHおよび総ビリルビンの変化は減少性のものであり,毒性学的意義は小さいものと判断され,トリグセライドおよびナトリウムの減少も背景データにおける正常範囲の変化であった.
雌の下垂体重量は,600 mg/kg群では絶対および相対重量に共通して,また150 mg/kg群では相対重量の減少が認められた.下垂体に病理組織学的変化は認められなかったものの,雌の600 mg/kg群および150 mg/kg群では体重の変化は認められていないことから,下垂体重量の変化は被験物質の投与による影響と判断される.また,下垂体重量の変化と関連する可能性のある変化として,本物質のラットにおける簡易生殖・発生毒性試験13)では,雌の性周期に対する影響が認められている.
回復期間中或いは回復期間終了時の検査では,上述の投与期間中あるいは投与期間終了時の検査で認められた変化のうち,精巣の変化は増強する傾向にあった以外,回復あるいは回復傾向を示した.なお,回復群では,投与期間終了時屠殺動物で認められなった赤血球数の増加が雌雄に認められ,雌雄の平均赤血球容積および平均赤血球血色素量並びに雌の平均赤血球血色素濃度はいずれも低値を示したが,これは投与による貧血傾向に対するリバウンド現象と解せられる.また,その他にも回復群で認められられた変化はあったが,投与期間終了時屠殺動物では認められておらず,偶発的所見と判断された.
以上の結果から,テトラヒドロフルフリルアルコールのラットへの28日間反復投与による主な毒性として,胸腺,脾臓,腎臓および精巣に対する影響並びに血液学的および血液生化学的影響が認められた.無影響量は,雌雄とも40 mg/kg/dayと考えられた.
| 1) | 「12394の化学商品」化学工業日報社,東京(1994) p.701. |
| 2) | Richardson ML and Gangolli S:“The Dictionary of Substances and their Effects”,Vol. 7, The royal society of chemistry, England(1994) pp.353-354. |
| 3) | TSCA Section 8,(e)Data, 8EHQ-1091-1381 A, -0692-1381B, and -0992-1381C. |
| 4) | IUCLID (International Uniform Chemical Information Data Base) Data Sheet, EU (1995). |
| 5) | Registry of Toxic Effects of Chemical Substances (RTECS), US NIOSH(1996). |
| 6) | David EM:Drug and chemical Toxicology, 14: 319-342(1991). |
| 7) | Hazardous Substances Data Bank(HSDB), U.S. National Library of Medicine(1998). |
| 8) | ACGIH,Documentation of the Threshold Limit Values and Biological Exposure Indices(1991). |
| 9) | 片平卓男:産業医学,24: 379-387(1982). |
| 10) | Chabra RS:Toxicological Sciences, 41: 183-188 (1992). |
| 11) | 高橋道人:精巣毒性評価のための精細管アトラス,ソフトサイエンス,東京(1994)pp.15-20. |
| 12) | Matui H, Toyoda K, Kawanishi T, Mitumori K, Takahashi M:J Toxicologic Pathology, 9:285 -292(1996). |
| 13) | 野田篤ら:テトラヒドロフルフリルアルコールのラットを用いる経口投与簡易生殖毒性試験.化学物質毒性試験報告,11:175-186(2004). |
| 連絡先 | |||
| 試験責任者: | 伊藤義彦 | ||
| 試験担当者: | 野田 篤,山口真樹子, 伊藤雅也,赤木 博 | ||
| (財)畜産生物科学安全研究所 | |||
| 〒229-1132 神奈川県相模原市橋本台3-7-11 | |||
| Tel 042-762-2775 | Fax 042-762-7979 | ||
| Correspondence | ||||
| Authors: | Yoshihiko Ito(Study director) Atushi Noda, Makiko Yamaguchi, Masaya Ito, Hiroshi Akagi | |||
| Research Institute for Animal Science in Biochemistry and Toxicology | ||||
| 3-7-11 Hashimotodai, Sagamihara-shi, Kanagawa, 229-1132, Japan | ||||
| Tel +81-42-762-2775 | Fax +81-42-762-7979 | |||