1,3-ビス(2-メチルフェニル)グアニジンのラットを用いる経口投与簡易生殖毒性試験
Preliminary Reproduction Toxicity Screening Test
of 1,3-Bis(2-methylphenyl)guanidine by Oral Administration in Rats
要約
OECD既存化学物質安全性点検に係わる毒性調査の一環として,1,3-ビス(2-メチルフェニル)グアニジンの0(媒体対照),8,20および50 mg/kg/dayをCrj:CD(SD系)IGSラットの雌雄(各12匹/群)に交配前14日間,雄ではその後交配期間を含む35日間,雌では交配期間,妊娠期間および哺育3日まで通して経口投与し,親動物に対する反復投与毒性および生殖能力ならびに次世代児の発生・発育に及ぼす影響について検討した.
1.反復投与毒性
50 mg/kg群で死亡が雄2例および雌3例に認められた.生存例では,20および50 mg/kg群の雌雄で流涎,20 mg/kg群の雌および50 mg/kg群の雌雄で散瞳,自発運動の低下,緩徐呼吸,腹臥位および振戦が認められた.これらの症状のほとんどが投与開始日からみられ,投与日数の経過とともに出現例数は減少したが,流涎は投与中期ごろより投与最終日にかけて散発的に認められた.さらに,50 mg/kg群の雌雄では体重および摂餌量の低値がみられ,20 mg/kg群の雌においても摂餌量の低値が認められた.剖検,器官重量および病理組織学検査では,被験物質投与の影響は認められなかった.
2.生殖発生毒性
親動物の生殖機能に関しては,性周期,黄体数,着床痕数,着床率,交尾率,受胎率および交尾所要日数に被験物質投与の影響は認められなかった.分娩時検査では,50 mg/kg群で出産児数,新生児数,出生率および雌雄の生後0日新生児体重の低値ならびに外表異常出現率の高値が認められた.妊娠期間,死産率,出産率,新生児の性比および型別外表異常出現率については,被験物質投与の影響は認められなかった.哺育期検査では,50 mg/kg群で新生児の生後4日の生存率に低値が認められた.
以上のように,反復投与毒性では20および50 mg/kg群で被験物質投与による影響が認められた.また,生殖発生毒性においては,親動物の生殖能力に被験物質投与の影響はみられなかったが,次世代児の発生・発育への影響が50 mg/kg群で認められた.したがって,本試験条件下における無影響量は,反復投与毒性では雌雄とも8 mg/kg/day,生殖発生毒性では,親動物の生殖能力に関する無影響量は50 mg/kg/day,次世代児の発生・発育に関する無影響量は,親動物および児動物ともに20 mg/kg/dayと推察された.
方法
1.被験物質および投与液の調製
住友化学工業(東京)より提供された1,3-ビス(2-メチルフェニル)グアニジン(Lot No. 30J08,純度:99.6 wt%)を室温で保存し,試験に使用した.本被験物質は白色粉末である.試験期間中の被験物質の安定性については,本試験の投与期間終了後に上記の提供先にて分析を行った結果,投与期間中安定であったことが確認された.
投与液の調製は被験物質をメノウ製乳鉢で磨砕したのち,0.1 w/v% Tween 80添加0.5 w/v%カルボキシメチルセルロースナトリウム(CMC-Na)溶液(Tween 80:ナカライテスク,CMC-Na:ナカライテスク)で所定の濃度になるように懸濁して,1週間に1〜2回の頻度で行った.0.1 w/v%Tween 80添加0.5 w/v%CMC-Na溶液で懸濁した場合,本調製法による投与液は,均一かつ,安定であることを確認した.また,初回に調製した各濃度の投与液について濃度測定を行い,設定濃度の許容範囲(±10 %以内)にあることを確認した.
2.使用動物および飼育条件
8週齢のCrj:CD(SD)IGSラット(日本チャールス・リバー)を雌雄各55匹購入し,13日間の検疫・馴化を行った.この期間中に一般状態の観察,体重測定および性周期観察を行い,異常がないことを確認したのち,雌雄各48匹を選抜し,10週齢で試験に使用した.なお,投与開始時の体重は雄で346.2〜408.2 g,雌で216.9〜260.5 gであった.
動物は温度24 ± 2℃,湿度55 ± 10 %,照明12時間(午前7時〜午後7時)および換気回数13〜15回/時に設定したバリアーシステム区域で飼育した.検疫・馴化期間中は2〜3匹,群分け後は個別(ただし,交配期間中は雌雄各1匹)にステンレススチール製ケージに収容した.また,交尾が確認された雌動物については,床敷を入れたポリカーボネイト製ケージに個別に収容した.飼料は高圧蒸気滅菌処理した固型飼料(CRF-1,オリエンタル酵母工業)を,飲水は次亜塩素酸ナトリウムを添加(約2 ppm)した井戸水を給水瓶または自動給水装置によりそれぞれ自由に摂取させた.
3.投与量,投与方法,試験群構成および群分け
投与量は,先に実施した,一群5匹のラットに本被験物質を0,20,40及び80 mg/kg/dayで14日間反復経口投与した試験の結果から設定した.すなわち,当該試験では80 mg/kg群の雄全例と雌4例が死亡した.一般状態観察では,死亡例で自発運動の低下,緩徐呼吸,散瞳,腹臥位,側臥位および振戦が認められた.生存例では,80 mg/kg群の雌1例で自発運動の低下,緩徐呼吸,散瞳,振戦および流涎がみられ,40 mg/kg群の雌2例で自発運動の低下,散瞳,振戦および流涎が認められた.摂餌量では80 mg/kg群の雌雄および40 mg/kg群の雌で投与2日に対照群と比較して有意な低値が認められた.剖検所見では80 mg/kg群の死亡例で雄4/5例および雌3/4例に肺の暗赤色化が認められた.したがって,本試験では明らかな毒性が発現すると考えられる50 mg/kgを高用量とし,以下公比2.5をもって20および8 mg/kgを設定した.また,媒体のみを投与する対照群を設けた.1群当たりの動物数は雌雄各12匹とし,群分けは,投与開始前日にその日の体重を基に層別連続無作為化法で行った.
投与経路は経口とし,雄は交配前14日間およびその後35日間の合計49日間,雌は交配前14日間,交配期間(交尾成立までの最長14日間),妊娠期間および哺育3日までの期間,それぞれ1日1回投与した.なお,投与開始日を投与1日とした.投与容量は10 mL/kgとし,対照群には同容量の0.1 w/v%Tween 80添加0.5 w/v% CMC-Na溶液を投与した.雄ならびに交配前および交配期間中の雌の投与液量は最新体重を基に,交尾成立後の雌の投与液量は妊娠0日の体重を基にそれぞれ算出した.
4.反復投与毒性に関する観察・検査
1) 一般状態
雌雄とも,全例について一般状態の観察および生死の確認を毎日投与前および投与後の2回行った.
2) 体重および摂餌量
体重については,雄では投与期間を通して週2回測定した.雌では,交配前の投与期間および交配期間中は週2回,妊娠期間中は妊娠0,7,14および21日,哺育期間中は哺育0(分娩日)および4日に測定した.
摂餌量については,雄では交配期間を除く投与期間中に週2回測定した.雌では,交配前の投与期間中は週2回,妊娠期間中は妊娠1,7,14および21日,哺育期間中は哺育1および4日に測定した.
3) 病理学検査
雌雄ともエーテル麻酔下で外側腸骨動脈切断により放血致死させた後,解剖して諸器官および組織の肉眼的観察を行った.さらに,雌については,黄体数および着床痕数を調べ,着床率[(着床数/黄体数)×100]を算出した.剖検後,雄は精巣および精巣上体,雌は卵巣について重量を測定するとともに,雌雄とも最終投与日[投与期間:(雄)49日間,(雌)40〜49日間]の翌日の体重をもとに体重比器官重量(相対重量)を算出した.精巣,精巣上体および卵巣は10 %中性緩衝ホルマリン溶液(ただし,精巣および精巣上体はブアン液で前固定)で固定して保存した.対照群,高用量群(死亡例および全児死亡例含む),雌雄未交尾例および雌雄不妊例の精巣,精巣上体ならびに卵巣についてはパラフィン切片としたのち,ヘマトキシリン・エオジン染色を施して鏡検した.
5.生殖発生毒性に関する観察・検査
1) 生殖機能
雌について,投与開始日(投与1日)から15日間,毎日午前の一定時間に膣垢を採取し,性周期検査を行った.性周期検査では,発情回数を算出するとともに,発情期から次の発情期までの間の日数を発情周期日数とし,平均発情周期を算出した.
交配は投与15日の午後4時頃から,雌雄(12週齢)1対1で一晩同居させる方法で行い,翌朝膣垢中の精子または膣栓の存在により交尾を確認し,その日を妊娠0日とした.また,交配は同一群内で行い,交配期間は最長2週間とした.交配期間終了後,交尾所要日数,交尾率[(交尾動物数/同居動物数)×100]および受胎率[(妊娠動物数/交尾動物数)×100]を算出した.
2) 分娩および哺育状態ならびに新生児の観察
交尾が確認された雌については全例を自然分娩させ,分娩徴候を含めた分娩状態ならびに授乳および営巣などの哺育状態を観察するとともに,妊娠期間および出産率[(生児出産雌数/妊娠雌数)×100]を算出した.なお,分娩の確認は午前中に限定し,午後12時を過ぎて分娩した個体は,翌日に分娩をしたものとみなした.出産児については,分娩時に出産児数,新生児数,死産児数,新生児の性別および外表異常を検査した.新生児については,出生日および哺育4日に体重を個体ごとに測定するとともに出生率[(新生児数/着床痕数)×100],死産率[(死産児数/出産児数)×100]および新生児の4日の生存率[(哺育4日の生児数/出生児数)×100]を算出した.哺育4日に新生児の全例をエーテル麻酔下で放血致死させ,器官・組織の肉眼的観察を行った.また,出産児(死産児,死亡児および外表異常児を含む)については,剖検後一腹単位で純エタノールに固定保存した.
6.統計解析
体重,摂餌量,交尾所要日数,性周期検査値(発情周期および発情回数),器官重量,体重比器官重量,妊娠期間,黄体数,着床痕数,総出産児数,新生児数および新生児体重については,各群ごとに平均値と標準偏差を求め,対照群と被験物質投与群間で分散の均一性をBartlett法により検定した.分散が均一な場合は,Dunnettの多重比較検定を用いて対照群との比較を行い,分散が均一でない場合は,Steelの多重比較検定を用いて対照群との比較を行った.いずれの場合も有意水準を1および5 %とし,両側検定とした.また,交尾率,受胎率,出産率および新生児の性比についてはχ2検定により,着床率,死産率,外表異常率,型別外表異常児出現率,出生率および新生児の4日の生存率についてはWilcoxonの順位和検定により,病理組織学検査については Mann-WhitneyのU検定により対照群と各投与群間の比較を行った.いずれの場合も有意水準を1および5 %とした.なお,新生児に関する測定値については一腹単位で処理した.
結果
1.反復投与毒性
1) 一般状態
50 mg/kg群の雄で投与6および7日に各1例,雌で投与1日に2例および分娩当日に1例が死亡した.これらの死亡例は,死亡当日に散瞳,自発運動の低下,緩徐呼吸,腹臥位および振戦が投与10から20分ごろよりみられ,間代性痙攣あるいは呼吸困難を呈し,早いもので投与後20分,遅いもので投与後3時間30分に死亡した.また,分娩当日に死亡した雌1例では,これらの症状に加え投与直後から流涎が認められた.
生存例の雄では,50 mg/kg群で散瞳が投与1日から9日までにほぼ全例にみられ,これに加え緩徐呼吸,自発運動の低下および腹臥位がほぼ全例で散発的に認められた.これらの症状の発現例数は投与日数の経過とともに減少した.また,振戦が投与期間を通して少数例で散発的にみられ,さらに,流涎が投与22日から投与最終日までに全例で散発的に認められた.20 mg/kg群では,流涎が投与28日から投与最終日までに半数例で散発的に認められた.
生存例の雌では,50 mg/kg群で散瞳,緩徐呼吸,自発運動の低下および腹臥位が投与1日から哺育0日までにほぼ全例で散発的にみられたが,発現例数は投与日数の経過とともに減少した.また,20 mg/kg群においても散瞳,緩徐呼吸,自発運動の低下および腹臥位が投与2および3日に各1例で認められた.これらの症状に加え,50 mg/kg群で振戦が投与1日から妊娠5日までに半数例で散発的に認められた.さらに,流涎が50 mg/kg群で妊娠4日から哺育3日までにほぼ全例で散発的にみられ,20 mg/kg群でも妊娠14日から哺育3日までにほぼ半数例で散発的に認められた.
これらの症状は,雌雄とも投与直後から4時間の間に出現し,翌日までには消失した.
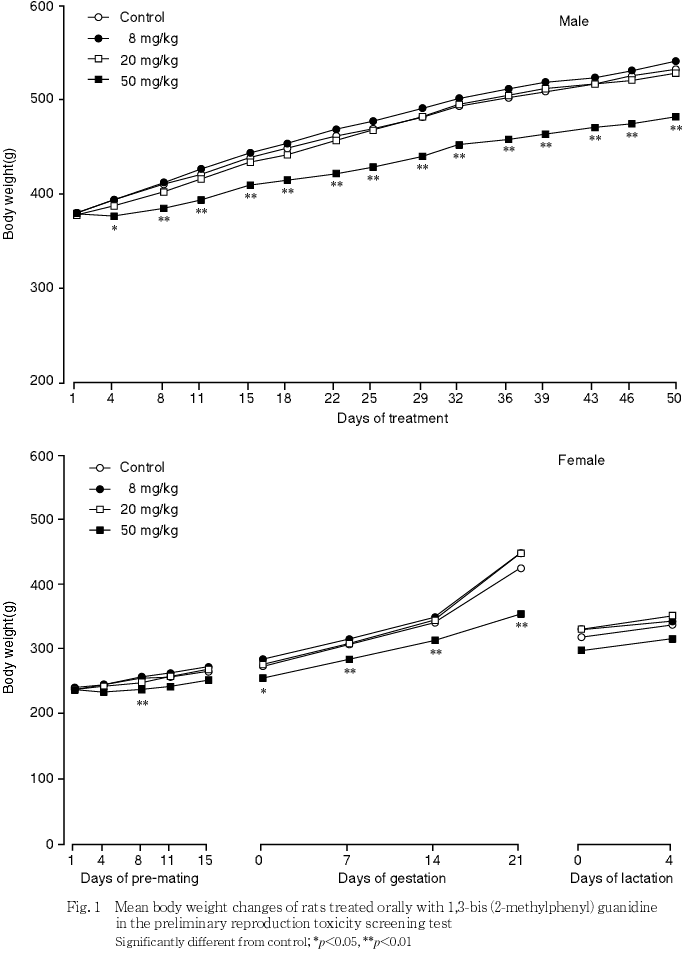
2) 体重(Fig.1)
雄では,50 mg/kg群で投与4から50日に対照群と比較して有意な低値が認められた.
雌では,50 mg/kg群で投与期間を通して対照群と比較して低値傾向がみられ,投与8日および妊娠期間を通して対照群と比較して有意な低値が認められた.
3) 摂餌量
雄では,50 mg/kg群で投与2から15日に対照群と比較して有意な低値が認められた.
雌では,50 mg/kg群で投与期間を通して低値傾向がみられ,投与2から11日,妊娠7日および哺育4日に対照群と比較して有意な低値が認められた.また,20 mg/kg群においても投与4および8日に対照群と比較して有意な低値が認められた.なお,20 mg/kg群の雄で投与39日および雌で妊娠21日,哺育1ならびに4日に高値がみられたが,体重に変動はみられず,50 mg/kg群の雌雄に同様の変化は認められていないことから,被験物質投与と関連のない偶発的変化と考えられた.
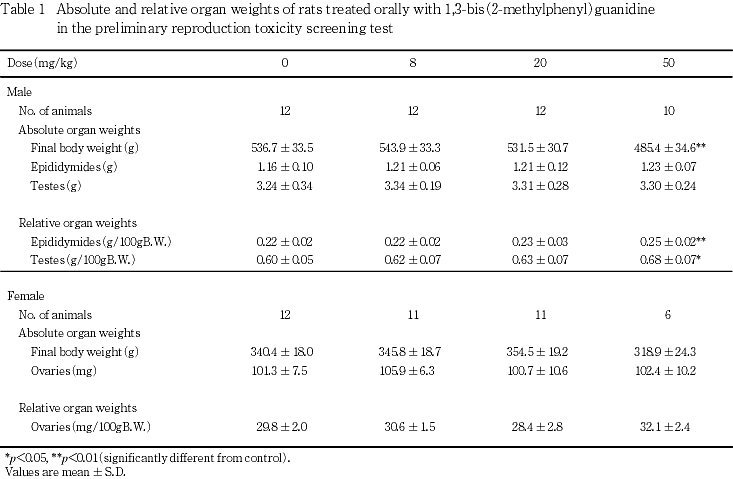
4) 器官重量(Table 1)
雄では,50 mg/kg群で精巣および精巣上体の相対重量に対照群と比較して有意な高値がみられたが,絶対重量では対照群との間に差は認められなかった.なお,50 mg/kg群では,最終体重に対照群と比較して有意な低値が認められた.
雌では,被験物質投与群と対照群の間に有意な差は認められなかった.
5) 剖検所見
雌雄の生存例,死亡例,未交尾例および不妊例,雌の未分娩例および全児死亡例の剖検において異常は認められなかった.
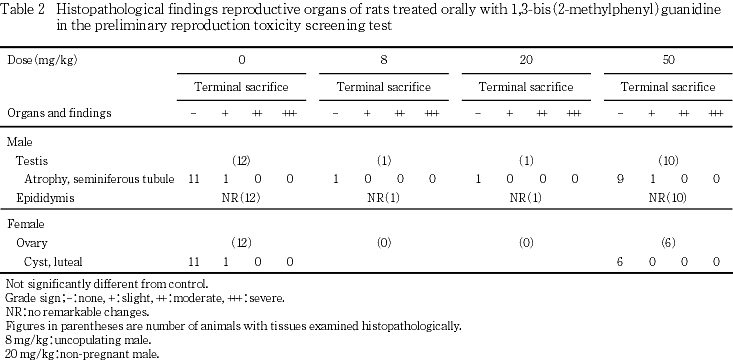
6) 病理組織学検査(Table 2)
雌雄とも被験物質投与による影響は認められなかった.雄の生存例では,対照群および50 mg/kg群の各1例で精巣に軽度の精細管の萎縮が認められた.雌の生存例では,対照群および全児死亡した50 mg/kg群の各1例で卵巣に黄体嚢胞が認められた.その他の雌雄の死亡例,未交尾例および不妊例ならびに雌の未分娩例および全児死亡例に異常は認められなかった.
2.生殖発生毒性
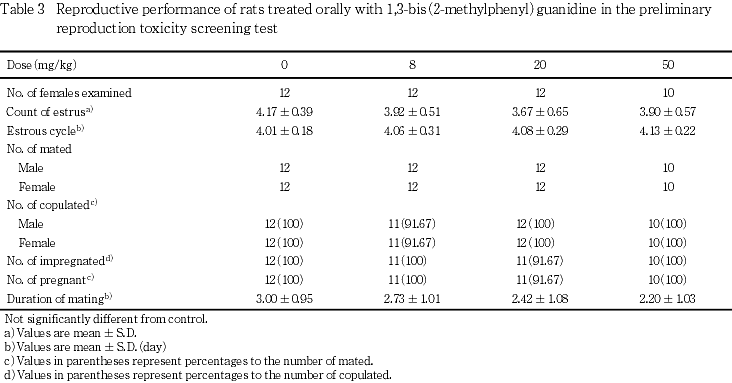
1) 生殖機能(Table 3)
性周期検査では,被験物質投与群と対照群との間で発情周期に有意な差は認められなかった.
生殖能力検査では,8 mg/kg群の1組を除いてすべてに交尾がみられ,20 mg/kg群の1組を除いて妊娠が認められた.したがって,交尾率は対照群,8,20および50 mg/kg群でそれぞれ100,91.67,100および100 %,受胎率は,100,100,91.67および100 %であり,対照群と被験物質投与群との間に有意な差は認められなかった.また,交尾所要日数においても,対照群と被験物質投与群との間に有意な差は認められなかった.なお,8 mg/kg群の未交尾例および20 mg/kg群の不妊例では,雌雄とも生殖器の剖検および病理組織学検査において変化はみられず,受胎能の欠如を示唆する所見は認められなかった.
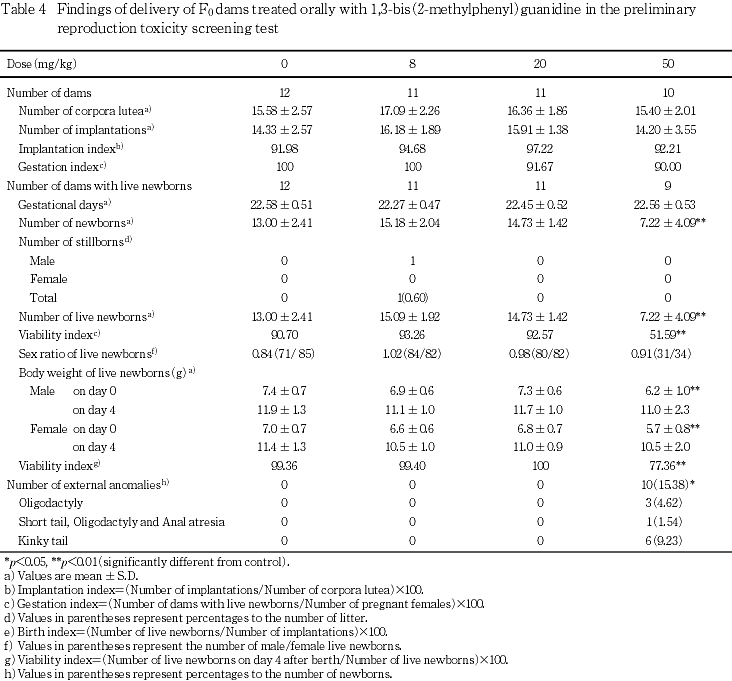
2) 分娩および哺育ならびに新生児の観察(Table 4)
分娩時の検査では,50 mg/kg群で出産児数,新生児数,出生率および生後0日の雌雄新生児体重に対照群と比較して有意な低値が認められた.また,新生児の外表検査では50 mg/kg群で欠指が3例,曲尾が6例,および短尾,欠指,鎖肛の合併が1例にみられ,外表異常出現率で対照群と比較して有意な高値が認められた.妊娠期間,黄体数,着床痕数,着床率,死産率,出産率,新生児の性比および型別外表異常出現率では,対照群と被験物質投与群との間に有意な差は認められなかった.
哺育期の検査では,50 mg/kg群で新生児の生後4日の生存率に対照群と比較して有意な低値が認められた.
考察
1.反復投与毒性試験
50 mg/kg群の雌雄では,投与初期の投与後に散瞳,間代性痙攣および振戦など被験物質の中枢神経系への影響を示唆する変化が高頻度にみられ,雌雄各2例が投与7日までに死亡した.また,50 mg/kg群の雌1例が同様の神経症状を呈し,分娩当日に死亡した.また,20 mg/kg群においても雌で散瞳,自発運動の低下,緩徐呼吸および腹臥位が認められた.これらの症状のほとんどは,投与日数の経過とともに出現頻度は減少した.このほか,20および50 mg/kg群の雌雄で流涎が認められた.
体重では,50 mg/kg群の雌雄で投与期間を通して,低値あるいは低値傾向がみられ,摂餌量にも低値あるいは低値傾向が認められた.また,摂餌量の低値は20 mg/kg群においても認められた.
剖検では,雌雄の生存例および死亡例ならびに雌の未交尾例,不妊例,未分娩例および全児死亡例のいずれにおいても異常は認められなかった.病理組織学検査では,生存例の50 mg/kg群の雄1例で精巣に軽度の精細管の萎縮,全児死亡した50 mg/kg群の雌1例で卵巣に黄体嚢胞がみられたが,同様の所見は対照群においても認められており,出現例数も少ないことから被験物質投与と関連のない偶発的変化と考えられた.器官重量測定では,50 mg/kg群の雄で精巣および精巣上体の相対重量が対照群と比較して有意な高値を示したが,いずれも絶対重量には対照群との差が認められないことから,最終体重の低値に起因した重量変動と考えられた.
以上のように,雌雄とも50 mg/kg群で死亡の発生がみられ,生存例においても20および50 mg/kg群で一般状態,体重および摂餌量に被験物質投与による影響が認められていることから,本試験条件下における1,3-ビス(2-メチルフェニル)グアニジンの反復投与毒性に関する無影響量は,雌雄とも8 mg/kg/dayと推察された.
2.生殖発生毒性
親動物の生殖機能に関しては,性周期,交尾所要日数,黄体数,交尾率,着床痕数,出産率および受胎率に被験物質投与の影響は認められなかった.
分娩時の観察では,50 mg/kg群で出産児数,新生児数および出生率の低値が認められた.これらの変化については,黄体数,着床痕数,着床率および死産率に変化がみられていないことから,死亡胚の増加が原因と考えられ,本被験物質の胚致死作用が示唆された.新生児の外表検査においても,50 mg/kg群では外表異常児が10例(欠指が3例,曲尾が6例,および短尾,欠指,鎖肛の合併が1例)にみられ,外表異常出現率は高値を示した.さらに,50 mg/kg群では生後0日の雌雄新生児体重に低値が認められ,被験物質投与による発育抑制が認められた.妊娠期間および新生児の性比には被験物質投与の影響は認められなかった.哺育期の観察では,50 mg/kg群で新生児の生後4日の生存率に低値がみられたが,母動物の哺育行動に異常はみられていないことから,胎生期での被験物質の曝露が新生児の生存性に影響を及ぼした可能性が考えられた.
以上のように,親動物の生殖機能に被験物質投与の影響はみられなかった.次世代児の発生・発育に及ぼす被験物質投与の影響として,50 mg/kg群で出生率の低下,外表異常出現率の高値,出生児体重の低値および生後の生存率の低下が認められた.したがって,本試験条件下における1,3-ビス(2-メチルフェニル)グアニジンの親動物の生殖機能に関する無影響量は50 mg/kg/day,次世代児の発生・発育に関する無影響量は,親動物および児動物ともに20 mg/kg/dayと推察された.
| 連絡先 |
| 試験責任者: | 木村栄介 |
| 試験担当者: | 大田泰史,浜村政夫,大西幹男,
和泉宏幸,鍬先恵美子 |
| (株)パナファーム・ラボラトリーズ安全性研究部 |
| 〒869-0425 熊本県宇土市栗崎町1285 |
| Tel 0964-23-5111 | Fax 0964-23-2282 | |
| Correspondence |
| Authors: | Eisuke Kimura(Study director)
Takafumi Ohta, Masao Hamamura,
Mikio Oonishi, Hiroyuki Izumi,
Emiko Kuwasaki |
| Safety Assessment Laboratory, Panapharm Laboratories Co., Ltd. |
| 1285 Kurisaki-machi, Uto-shi, Kumamoto, 869-0425, Japan |
| Tel +81-964-23-5111 | Fax +81-964-23-2282 | |





