2,4-ジ-tert-ブチルフェノールのラットを用いる28日間反復投与毒性試験
Twenty-eight-day Repeat Dose Oral Toxicity Test of 2,4-Di-tert-butylphenol in Rats
要約
OECD既存化学物質安全性点検に関わる毒性調査の一環として,2,4-ジ-tert-ブチルフェノールを0(媒体対照),5,20,75および300 mg/kgの用量で1群雌雄各6匹のCrj:CD(SD)IGSラットに28日間反復経口投与する毒性試験を実施した.対照群および300mg/kg群にはそれぞれ雌雄各6匹の14日間回復群を設けた.
死亡はいずれの群にもみられなかった.一般状態の観察では,300 mg/kg群の雌雄で流涎が認められた.本症状は投与直後から発現し,ほとんどの例で投与後約30分以内に消失する変化であった.体重および摂餌量では,被験物質投与の影響は認められなかった.
尿検査では,300 mg/kg群の雌雄で尿量の増加,尿浸透圧および比重の低下,ならびに尿色調の淡黄色化が認められた.
血液学検査では,300 mg/kg群の雌でヘモグロビン量およびヘマトクリット値の減少,ならびに分葉核好中球比の増加が認められ,雄でプロトロンビン時間およびAPTTの延長が認められた.
血液生化学検査では,75および300 mg/kg群の雌で総コレステロールおよびリン脂質の増加が認められた.
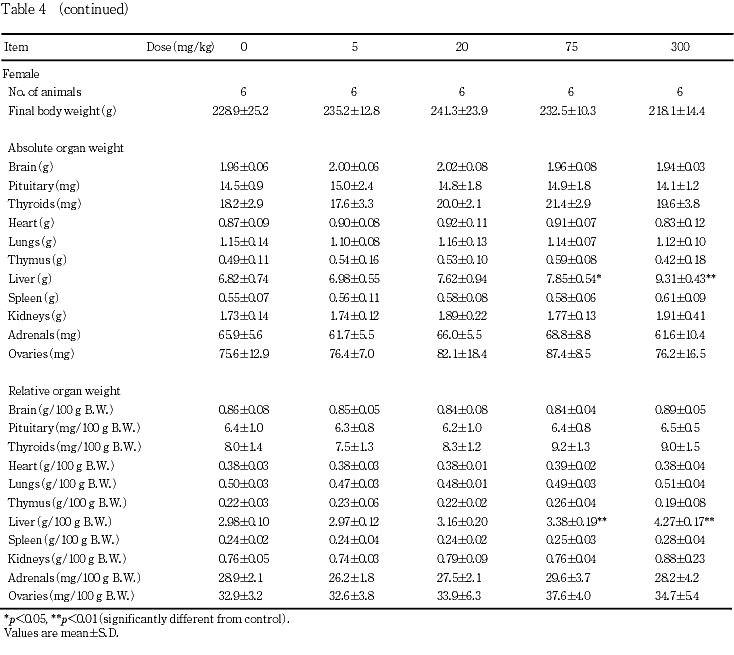
器官重量では,75 mg/kg群の雌および300 mg/kg群の雌雄で肝臓重量の増加が認められた.
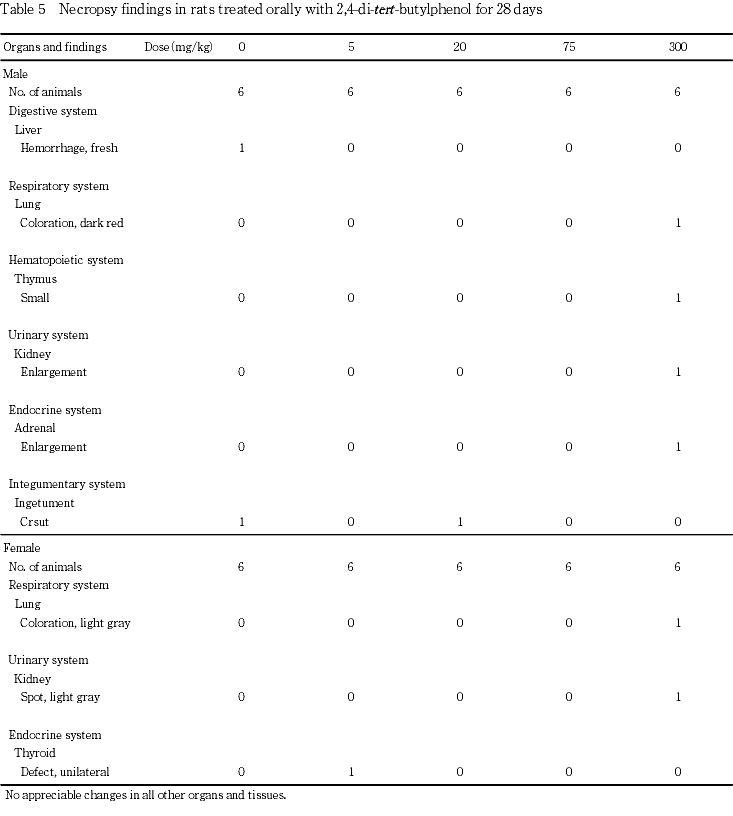
剖検では,300 mg/kg群の雄で腎臓の肥大が認められ,雌で腎臓の灰白色点が認められた.
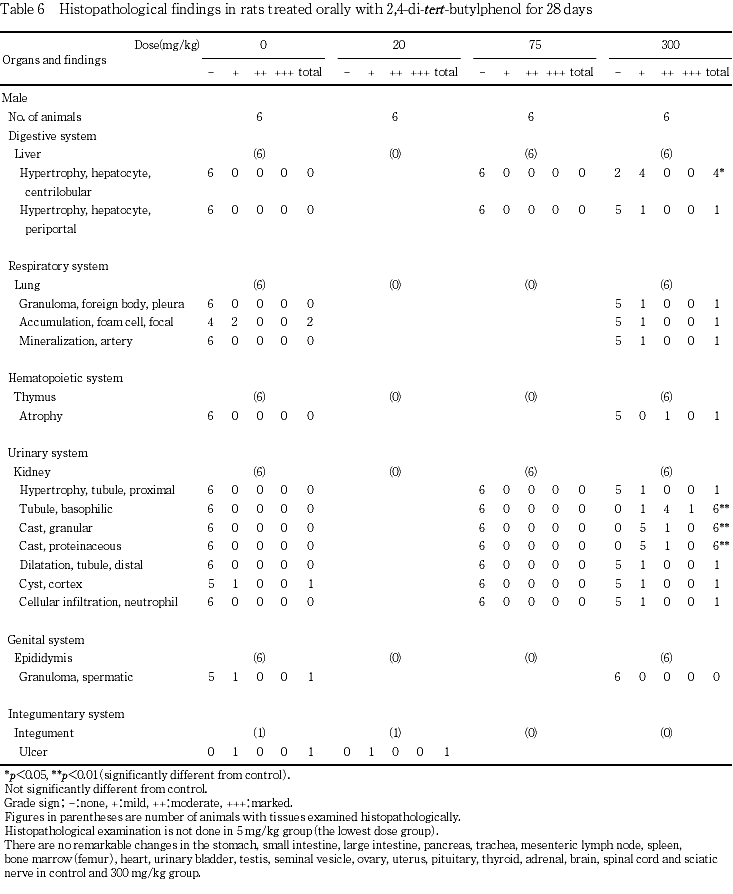
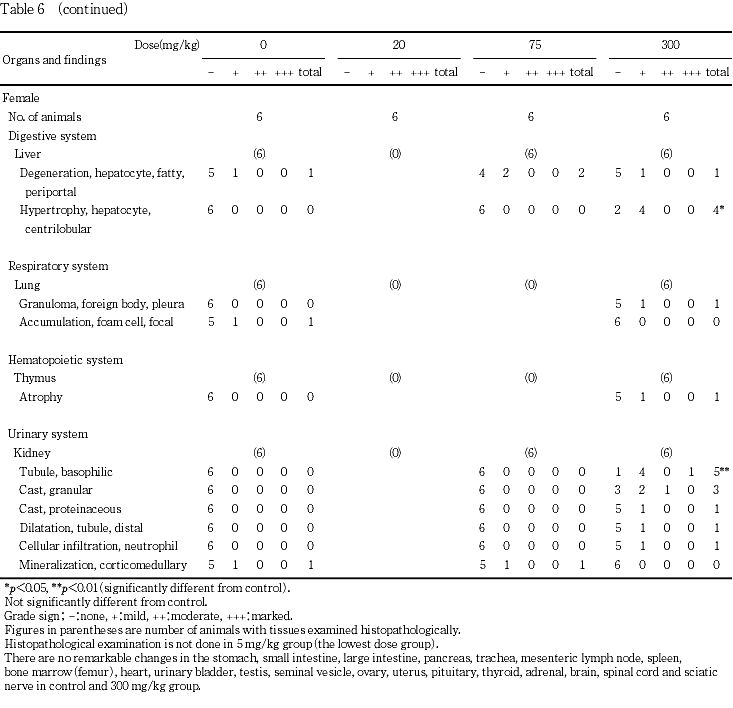
病理組織学検査では,300 mg/kg群の雌雄で小葉中心性の肝細胞の肥大,ならびに腎臓の好塩基性尿細管,顆粒円柱および蛋白円柱が認められた.さらに,腎臓で肉眼的変化のみられた例に好中球性細胞浸潤,遠位尿細管の拡張あるいは近位尿細管の肥大が認められた.
回復試験では,投与期間中および投与期間終了時にみられた変化に回復性が認められた.
以上の結果から,本試験条件下における無影響量は雄で75 mg/kg/day,雌で20 mg/kg/dayと考えられた.
方法
1. 被験物質および投与液の調製
2,4-ジ-tert-ブチルフェノール(純度99.67 %,Lot No. L874,大日本インキ化学工業(株)提供,千葉)は淡黄褐色の固体である.入手後被験物質は室温,遮光下で保存し,投与期間終了後に提供元にて分析を行い,試験期間中安定であったことを確認した.媒体にはコーンオイル(Lot No. V9F1519,ナカライテスク(株))を使用し,これに被験物質を0.1,0.4,1.5および6.0 w/v%の濃度になるように溶解して投与液を調製した.調製は週1回の頻度で行い,調製した投与液は褐色ガラスバイアルに入れて室温保存した.なお,初回調製時に投与液の濃度を測定し,設定値の± 5 %以内にあることを確認した.また,投与開始前に本調製法による0.1および20 w/v%のコーンオイル溶液は,室温散光下で8日間安定であることを確認した.
2. 使用動物および飼育条件
5週齢のCrj:CD(SD)IGSラット(日本チャールス・リバー(株))を雌雄各51匹購入し,雄は6日間,雌は7日間の検疫馴化を行ったのち,雌雄各42匹を次項に記載の方法で選んで6週齢で試験に使用した.投与開始時の体重は,雄が188.9〜218.5 g,雌が137.5〜169.8 gであった.動物は,温度24 ± 2 ℃,湿度55 ± 10 %,照明12時間(午前7時〜午後7時)および換気回数13〜15回/時に設定したバリアーシステム飼育室でステンレススチール製ハンガーケージに個別に収容して飼育した.飼料は高圧蒸気滅菌処理した固型飼料(MF,オリエンタル酵母工業(株))を,飲水は次亜塩素酸ナトリウムを添加(約2 ppm)した井戸水をそれぞれ自由に摂取させた.
3. 投与量,投与方法,試験群構成および群分け
投与量は,予備試験の結果より設定した.すなわち,予備試験においては,500 mg/kg群の雌で自発運動の低下,緩徐呼吸および体温低下がみられ,1/4例が死亡した.また,500 mg/kg群の雌雄で体重増加抑制傾向,血清総蛋白質,アルブミンおよび総コレステロールの増加,腎臓の灰白色斑,ならびに肝臓重量の増加が認められた.したがって,本試験では,300 mg/kgを高用量に設定し,以下公比約4をもって,75,20および5 mg/kgをそれぞれ中用量2,中用量1および低用量に設定した.試験群は,上記4用量に媒体のみを投与する対照を加え計5群とした.1群当たりの動物数は,投与期間終了時の剖検例として各群とも雌雄各6匹とし,さらに,対照群および高用量群には14日間の回復期間終了時の剖検例として各群とも雌雄各6匹を設けた.群分けは,投与開始前日の体重を基に層別連続無作為化法で行った.
投与経路は経口とし,胃管を用いた強制投与を1日1回,28日間反復して行った.投与容量は5 mL/kgとし,個体ごとの投与液量は最新の体重を基に算出した.回復試験に供した動物は,投与期間終了後に14日間無処置で飼育した.
4. 検査項目
1) 一般状態の観察,体重および摂餌量の測定
一般状態及び死亡の有無については,投与期間中,投与開始日から投与6日(雌)ないし7日(雄)までは毎日投与前および投与後の計2回,それ以降は投与前,投与直後および投与後2〜3時間の計3回,回復期間中は毎日午前,午後の計2回観察した.また,体重および摂餌量を投与期間および回復期間を通して週2回の頻度で測定した.
2) 尿検査
投与第4週(検査当日の投与前)および回復第2週に,代謝ケージにて絶食,給水下で午前中の時間に採取した新鮮尿を用いて,比色試験紙(プレテスト8a,和光純薬工業(株))によりpH,蛋白質,ブドウ糖,ケトン体,ビリルビン,潜血およびウロビリノーゲンを検査した.さらに,新鮮尿は1500回転/分で5分間遠心分離し,得られた尿沈渣について鏡検した.また,新鮮尿採取後に給餌,給水下で採取した24時間蓄積尿を用いて,尿量(メスシリンダー測定),色調(肉眼的観察),浸透圧(氷点降下法;OSMOMETER OM801, VOGEL社)および比重(屈折率法;尿屈折計,(株)アタゴ)を測定した.
3) 血液学検査
投与期間および回復期間終了後に,動物を18時間以上絶食させたのち,ペントバルビタール・ナトリウム(30 mg/kg)の腹腔内投与による麻酔下に開腹し,後大静脈から採血を行った.採取した血液の一部はEDTA-2K処理(EDTA-2K加血液)して多項目自動血球計数装置(Sysmex CC-780, シスメックス(株))を用いて,白血球数(電気抵抗検出方式),赤血球数(電気抵抗検出方式),ヘモグロビン量(Oxyhemoglobin法),ヘマトクリット値(血球pulse波高値検出方式)および血小板数(電気抵抗検出方式)を測定し,赤血球数,ヘモグロビン量およびヘマトクリット値の測定結果を基に平均赤血球容積(MCV),平均赤血球血色素量(MCH)および平均赤血球血色素濃度(MCHC)を算出した.また,血液の一部は塗抹標本とし,May-Gr nwald-Giemsa染色を施して白血球百分比を算出するとともに,New methylene blue超生体染色を施して,網状赤血球率を算出した.さらに,3.8 %クエン酸ナトリウム加血液を3000回転/分で15分間遠心分離し,得られた血漿を用いて,全自動血液凝固測定装置(Sysmex CA-5000, シスメックス(株))により,プロトロンビン時間(散乱光検出方式)および活性化部分トロンボプラスチン時間(APTT, 散乱光検出方式)を測定した.
nwald-Giemsa染色を施して白血球百分比を算出するとともに,New methylene blue超生体染色を施して,網状赤血球率を算出した.さらに,3.8 %クエン酸ナトリウム加血液を3000回転/分で15分間遠心分離し,得られた血漿を用いて,全自動血液凝固測定装置(Sysmex CA-5000, シスメックス(株))により,プロトロンビン時間(散乱光検出方式)および活性化部分トロンボプラスチン時間(APTT, 散乱光検出方式)を測定した.
4) 血液生化学検査
血液学検査に引き続き採取した血液を室温で約60分間放置後,3000回転/分で10分間遠心分離し,得られた血清(ただし,乳酸脱水素酵素およびクレアチンリン酸化酵素については,ヘパリン・ナトリウム塗布注射筒にて採血し,同様に遠心分離して得られた血漿)を用いて自動分析装置(7170,(株)日立製作所)により,総蛋白質(T.protein, Biuret法),アルブミン(BCG法),A/G比(総蛋白質およびアルブミンより算出),総ビリルビン(T.bilirubin, Vanadate oxidation法),GOT(UV-rate法),GPT(UV-rate法),γ-グルタミルトランスペプチダーゼ(γ-GTP, L-γ-Glutamyl-3-hydroxymethyl-4-nitroanilide基質法), アルカリ性フォスファターゼ(ALP, ρ-Nitrophenylphosphate acid基質法),乳酸脱水素酵素(Wr blewski-La due法),クレアチンリン酸化酵素(JSCC法),総コレステロール(T.cholesterol, COD-HDAOS法),トリグリセライド(GPO-HDAOS法, glycerol blanking法),リン脂質(Choline oxidase-DAOS法),グルコース(Hexokinase-G-6-PDH法),尿素窒素(BUN, Urease-GLDH法),クレアチニン(Jaff
blewski-La due法),クレアチンリン酸化酵素(JSCC法),総コレステロール(T.cholesterol, COD-HDAOS法),トリグリセライド(GPO-HDAOS法, glycerol blanking法),リン脂質(Choline oxidase-DAOS法),グルコース(Hexokinase-G-6-PDH法),尿素窒素(BUN, Urease-GLDH法),クレアチニン(Jaff 法),無機リン(IP, PNP-XOD法)およびカルシウム(Ca, MXB法)を測定した.また,電解質分析装置(PVA-γIII, (株)アナリティカル・インスツルメンツ)によりナトリウム(Na, 電極法),カリウム(K, 電極法)およびクロール(Cl, 電量滴定法)を測定した.
法),無機リン(IP, PNP-XOD法)およびカルシウム(Ca, MXB法)を測定した.また,電解質分析装置(PVA-γIII, (株)アナリティカル・インスツルメンツ)によりナトリウム(Na, 電極法),カリウム(K, 電極法)およびクロール(Cl, 電量滴定法)を測定した.
5) 器官重量の測定,剖検および病理組織学検査
採血後に放血死させ,剖検した.剖検後に,脳,下垂体,甲状腺(上皮小体を含む),心臓,肺(気管支を含む),胸腺,肝臓,脾臓,腎臓,副腎,精嚢,精巣上体,精巣および卵巣を摘出して器官重量(絶対重量)を測定するとともに,剖検日の体重を基に体重比器官重量(相対重量)を算出した.これらの器官に加え,脊髄(頸部から胸部),眼球,気管,膵臓,胃,十二指腸,空腸,回腸(パイエル板を含む),盲腸,結腸,直腸,腸間膜リンパ節,膀胱,子宮,骨髄(大腿骨),坐骨神経および肉眼的異常部位を採取して10 %中性緩衝ホルマリン溶液(眼球は2.5 %グルタールアルデヒド溶液,精巣および精巣上体はブアン液で前固定)に固定した.投与期間終了時の対照群および300 mg/kg群の眼球を除く上述した器官および肉眼的異常部位については,常法に従ってパラフィン切片を作製し,ヘマトキシリン・エオジン染色を施して光学顕微鏡下で観察した.さらに,肝臓および腎臓では,被験物質投与に関連したと考えられる変化が300 mg/kg群で認められたことから,投与期間終了時には75 mg/kg群を,また回復期間終了時には対照群および300 mg/kg群について同様の観察を行った.なお,回復期間終了時にみられた肉眼的異常部位についても検査を実施した.
5. 統計解析
体重,摂餌量,尿検査(定性反応を除く),血液学検査,血液生化学検査,器官重量および体重比器官重量について,各群ごとに平均値と標準偏差を求め,Bartlett法により分散の均一性を検定した.分散が均一な場合はDunnettの多重比較検定を用いて,分散が均一でない場合はSteelの多重比較検定を用いて対照群との比較を行った.また,病理組織学検査においてみられた所見については,Mann-WhitneyのU検定法を実施した.いずれの場合も有意水準を1および5 %とした.
結果
1. 一般状態
すべての群に死亡例はなく,5,20および75 mg/kg群では観察期間を通して被験物質投与に関連した一般状態の変化は認められなかった.
300 mg/kg群では,流涎が雄で投与8日以降,雌で投与7日以降に認められた.流涎は雄で2〜6例/日,雌で2〜7例/日の頻度でみられ,総発現例数は雄で9例,雌で11例であった.発現時間は,投与直後からみられ,ほとんどの例で投与後約30分以内に消失し,少数例で投与後2ないし3時間以内には消失した.回復期間において,300 mg/kg群の雌雄で変化は認められなかった.
その他,偶発的な変化として,対照群および20 mg/kg群の雄各1例で頸部に外傷(掻創)が認められ,300 mg/kg群の雄1例で上顎切歯の歯折が認められた.
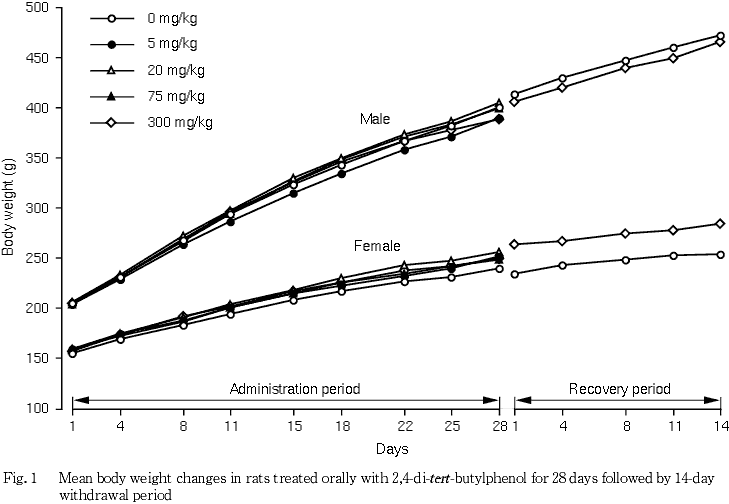
2. 体重(Fig. 1)
投与期間を通して,2,4-ジ-tert-ブチルフェノール各群は対照群とほぼ同様な推移を示した.なお,個体別にみると300 mg/kg群の雄1例で投与18および22日に増加抑制,ならびに投与25および28日に減少が認められ,また,雌1例で投与25日に明らかな減少が認められたが,後述の通り病理組織学的検査の結果から誤投与によるものと推測された.
回復期間において,300 mg/kg群の雄は対照群とほぼ同様な推移を示した.300 mg/kg群の雌で体重値は対照群より高値を示したが,体重増加量は対照群とほぼ同様であり,回復期間開始時に体重がすでに対照群より高値であったことから,偶然に回復試験に供された動物の体重値の高いものが偏ったことが原因と考えられ,被験物質投与との関連はないと判断した.
3. 摂餌量
投与期間を通して,2,4-ジ-tert-ブチルフェノール各群の雄は対照群とほぼ同様な推移を示した.300 mg/kg群の雌で投与2日に減少および投与28日に増加が認められたが,投与期間中に一定の傾向を示したものではなく,一過性の変化であったことから,被験物質投与との関連性はないと判断した.なお,個体別にみると300 mg/kg群の雄1例で投与18日以降に減少あるいは減少傾向が認められ,また,雌1例 で投与25日に減少が認められた.
回復期間において,300 mg/kg群は対照群とほぼ同様な推移を示した.
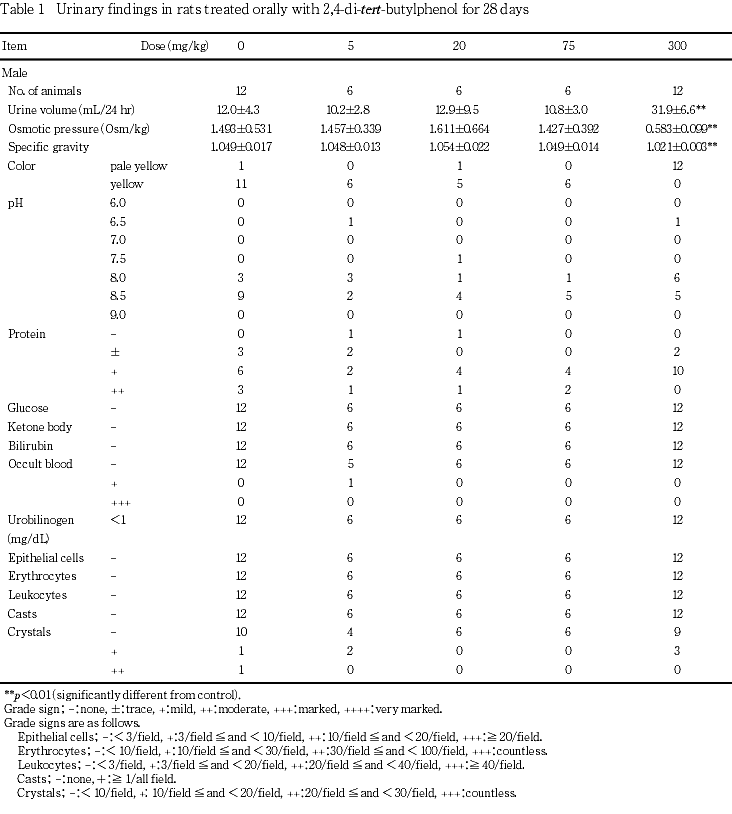
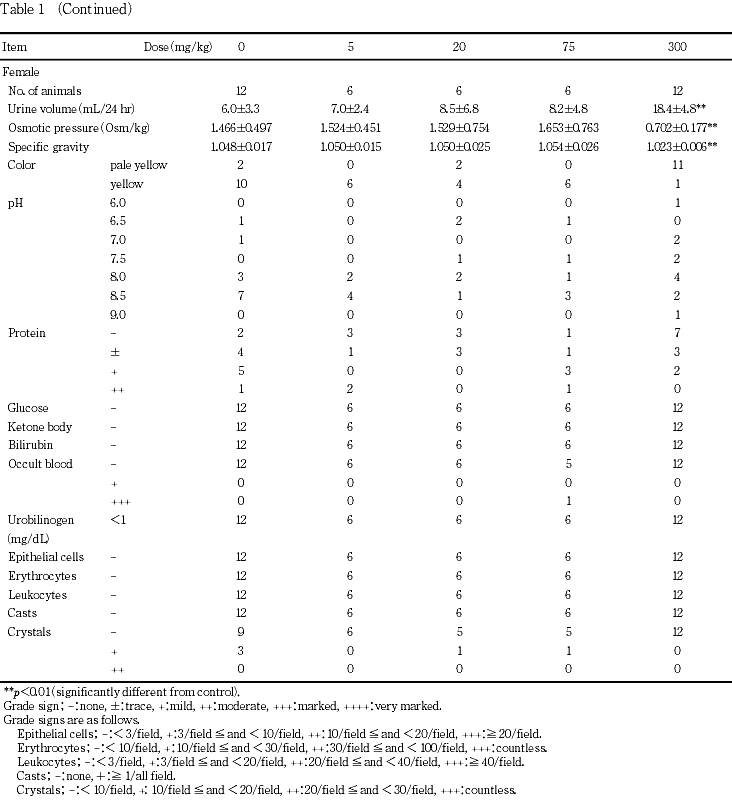
4. 尿検査(Table 1)
投与4週の検査では,300 mg/kg群の雌雄で尿量の増加,尿浸透圧および比重の低下,ならびに尿色調の淡黄色化が認められた.
回復2週の検査では,300 mg/kg群の雌雄で変化は認められなかった.
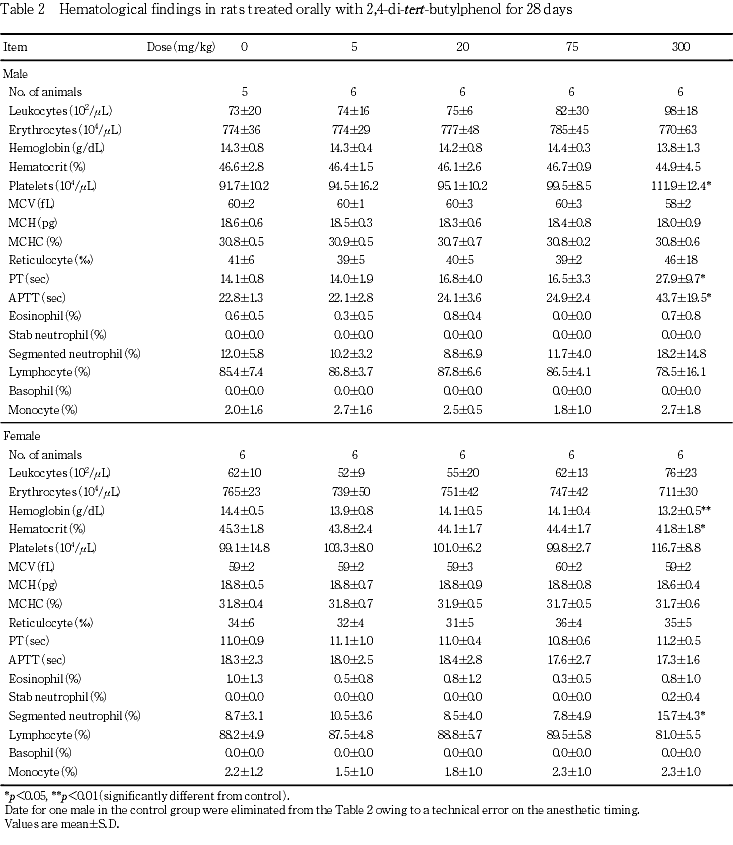
5. 血液学検査(Table 2)
投与期間終了時の検査では,300 mg/kg群の雌でヘモグロビン量およびヘマトクリット値の減少,ならびに分葉核好中球比の増加が認められ,300 mg/kg群の雄でプロトロンビン時間およびAPTTの延長が認められた.また,同群の雄で血小板数の増加が認められたが,生理的な変動範囲内の変化であった.なお,個体別にみると300 mg/kg群の雄1例で赤血球数,ヘモグロビン量,ヘマトクリット値およびリンパ球比の減少,ならびに分葉核好中球比の増加が認められた.
その他,対照群の雄1例で麻酔時の腹腔内投与において,誤投与により肝臓を出血させたことから,すべての測定値は試験の評価から除外した.
回復期間終了時の検査では,300 mg/kg群の雄でMCHの減少が認められ,雌でMCHCの減少およびAPTTの短縮が認められたが,いずれも軽度な変化であり,かつ同様の変化は投与期間終了時の検査時には認められていないことから,2,4-ジ-tert-ブチルフェノール投与との関連性はないと考えられた.
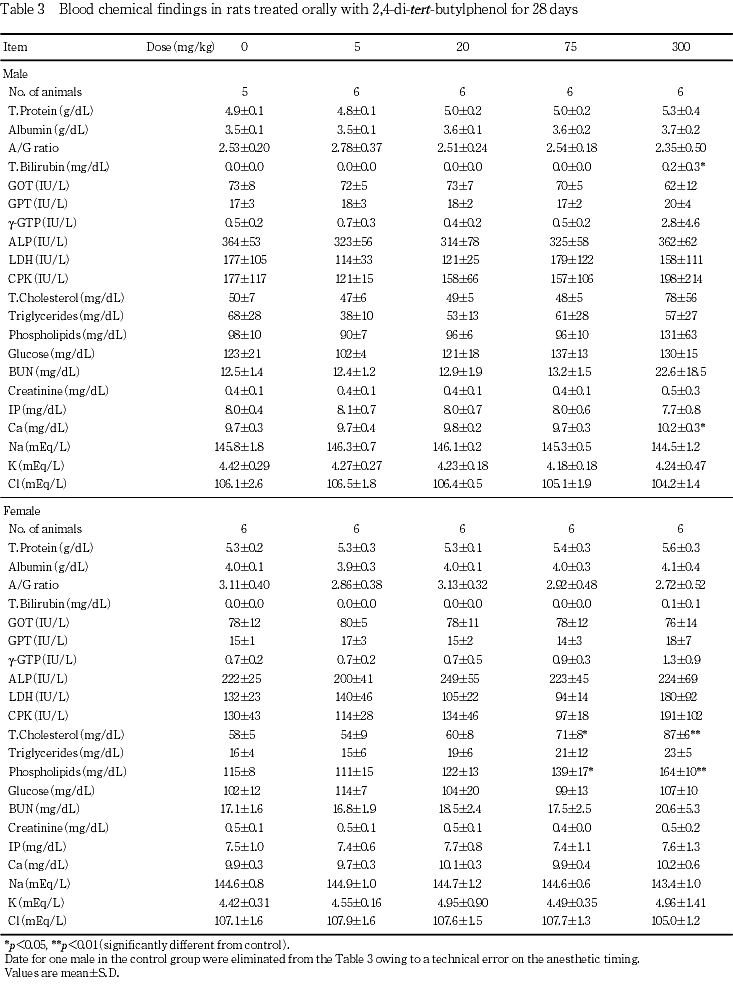
6. 血液生化学検査(Table 3)
投与期間終了時の検査では,75および300 mg/kg群の雌で総コレステロールおよびリン脂質の増加が認められ,300 mg/kg群の雄で総ビリルビンおよびCaの増加が認められた.これらのうち,総ビリルビンについては,高値を示した1例を除く他の5例の値は生理的な変動範囲内の変化であった.Caについては生理的な変動範囲内の変化であり,かつ有意差はみられていないものの同群の雄では総蛋白質がやや高値を示していることから,蛋白質の増加に伴った変化と考えられた.なお,個体別にみると300 mg/kg群の雄1例で総蛋白質,総ビリルビン,γ-GTP,総コレステロール,リン脂質,BUNおよびクレアチニンの増加,ならびにA/G比の減少が認められ,雌1例でγ-GTP,BUNおよびクレアチニンの増加,ならびにA/G比の減少が認められた.
回復期間終了時の検査では,300 mg/kg群の雌で総コレステロールおよびリン脂質の増加が認められた.その他,300 mg/kg群の雄でA/G比の増加が認められ,雌でGPTの減少,ならびにトリグリセライドおよびグルコースの増加が認められたが,いずれも軽度な変化であり,同様の変化は投与期間終了時の検査時には認められていないことから,2,4-ジ-tert-ブチルフェノールとの関連性はないと考えられた.
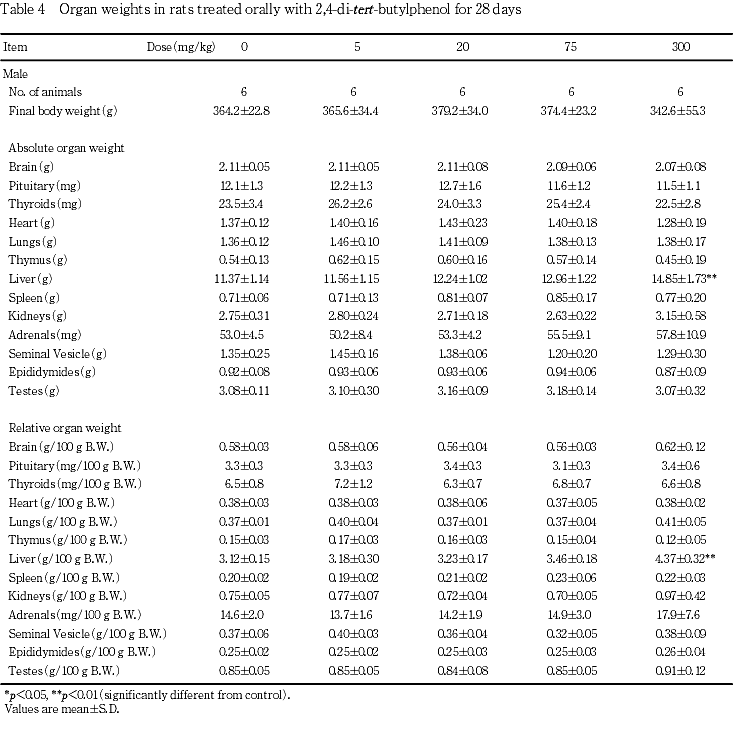
7. 器官重量(Table 4)
投与期間終了時の検査では,75 mg/kg群の雌および300 mg/kg群の雌雄で肝臓の絶対および相対重量の増加が認められた.なお,個体別にみると300 mg/kg群の雄1例で肝臓重量の増加に加え,腎臓および副腎の絶対および相対重量の増加,胸腺の絶対および相対重量の減少,ならびに脾臓の絶対重量の減少が認められ,300 mg/kg群の雌1例で肝臓重量の増加に加え,腎臓の絶対および相対重量の増加,ならびに胸腺の絶対および相対重量の減少が認められた.
回復期間終了時の検査では,300 mg/kg群の雌で肝臓の絶対および相対重量の増加,雄で肝臓の相対重量の増加が認められたが,変化の程度は投与期間終了時のものと比較して軽減していた.さらに,300 mg/kg群の雌で腎臓の絶対重量の増加が認められた.その他,300 mg/kg群の雄で精巣上体の絶対重量の減少,および雌で脾臓の絶対重量の増加が認められたが,同様の変化は投与期間終了時の検査には認められておらず,かつ後述する投与期間終了時の当該器官における病理組織学検査では被験物質投与に関連する変化は認められていないことから,2,4-ジ-tert-ブチルフェノール投与との関連性はないと考えられた.
8. 剖検所見(Table 5)
投与期間終了時の検査では,300 mg/kgの雄1例で腎臓の肥大が認められ,雌1例で腎臓の灰白色点が認められた.さらに,腎臓の肥大がみられた雄1例には胸腺の小型化,副腎の肥大および肺の暗赤色化が認められ,腎臓の灰白色点がみられた雌1例には肺の灰白色化が認められた.その他,偶発的な変化として,一般状態で外傷(掻創)がみられた対照群および20 mg/kg群の雄各1例に頸部皮膚の痂皮形成が認められ,5 mg/kg群の雌1例に甲状腺の片側性欠損が認められた.
回復期間終了時の検査では,2,4-ジ-tert-ブチルフェノール投与に関連すると考えられる変化は認められなかった.偶発的な変化として,300 mg/kg群の雌1例で下腹部皮下の腫瘤が認められた.
9. 病理組織学検査(Table 6)
投与期間終了時の検査において,肝臓では,300 mg/kg群の雌雄各4例で小葉中心性の肝細胞肥大が認められ,同群の別の雄1例で門脈周囲性の肝細胞肥大が認められた.腎臓では,300 mg/kg群の雄全例および雌5例で好塩基性尿細管が認められ,これらのうち雄全例および雌3例で顆粒円柱,雄全例および雌1例で蛋白円柱が認められた.さらに,300 mg/kg群の雌雄各1例のうち,好塩基性尿細管の程度が強かった雄1例で近位尿細管の肥大,遠位尿細管の拡張および好中球性細胞浸潤がみられ,雌1例で遠位尿細管の拡張および好中球性細胞浸潤が認められた.75 mg/kg群の雌雄では,肝臓および腎臓において被験物質投与に関連した変化は認められなかった.その他,対照群および2,4-ジ-tert-ブチルフェノール各群で肝臓の門脈周囲性の脂肪変性,肺の肺胞内泡沫細胞または動脈壁への鉱質沈着,腎臓皮質の嚢胞または皮髄境界部の鉱質沈着,精巣上体の精子肉芽腫,頸部皮膚の潰瘍が散見されたが,それらの出現頻度および程度に対照群との差はなく,いずれも被験物質投与と関連のない自然発生あるいは偶発的な変化と考えられた.また,300mg/kg群の雌雄各1例で肉眼的に肺の変化がみられた部位で異物肉芽腫がみられ,加えて胸腺の萎縮が認められたが,いずれも誤投与による変化ならびに誤投与にともなう全身状態の悪化に起因した変化と判断した.
回復期間終了時の検査において,投与期間終了時と同様な変化として,腎臓では300 mg/kg群の雄全例および雌1例で好塩基性尿細管がみられ,さらに,雄4例で顆粒円柱および雄2例で蛋白円柱が認められたが,変化の程度は投与期間終了時のものと比較して軽減していた.また,投与期間終了時に変化がみられた肝臓には変化は認められなかった.その他,300 mg/kg群の雄1例で肝臓の門脈周囲性の脂肪変性がみられ,皮下腫瘤がみられた300 mg/kg群の雌1例で乳腺の腺癌が認められたが,出現例数は少なく,腺癌については,同週齢程度の雌で自然発生するとの報告1)もあることから,いずれも被験物質投与と関連のない自然発生の変化と判断した.
考察
試験期間を通して死亡は認められなかった.一般状態観察では,300 mg/kg群の雌雄で投与直後に一過性の流涎が認められた.2,4-ジ-tert-ブチルフェノールは,皮膚および粘膜に対して刺激性を有することが知られており,本試験で観察された流涎は,被験物質の粘膜刺激性に関連した変化であると考えられた.
体重および摂餌量では,被験物質投与に関連すると考えられる変化は認められなかった.
尿検査では,300 mg/kg群の雌雄で尿量の増加が認められた.また,尿量の増加に伴った変化として,300 mg/kg群の雌雄で尿浸透圧および比重の低下,ならびに尿色調の淡黄色化が認められた.これらの変化は,後述の病理学検査で述べるような被験物質の腎臓に対する影響に関連した変化のように考えられた.
血液学検査では,300 mg/kg群の雌でヘモグロビン量およびヘマトクリット値の減少,ならびに分葉核好中球比の増加が認められ,雄でプロトロンビン時間およびAPTTの延長が認められた.ヘモグロビン量およびヘマトクリット値の減少について,その発生機序は不明であるが,赤血球数および網状赤血球率に変化はなく,骨髄の病理組織学検査においても造血抑制を示唆する変化は認められていないことから,重篤な変化ではないと考えられた.分葉核好中球比の増加については,上述した尿量の増加と同様に,被験物質の腎臓に対する影響に関連した変化のように考えられた.また,凝固時間の延長については,本被験物質に類似した構造を持つ2,6-ジ-tert-ブチル-4-メチルフェノールあるいはその代謝物は,抗ビタミンK作用を有することが示唆2)されており,プロトロンビン形成にはビタミンKが必須であることから,類似化合物と同様な作用機序により凝固時間の延長が発現した可能性が考えられた.
血液生化学検査では,75および300 mg/kg群の雌で総コレステロールおよびリン脂質の増加が認められ,本被験物質の脂質代謝への影響が示唆された.
病理学検査では,75 mg/kg群の雌および300 mg/kg群の雌雄で肝臓重量の増加が認められ,組織学的には300 mg/kg群の雌雄で小葉中心性の肝細胞の肥大が認められた.本被験物質およびその類似化合物の投与において,肝臓重量および肝薬物代謝酵素活性を増加させることが報告3)されており,小葉中心性の肝細胞の肥大は薬物代謝酵素の誘導に起因した変化4)と考えられた.また,300 mg/kg群の雄1例で肉眼的に腎臓の肥大が認められ,雌1例で腎臓の灰白色点が認められた.腎臓の病理組織学検査では,300 mg/kg群の雌雄で好塩基性尿細管,顆粒円柱および蛋白円柱が認められ,さらに腎臓の肉眼的変化がみられた例には好中球性細胞浸潤,近位尿細管の肥大あるいは遠位尿細管の拡張が認められ,本被験物質の腎臓に対する影響が認められた.このような腎障害は,本被験物質のラットにおける単回投与毒性試験においても認められており,腎臓は本被験物質の主要な標的器官であると考えられた.
上述した変化に加えて,腎障害の程度が強かった300 mg/kg群の雌雄各1例において,体重および摂餌量の減少,γ-GTP, BUNおよびクレアチニンの増加,A/G比の減少,腎臓重量の増加,さらに同雄1例では赤血球系パラメーターの減少,分葉核好中球比の増加,総蛋白質,総ビリルビン,総コレステロール,リン脂質の増加,門脈周囲性の肝細胞の肥大などが認められ,被験物質投与による影響が強くみられたが,いずれの例でも誤投与による生体への負荷が加わっていることから,その影響が毒性を増強させたものと考えられた.
回復試験では,血液生化学検査において,300 mg/kg群の雌で総コレステロールおよびリン脂質の増加が認められたものの,尿検査,血液学検査,剖検,器官重量および病理組織学検査でみられた変化は消失あるいはその程度が軽減しており,被験物質投与で生じた変化は可逆的であると考えられた.
以上のように,本試験では75 mg/kg以上の群の雌で血清中総コレステロールおよびリン脂質の増加,ならびに肝臓重量の増加が認められ,300 mg/kg群の雌雄で流涎,肝臓および腎臓に対する影響が認められたことから,無影響量は雄で75 mg/kg/day,雌で20 mg/kg/dayと考えられた.
文献
| 1) | Y. Oishi, et al, J. Toxicol. Pathol., 5, 696(1995). |
| 2) | O. Takahashi, et al, Toxicology Letters., 5, 147(1980). |
| 3) | S. Kawano, et al, Japan. J. Pharmacol., 31, 459(1981). |
| 4) | J. R. Glaister, “Principles of Toxicological Pathology,” eds. by Taylar & Francis, London and Philadelphia, 1986, pp.83-85. |
| 連絡先 |
| 試験責任者: | 古川浩美 |
| 試験担当者: | 榎嶋輝彦,浜村政夫,和泉宏幸,神谷光一,鍬先恵美子 |
| (株)パナファ−ム・ラボラトリ−ズ安全性研究所 |
| 〒869-0425 熊本県宇土市栗崎町1285 |
| Tel 0964-23-5111 | Fax 0964-23-2282 | |
| Correspondence |
| Authors: | Hiromi Furukawa(Study director)
Teruhiko Enoshima, Masao Hamamura, Hiroyuki Izumi, Kohithi Kamiya, Emiko Kuwasaki |
| Safety Assessment Laboratory, Panapharm Laboratories Co., Ltd. |
| 1285 Kurisaki-machi, Uto-shi, Kumamoto, 869-0425, Japan |
| Tel +81-964-23-5111 | Fax +81-964-23-2282 | |

 nwald-Giemsa染色を施して白血球百分比を算出するとともに,New methylene blue超生体染色を施して,網状赤血球率を算出した.さらに,3.8 %クエン酸ナトリウム加血液を3000回転/分で15分間遠心分離し,得られた血漿を用いて,全自動血液凝固測定装置(Sysmex CA-5000, シスメックス(株))により,プロトロンビン時間(散乱光検出方式)および活性化部分トロンボプラスチン時間(APTT, 散乱光検出方式)を測定した.
nwald-Giemsa染色を施して白血球百分比を算出するとともに,New methylene blue超生体染色を施して,網状赤血球率を算出した.さらに,3.8 %クエン酸ナトリウム加血液を3000回転/分で15分間遠心分離し,得られた血漿を用いて,全自動血液凝固測定装置(Sysmex CA-5000, シスメックス(株))により,プロトロンビン時間(散乱光検出方式)および活性化部分トロンボプラスチン時間(APTT, 散乱光検出方式)を測定した.
 blewski-La due法),クレアチンリン酸化酵素(JSCC法),総コレステロール(T.cholesterol, COD-HDAOS法),トリグリセライド(GPO-HDAOS法, glycerol blanking法),リン脂質(Choline oxidase-DAOS法),グルコース(Hexokinase-G-6-PDH法),尿素窒素(BUN, Urease-GLDH法),クレアチニン(Jaff
blewski-La due法),クレアチンリン酸化酵素(JSCC法),総コレステロール(T.cholesterol, COD-HDAOS法),トリグリセライド(GPO-HDAOS法, glycerol blanking法),リン脂質(Choline oxidase-DAOS法),グルコース(Hexokinase-G-6-PDH法),尿素窒素(BUN, Urease-GLDH法),クレアチニン(Jaff 法),無機リン(IP, PNP-XOD法)およびカルシウム(Ca, MXB法)を測定した.また,電解質分析装置(PVA-γIII, (株)アナリティカル・インスツルメンツ)によりナトリウム(Na, 電極法),カリウム(K, 電極法)およびクロール(Cl, 電量滴定法)を測定した.
法),無機リン(IP, PNP-XOD法)およびカルシウム(Ca, MXB法)を測定した.また,電解質分析装置(PVA-γIII, (株)アナリティカル・インスツルメンツ)によりナトリウム(Na, 電極法),カリウム(K, 電極法)およびクロール(Cl, 電量滴定法)を測定した.









