
| 1. | 死亡例は、雌雄ともに認められず、LD50値は2000 mg/kg以上と推察された。 |
| 2. | 一般状態観察では、被験物質投与群の雌雄で投与後20分後より自発運動の減少、よろめき歩行が認められた。これらの症状は高用量群ほど長く持続する傾向があり、重症の例では腹臥あるいは横臥の状態を呈した。2000 mg/kg群では、他に外尿道口周囲や肛門周囲の被毛汚染、軟便が認められた。 |
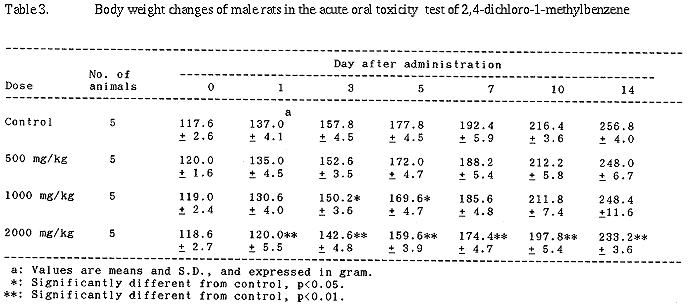
| 3. | 体重推移では、1000 mg/kg以上の群において、雄で投与後に体重の増加抑制が、雌で投与後1日に体重に有意な低値が認められた。 |
| 4. | 剖検及び病理組織学的検査では、雌雄ともに被験物質投与による影響は認められなかった。 |
飼育室内の清掃は1日2回、床の清拭消毒は1日1回の頻度で行った。
飼料は固型飼料(CRF-1、オリエンタル酵母工業株式会社)を金属製給餌器を用いて、飲料水は水道水(札幌市水道水)を自動給水装置を用いて、それぞれ自由に摂取させた。
飼料の分析及び飲料水の水質検査の結果、試験施設で定めた基準値の範囲内であることを確認した。
動物数は、1群当たり雌雄各5匹とした。群分けは、馴化飼育の最終日(投与前日)に各群の体重が均一になるように体重別層化無作為抽出法により行った。
動物の識別は、群分け時に油性フェルトペンを用いて尾部に行った。ケージには性別毎に色分けしたカードに試験番号、試験群及び動物番号を明記して標示した。
投与は雌雄ともに5週齢に行い、その平均体重(体重範囲)は雄で118.8 g(114〜123 g)、雌で100.1 g(97〜104 g)であった。投与時刻は午前9時から午後2時の間とした。

肝臓、腎臓、脾臓、心臓、肺、脳、胃、十二指腸、空腸、回腸、盲腸、結腸、直腸及び異常所見部位
体重値について、Bartlettの検定法によって分散を検定した。その結果、等分散(p>0.05)を示した項目については一元配置分散分析法によって解析し、有意な場合(p<0.10)、Dunnettの検定法により対照群と被験物質投与群との比較を行った。一方、不等分散(p<0.05)を示した項目については Kruskal-Wallis 法により解析し、有意な場合(p<0.10)、Mann-WhitneyのU-検定法により対照群と被験物質投与群との比較を行った。なお、対照群との検定については、危険率5%以下を統計学的に有意とした。

雌では、500及び1000 mg/kg群で、出現時間に若干相違はあるものの、雄と同様な症状が認められた。2000 mg/kg群では、投与約25分後より、自発運動の減少及びよろめき歩行が全例、流涎が1例に、約1時間後より腹臥あるいは横臥が全例に認められ、約9時間後においても腹臥(4例)及び横臥(1例)が認められた。投与後1日には、自発運動の減少及びよろめき歩行が全例、外尿道口周囲の被毛汚染が4例、肛門周囲の被毛汚染が1例に認められた。投与後2日以降に症状は認められなかった。
雌では、1000及び2000 mg/kg群で投与後1日の体重に有意な低値が認められたが、その後は対照群とほぼ同じ推移を示した。なお、1000 mg/kg群で投与後5及び10日の体重に有意な差がみられたが、用量依存的な変動ではなかった。
雌では、いずれの群においても異常は認められなかった。
雌では、いずれの群においても異常は認められなかった。
死亡例は、雌雄ともにいずれの群においても認められず、LD50値は2000 mg/kg以上と推察された。

症状では、雌雄ともに投与後約20分より、自発運動の減少、よろめき歩行が認められた。これらの症状は500 mg/kg以上の群で認められ、高用量群ほど長く持続する傾向があり、重症の例では腹臥あるいは横臥の状態を呈した。被験物質の基本骨格であるトルエンは、中枢に対して抑制的に働くこと1)から、本被験物質も同様に中枢に対して作用するものと考えられた。しかし、以上の症状はいずれの群についても投与後2日までに消失した。その他、2000 mg/kg群でみられた外尿道口周囲や肛門周囲の被毛汚染、軟便は、腹臥あるいは横臥状態が持続したこと、あるいは大量投与による影響と考えられた。なお、肛門周囲被毛汚染及び軟便のみられた例については、投与後14日の病理学的検査では消化管に異常は認められなかった。また、500及び2000 mg/kg群では、流涎が少数例に認められた。これは、口腔に被験物質が付着したために出現したものと考えられた。
体重推移では、1000 mg/kg以上の群において、雄で投与後に体重の増加抑制が、雌で投与後1日に体重に有意な低値がみられた。
病理組織学的検査では、500あるいは2000 mg/kg群の雄各1例で腎臓に尿細管上皮の再生、脾臓にリンパろ胞の増生が認められた。これらの所見は、いずれも限局性に認められ、また、前者については背景データにおいても5.6%の頻度で認められる変化であり、後者については対応する剖検所見(白色腫瘤)が2, 4−ジクロロ−1−メチルベンゼンの500 mg/kgを14日間反復投与した場合に認められないことから、被験物質投与との関連はないものと考えられた。
| 1) | 北川晴雄, "毒性学," 第1刷 株式会社 南江堂, 東京, 1982, P195. |
| 連絡先: | |||
| 試験責任者 | 釜田悟 | ||
| (株)化合物安全性研究所 | |||
| 〒 004 北海道札幌市豊平区真栄 363 番 24 | |||
| Tel 011-885-5031 | Fax 011-885-5313 | ||
| Correspondence: | |||
| Kamada, Satoru | |||
| Safety Research Institute for Chemical Compounds Co., Ltd., Japan | |||
| 363-24 Shin-ei, Toyohira-ku, Sapporo, Hokkaido, 004, Japan | |||
| Tel 81-11-885-5031 | Fax 81-11-885-5313 | ||