o-ジクロロベンゼンの細菌を用いる復帰変異試験
Reverse Mutation Test of o-Dichlorobenzene on Bacteria
要約
o-ジクロロベンゼンについて,細菌を用いる復帰変異試験を実施した.
検定菌として,Salmonella typhimurium(TA100, TA98, TA1535, TA1537)およびEscherichia coli(WP2 uvrA)の5菌株を用いた.試験は2回繰り返して実施し,S9 mix無添加群のTA100で2.44〜78.1 μg/plate,同群のその他の菌株およびS9 mix添加群の各試験菌株でそれぞれ9.77〜313 μg/plateの6用量で試験を実施した.
その結果,S9 mix無添加群および添加群のいずれにおいても,溶媒対照に比べ復帰突然変異コロニー数の明確な増加は認められなかった.
以上の結果より,本試験条件下ではo-ジクロロベンゼンは,変異原性を有しない(陰性)と結論した.
方法
1. 試験菌株
細菌を用いる復帰変異試験に広く使用されていることから,試験菌株としてヒスチジン要求性のSalmonella typhimurium TA100, TA98, TA1535およびTA1537 1)ならびにトリプトファン要求性のEscherichia coli WP2 uvrA 2)の5種類の菌株を選択した.
ネズミチフス菌は昭和58年9月9日にカリフォルニア大学のB. N. Ames教授から,また,大腸菌については昭和58年3月16日に国立衛生試験所(現:国立医薬品食品衛生研究所)から分与を受けた.平成11年1月5日ならびに平成11年3月31日に菌株の特性検査を実施し,本試験に用いた菌株が規定の特性を保持していることを確認した.
各菌株の菌懸濁液はジメチルスルホキシド(DMSO:MERCK KGaA)を添加した後,凍結保存用チューブに0.2 mLずつ分注した.これを液体窒素を用いて凍結し,超低温フリーザーに-80 ℃で保存した.
2. 培地の調製
1) 最少グルコース寒天平板培地(プレート)
オリエンタル酵母工業(株)製のテスメディアAN培地を購入し,試験に用いた.本プレートは,Vogel-Bonnerの最少培地Eを含む水溶液(0.02 %硫酸マグネシウム・7水塩,0.2 %クエン酸・1水塩,1 %リン酸二カリウム・無水塩,0.192 %リン酸一アンモニウム,0.066 %水酸化ナトリウム[いずれも最終濃度])に2 %のグルコース(和光純薬工業(株))と1.5 %の寒天(OXOID:No. 1)を加え,径90 mmのシャーレに1枚当たり30 mLを分注したものである.
2) トップアガー(軟寒天)
塩化ナトリウム0.5 %を含む0.6 % Bacto-agar(Difco)水溶液10容量に対し,ネズミチフス菌を用いる試験の場合,0.5 mmol/L L-ヒスチジン(関東化学(株))-0.5 mmol/L D-ビオチン(関東化学(株))水溶液を1容量加え,大腸菌を用いる試験の場合,0.5 mmol/L L-トリプトファン(関東化学(株))水溶液を同じく1容量加え用いた.
3. 前培養条件
内容量200 mLのバッフル付三角フラスコに2.5 %ニュートリエントブロス(Oxoid Nutrient Broth No. 2:OXOID)溶液を25 mL分注し,これに融解した菌懸濁液を50 μL接種した.ウォーターバスシェーカー(MM-10:タイテック(株))を用い,37 ℃で8時間振盪(往復振盪:100回/分)培養し,菌濃度を確認した後試験に使用した.
4. S9 mix
製造後6ヵ月以内のキッコーマン(株)製S9 mixを試験に使用した.S9 mix中のS9は誘導剤としてフェノバルビタールおよび5,6-ベンゾフラボンを投与したSprague-Dawley系雄ラットの肝臓から調製されたものである.S9 mixの組成を以下に示す.
-
| 成 分 | S9 mix 1 mL中の量 |
| S9 | 0.1 mL |
| MgCl2 | 8 μmol |
| KCl | 33 μmol |
| G-6-P | 5 μmol |
| NADPH | 4 μmol |
| NADH | 4 μmol |
| Na-リン酸緩衝液(pH 7.4) | 100 μmol |
| 精製水 | 残 量 |
5. 被験物質
o-ジクロロベンゼン(ロット番号:8803302)は純度99.7 %の無色透明液体である.本剤は20 ℃の水100 mLに0.013 g溶解し,ほとんどの有機溶剤に可溶であり,DMSO溶液中で安定である.三井化学(株)(東京)から提供された被験物質を使用した.被験物質は,使用時まで室温で保管した.試験終了後,被験物質提供元において残余被験物質を分析した結果,安定性に問題はなかった.
6. 被験物質液の調製
試験の都度,モレキュラーシーブを用いて脱水処理を行ったDMSO(MERCK KGaA)で被験物質を溶解して調製原液とした.調製原液を使用溶媒を用いて順次所定濃度に希釈した後,速やかに処理を行った.なお,本被験物質情報から揮発性が疑われたため,調製には蓋付きの試験管を用いた.
7. 試験用量の設定
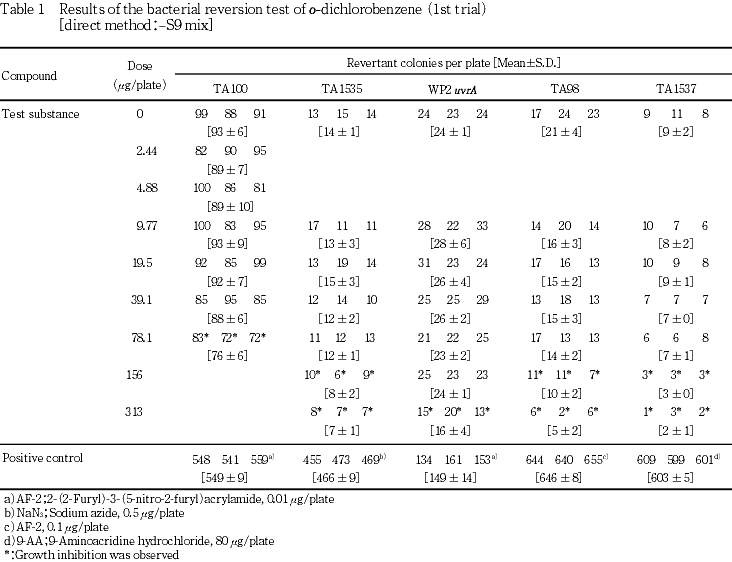
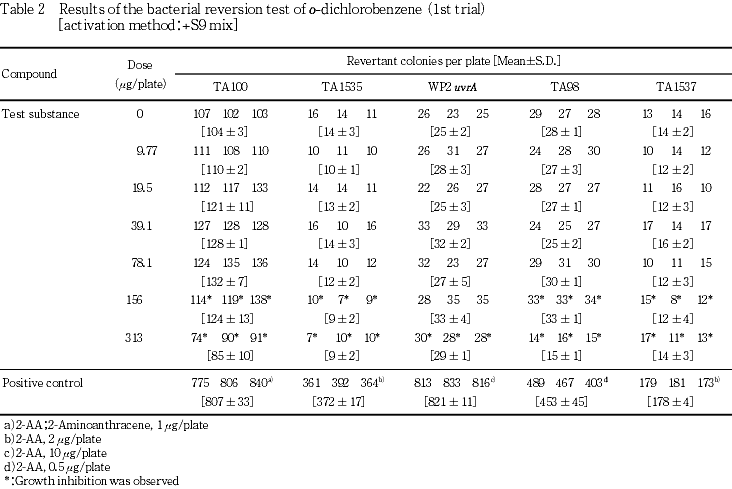
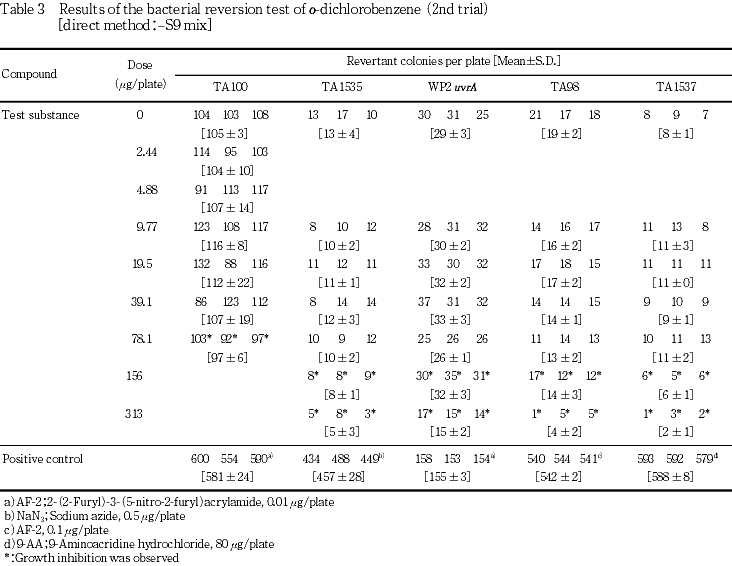
19.5,78.1,313および1250 μg/plateの用量を用いて予備的な試験を実施した.S9 mix無添加群のTA100で78.1 μg/plate以上,同群のその他の菌株ならびにS9 mix添加群の全菌株で313 μg/plate以上において試験菌株に対する生育阻害作用が観察された.
従って,本試験においてはS9 mix無添加群のTA100で78.1 μg/plate,同群のその他の菌株ならびにS9 mix添加群の各試験菌株で313 μg/plateを最高用量とし,それぞれ6用量(公比2)を設定した.
8. 陽性対照物質
陽性対照物質として下記に示した物質を使用した.これらの陽性対照物質は,DMSOを用いて溶解し,少量ずつ分注した後凍結保存(-20 ℃)した.
- 2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド(AF-2:和光純薬工業(株))
- アジ化ナトリウム(NaN3:和光純薬工業(株))
- 9-アミノアクリジン塩酸塩(9-AA:Aldrich社)
- 2-アミノアントラセン(2-AA:和光純薬工業(株))
9. 試験方法
Amesらの原法1)の改良法であるプレインキュベーション法に準じて,S9 mix無添加群および添加群それぞれについて試験を実施した.蓋付き試験管に,使用溶媒,被験物質液あるいは陽性対照物質溶液を100 μL,次いでS9 mix無添加群の場合,0.1 mol/Lナトリウム・リン酸緩衝液(pH 7.4)を500 μL,S9 mix添加群の場合,S9 mixを500 μL添加した.さらに,試験菌液100 μLを加え,37 ℃で20分間振盪培養(プレインキュベーション)した.培養終了後,あらかじめ45 ℃に保温したトップアガーを2 mL添加し,混合液をプレート上に重層した.各プレートをビニールテープで密封して,37 ℃の条件で48時間各プレートを培養した後,被験物質の試験菌株に対する生育阻害作用を確認するため,実体顕微鏡(×60)を用いてプレート上の試験菌株の生育状態を観察した.次いで,復帰突然変異により生じたコロニーを計数した.計測に際してはコロニーアナライザー(CA-11:システムサイエンス(株))を用いた.各濃度につき3枚のプレートを使用した.また,独立して試験を2回実施した.
10. 結果の解析
復帰突然変異コロニー数が溶媒対照のほぼ2倍以上に増加し,かつ,再現性あるいは被験物質の用量に依存性が認められた場合に,陽性と判定した.
なお,統計学的手法を用いた検定は実施しなかった.
結果および考察
1回目の試験結果をTable 1〜2に,2回目の試験結果をTable 3〜4に示した.S9 mix無添加群ならびに添加群のいずれにおいても,高用量群においてo-ジクロロベンゼン処理による生育阻害作用が観察された.しかしながら,復帰突然変異コロニー数については,S9 mix無添加群,S9 mix添加群とも溶媒対照と同等の値であり,明確な増加傾向は認められなかった.一方,陽性対照物質はそれぞれの試験菌株において,溶媒対照群の2倍以上の復帰突然変異コロニーを誘発した.なお,コロニー計数時,析出等の特筆すべき変化は観察されなかった.以上の試験結果から,本試験条件下において,o-ジクロロベンゼンの微生物に対する遺伝子突然変異に関し,陰性と判定した.
なお,本被験物質についてはすでにAmes試験で陰性3)との報告がある.一方,ヒト鼻粘膜細胞に染色体異常を誘発する4)との報告がある.類縁体であるp-ジクロロベンゼンについてはAmes試験で陰性5),染色体異常試験で陰性6),ヒトリンパ球に対して姉妹染色体交換を誘発する7)との報告があるが,m-ジクロロベンゼンの変異原性に関する報告はなかった.

文献
| 1) | D. M. Maron and B. N. Ames, Mutation Research, 113, 173(1983). |
| 2) | M. H. L. Green and W. J. Muriel, Mutat. Res., 38, 3(1976). |
| 3) | 石館基監修,“微生物を用いる変異原性試験データ集,”エル・アイ・シー,東京,1991, pp.164-165. |
| 4) | C. Zapata-Gayon, N. Zapata-Gayon and A. Gonzalez-Angulo, Arch. Environ. Health, 37(4), 231(1982). |
| 5) | E. Loeser and M. H. Litchfield, Food Chem. Toxicol., 21(6), 825(1983). |
| 6) | 石館基監修,“<改訂>染色体異常試験データ集,”エル・アイ・シー,東京,1987, p.123. |
| 7) | E. Carbonell, M. Puig, N. Xamena, A. Creus and R. Marcos, Mutat. Res., 263(1), 57(1991). |
| 連絡先 |
| 試験責任者: | 益森勝志 |
| 試験担当者: | 板倉真由実,菊池正憲 |
| (財)食品農医薬品安全性評価センター |
| 〒437-1213 静岡県磐田郡福田町塩新田字荒浜582-2 |
| Tel 0538-58-1266 | Fax 0538-58-1393 | |
| Correspondence |
| Authors: | Shoji Masumori(Study Director)
Mayumi Itakura, Masanori Kikuchi |
| Biosafety Research Center, Foods, Drugs and Pesticides(An-Pyo Center) |
| 582-2 Arahama, Shioshinden, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan |
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |




