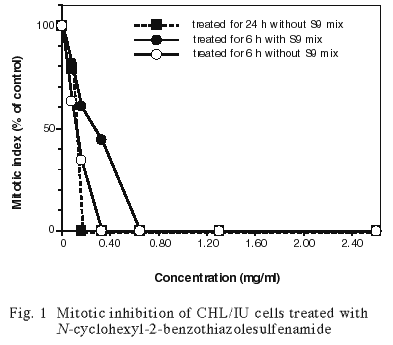
連続処理(24時間)および短時間処理(6時間)において,0.5% 以上の分裂指数を示した最も高い濃度(MI max)は,連続処理(24時間)では 0.081 mg/ml,短時間処理(6時間)の S9 mix 非存在下および S9 mix 存在下ではそれぞれ 0.16 mg/ml および 0.33 mg/ml であった.各系列での処理濃度は,MI max の2倍濃度を最高処理濃度とし,公比2で5濃度設定した.なお,48時間連続処理の濃度は,24時間連続処理と同じ濃度に設定した.連続処理では,S9 mix 非存在下で24時間および48時間連続処理後,短時間処理では S9 mix 存在下および非存在下で6時間処理(18時間の回復時間)後,標本を作製し,検鏡することにより染色体異常誘発性を検討した.染色体分析が可能な最高濃度は,24時間および48時間連続処理では 0.040 mg/ml の濃度であったことから,これらの濃度を高濃度群として3濃度群を観察対象とした.短時間処理の S9 mix 非存在下および S9 mix 存在下ではそれぞれ 0.041 mg/ml および 0.081 mg/ml が染色体分析の可能な最高濃度であったことから,この濃度を含む2濃度群を観察対象とした.
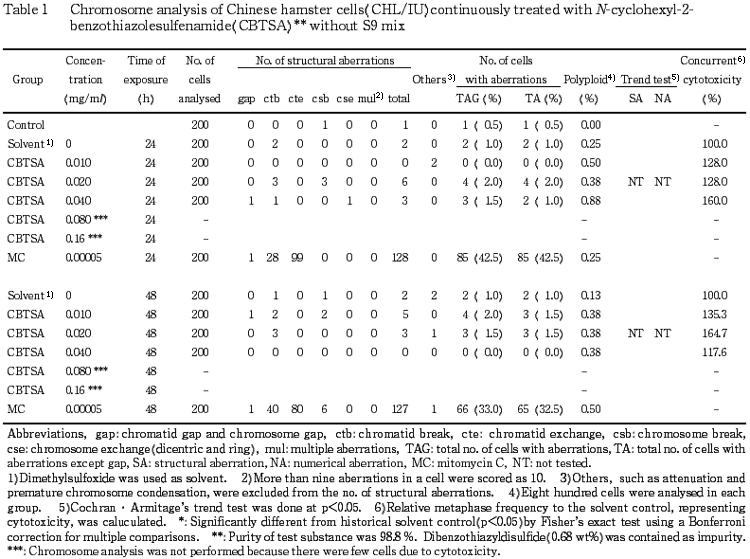
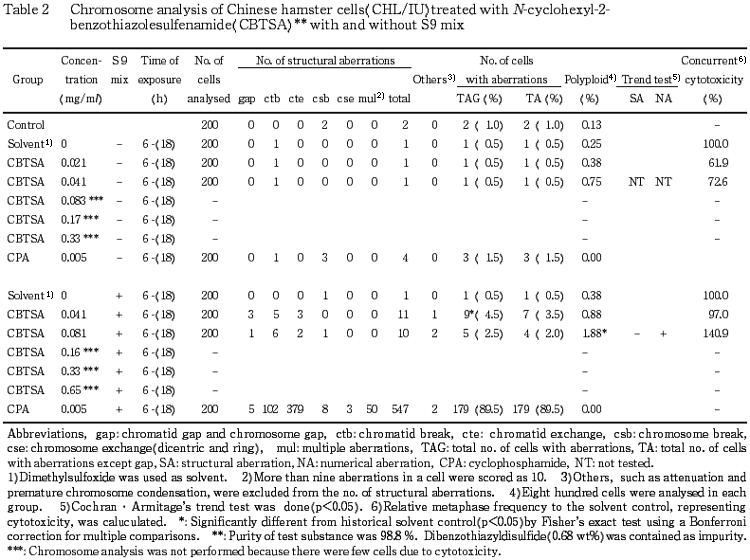
CHL/IU 細胞を24時間および48時間連続処理したいずれの処理群においても染色体の構造異常および倍数性細胞の誘発は認められなかった.短時間処理では,S9 mix 非存在下において,いずれの処理群でも染色体の構造異常および倍数性細胞の誘発は認められなかった.一方,S9 mix 存在下では,0.041 mg/ml において,染色体の構造異常(gap を含む)が有意に増加(4.5%)したが,傾向性検定の結果,濃度依存性は認められなかった.また,0.081 mg/ml では,倍数性細胞が有意に誘発(1.88%)され,傾向性検定の結果,濃度依存性が認められたが,誘発頻度が低いため,疑陽性と判断した.このことから,S9 mix 存在下の短時間処理についてのみ,確認試験を行った.その結果,0.081 mg/ml において,染色体の構造異常(gap を含む)が有意に誘発(3.5%)されたが,傾向性検定の結果,濃度依存性は認められなかった.また,0.041 mg/ml において,倍数性細胞が有意に誘発(1.13%)されたが,傾向性検定の結果,濃度依存性は認められなかった.従って,S9 mix 存在下の確認試験においては,染色体の構造異常,倍数性細胞誘発性ともに陰性と判定した.
以上の結果より,最終的に N-シクロヘキシル-2-ベンゾチアゾールスルフェンアミドは,上記の試験条件下で染色体異常を誘発しないと結論した.
被験物質原体は,常温で6ヶ月くらいは安定である.
その結果,連続処理における MI max は,0.081 mg/ml,短時間処理の S9 mix 非存在下および S9 mix 存在下では,それぞれ 0.16 mg/ml および 0.33 mg/ml であった(Fig.1).

染色体異常試験においては1濃度あたり2枚ディッシュを用い,染色体標本を作製と同時に分裂指数の測定(追加試験ではモノセレーターによる細胞増殖率の測定)をした.
作製したスライド標本のうち,1つのディッシュから得られた異なるスライドを,4名の観察者がそれぞれ処理条件が分からないようにコード化した状態で分析した.染色体の分析は,日本環境変異原学会,哺乳動物試験(MMS)研究会1)による分類法に基づいて行い,染色体型あるいは染色分体型のギャップ,切断,交換などの構造異常の有無と倍数性細胞(polyploid)の有無について観察した.また構造異常については1群200個,倍数性細胞については1群800個の分裂中期細胞を分析した.
染色体異常を有する細胞の出現頻度について,溶媒の背景データと被験物質処理群間でフィッシャーの直接確率法2)(多重性を考慮して familywise の有意水準を 5% とした)により,有意差検定を実施した.また,フィッシャーの直接確率法で有意差が認められた場合には,用量依存性に関してコクラン・アーミテッジの傾向性検定3) (p<0.05)を行った.最終的な判定は,統計学的および生物学的な評価に基づいて行った.
短時間処理による染色体分析の結果を Table 2 に示した.N-シクロヘキシル-2-ベンゾチアゾールスルフェンアミドを加えてS9 mix 非存在下における短時間処理では,0.083 mg/ml 以上の処理群では細胞毒性のため分析できなかったが,観察可能であったいずれの処理群においても,染色体の構造異常や倍数性細胞の誘発作用は認められなかった.また,S9 mix 存在下では,0.16 mg/ml 以上の処理群では細胞毒性のため分析できなかったが,0.041 mg/ml では,染色体の構造異常(gap を含む)が有意に誘発され,その頻度は 4.5% であったが,傾向性検定の結果,濃度依存性は認められなかったため,陰性と判定した.0.081 mg/ml では,倍数性細胞が有意に誘発され,その発生頻度は 1.88% であり,傾向性検定の結果,濃度依存性が認められた.しかしながら,倍数性細胞の誘発頻度は低いため,疑陽性と判断し,S9 mix 存在下の短時間処理群において確認試験を行うこととした.
短時間処理による染色体分析の結果を Table 3 に示した.確認試験において,S9 mix 存在下で短時間処理した 0.081 mg/ml では,染色体の構造異常(gap を含む)が有意に誘発(3.5%)されたが,傾向性検定の結果,濃度依存性は認められなかった.また,0.081 mg/ml では毒性のため,倍数性細胞は規定数の分析ができなかった.0.041 mg/ml において,倍数性細胞が有意に誘発(1.13%)されたが,傾向性検定の結果,濃度依存性は認められなかった.よって,確認試験において S9 mix 存在下では染色体の構造異常,倍数性細胞誘発性ともに陰性と判定した.
従って,N-シクロヘキシル-2-ベンゾチアゾールスルフェンアミドは,上記の試験条件下で,試験管内の CHL/IU 細胞に染色体異常を誘発しないと結論した.

| 1) | 日本環境変異原学会・哺乳動物試験分科会編,"化学物質による染色体異常アトラス," 朝倉書店,東京,1988. |
| 2) | 吉村 功編,"毒性・薬効データの統計解析,事例研究によるアプローチ," サイエンティスト社,東京,1987. |
| 3) | 吉村 功,大橋靖夫編,"毒性試験講座14,毒性試験データの統計解析," 地人書館,東京,1992,pp.218-223. |
| 連絡先 | |||
| 試験責任者: | 田中憲穂 | ||
| 試験担当者: | 山影康次,若栗 忍,日下部博一, 古畑紀久子,橋本恵子 | ||
| (財)食品薬品安全センター 秦野研究所 | |||
| 〒257 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Noriho Tanaka(Study director) Kohji Yamakage, Shinobu Wakuri, Hirokazu Kusakabe, Kikuko Furuhata, Keiko Hashimoto | ||
| Hatano Research Institute,Food and Drug Safety Center | |||
| 729-5 Ochiai,Hadano,Kanagawa,257,Japan | |||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | ||