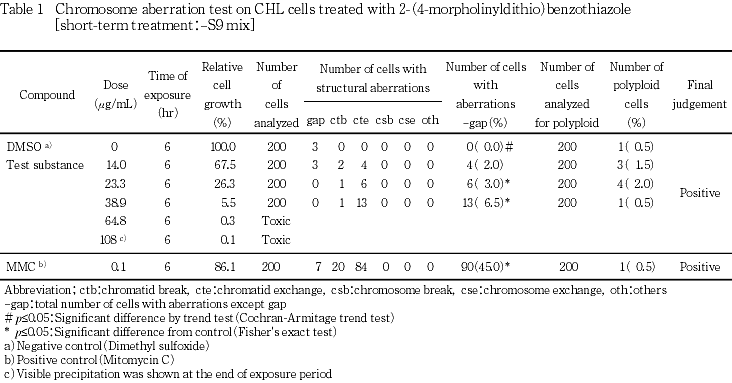
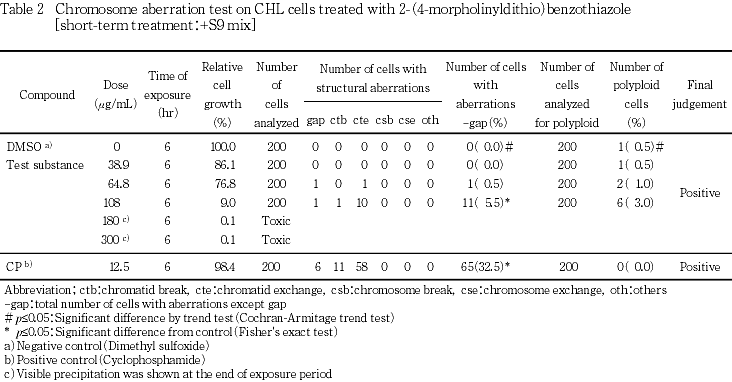
細胞増殖抑制試験結果をもとに,短時間処理法-S9処理では108 μg/mLを最高処理濃度とした5.04〜108 μg/mLの濃度範囲で7用量を,+S9処理では300 μg/mLを最高処理濃度とした23.3〜300 μg/mLの濃度範囲で6用量を設定した.S9 mix存在下および非存在下で6時間処理(18時間の回復時間)後,標本を作製し,検鏡することにより染色体異常誘発性を検討した.-S9処理では14.0, 23.3, 38.9 μg/mL,+S9処理では38.9, 64.8, 108 μg/mLのそれぞれ3用量(公比1.25)について顕微鏡観察を実施した.
その結果,-S9処理および+S9処理のいずれにおいても用量相関性を伴い,統計学的に有意な染色体異常の誘発が認められたが,強い細胞毒性作用が認められた用量であることと,出現頻度が低いことから確認試験を実施した.
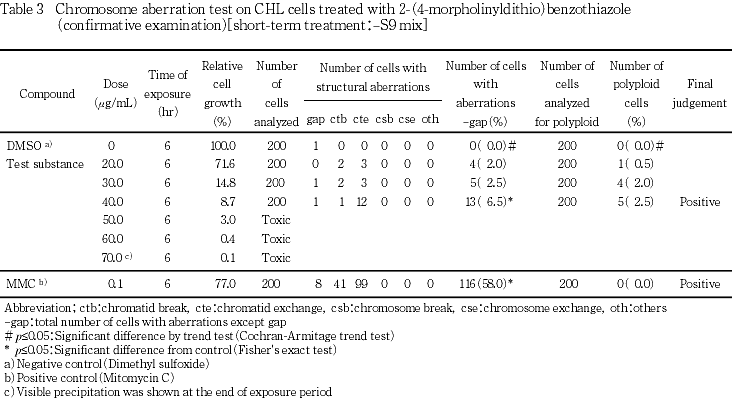
確認試験では,短時間処理法-S9処理で70.0 μg/mLを最高処理濃度とした20.0〜70.0 μg/mLの濃度範囲で6用量を,+S9処理では130 μg/mLを最高処理濃度とした80.0〜130 μg/mLの濃度範囲で6用量を設定し,-S9処理では20.0, 30.0, 40.0 μg/mLの3用量,+S9処理では80.0, 90.0, 100, 110, 120 μg/mLの5用量(公差10 μg/mL)について顕微鏡観察を実施した.
その結果,-S9処理および+S9処理のいずれにおいても用量相関性を伴い,統計学的に有意な染色体異常の誘発が認められた.しかしながら,-S9処理群でみられた陽性反応は全て極めて高い細胞毒性を示す濃度での反応であり,相対細胞増殖率14.8 %で陰性を示すため,明確な陽性反応ではないことから疑陽性と判断した.一方,+S9処理群では30〜50 %の相対細胞増殖率で陽性であることから陽性反応と判断した.
以上の結果より,本試験条件下では2-(4-モルホリニルジチオ)ベンゾチアゾールは,染色体異常を誘発する(陽性)と結論した.
| 成分 | S9 mix 1 mL中の量 |
| S9 | 0.3 mL |
| MgCl2 | 5 μmol |
| KCl | 33 μmol |
| G-6-P | 5 μmol |
| NADP | 4 μmol |
| HEPES緩衝液(pH 7.2) | 4 μmol |
| 蒸留水 | 0.1 mL |
12ウエルの細胞培養用マルチプレートに細胞を播種し,培養3日後に被験物質液を処理した.S9 mix非存在下(-S9処理)あるいは存在下(+S9処理)で6時間処理した後,新鮮な培養液に交換してさらに18時間培養を続けた.
細胞を10 vol%中性緩衝ホルマリン液(和光純薬工業)で固定した後,0.1 w/v%クリスタル・バイオレット(関東化学)水溶液で10分間染色した.色素溶出液(30 vol%エタノール,1 vol%酢酸水溶液)を適量加え,5分間程度放置して色素を溶出した後,分光光度計(105-50型:日立製作所)を用いて580 nmでの吸光度を測定した.各用量群について溶媒対照群での吸光度に対する比,すなわち相対細胞増殖率を算出し,さらにプロビット法を用いて50 %細胞増殖抑制濃度を算出した.
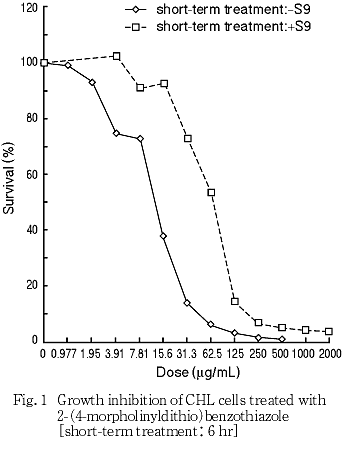
その結果,細胞増殖を50 %抑制する濃度は,短時間処理法-S9処理で11.2 μg/mLおよび+S9処理で57.4 μg/mLと算出された(Fig. 1).
なお,被験物質処理開始時,-S9処理の125 μg/mL以上の用量で白色粉末状の,500 μg/mLの用量で白色膜状の析出物が認められ,+S9処理の250 μg/mL以上の用量で白色粉末状の,2000 μg/mLの用量で白色膜状の析出物が認められた.処理終了時,-S9処理の125 μg/mL以上の用量で白色粉末状の,500 μg/mLの用量で白色膜状の析出物が認められ,+S9処理の250 μg/mL以上の用量で白色粉末状の,500 μg/mL以上の用量で白色塊状の析出物が認められた.なお,本被験物質調製液は,125 μg/mL以上の用量で均一な懸濁状態であったため,処理開始および処理終了時の培養液中に懸濁物の残存が認められた.

さらに,染色体異常試験結果より,両試験系において確認試験を実施し,-S9処理では70.0 μg/mLを,+S9処理では130 μg/mLを最高処理濃度とし,以下それぞれ公差10 μg/mLで減じた7用量を設定した.
なお,陽性対照として,-S9処理でマイトマイシンC(MMC:協和醗酵工業)を0.1 μg/mL,+S9処理でシクロホスファミド(CP:塩野義製薬)を12.5 μg/mLの用量で試験した.
すべての標本をコード化した後,染色体分析を実施した.
各試験群の構造異常を有する細胞あるいは倍数性細胞の出現頻度を,Fisherの直接確率計算法(有意水準0.05)を用いて検定した.また用量依存性については,Cochran Armitageの傾向検定(有意水準0.05)を用いて検定した.溶媒対照群と比較し被験物質処理群において有意差が認められ,かつ,再現性あるいは用量に依存性が認められた場合に陽性と判定した.
また,分裂中期像の20 %にいずれかの異常を誘発するのに必要な被験物質濃度であるD20値を最小二乗法により算出し,一定濃度(mg/mL)あたりの交換型異常(cte)出現数を示す比較値であるTR値を,染色分体交換の出現頻度(%)を被験物質濃度(mg/mL換算)で割ることにより算出した.
以上の通り,-S9処理および+S9処理のいずれにおいても,試験用量に依存した有意(p≦0.05)な染色体構造異常の誘発が認められたが,強い細胞毒性作用が認められた用量であること,また出現頻度が低いことから確認試験を実施した.確認試験の結果をTable3〜4に示した.2-(4-モルホリニルジチオ)ベンゾチアゾール処理群での染色体構造異常出現頻度は,-S9処理では20.0 μg/mLで2.0 %,30.0 μg/mLで2.5 %,40.0 μg/mLで6.5 %(p≦0.05)を示し,試験用量に依存した有意な増加(p≦0.05)が認められたが,極めて高い細胞毒性を示す濃度での反応であった.+S9処理では80.0 μg/mLで4.0 %(p≦0.05),90.0 μg/mLで8.5 %(p≦0.05),100 μg/mLで5.0 %(p≦0.05),110 μg/mLで7.0 %(p≦0.05),120 μg/mLで9.0 %(p≦0.05)を示した.倍数性細胞の出現頻度は,-S9処理では溶媒対照と比較し僅かに高値を示し,+S9処理では試験用量に依存した有意(p≦0.05)な増加が認められ,110 μg/mLにおいては3.0 %を示したが,そこでの相対細胞増殖率が21.8 %と高い細胞毒性を示していたことから生物学的に有意な増加でないと判断した.なお,その倍数性細胞の約半数は核内倍加であった.また,試験用量に依存した相対細胞増殖率の減少が観察され,-S9処理では染色体異常評価群中の高用量である40.0 μg/mLでの相対細胞増殖率が8.7 %であった.+S9処理では染色体異常評価群中の高用量である120 μg/mLでの相対細胞増殖率は8.8 %であった.一方,S9 mix非存在下における陽性対照物質MMCで処理した細胞,およびS9 mix存在下における陽性対照物質CPで処理した細胞では染色体構造異常の顕著な誘発が認められた.なお,被験物質処理開始時,-S9処理の60.0 μg/mL以上の用量で白色粉末状の析出物が認められ,+S9処理の70.0 μg/mL以上の用量で白色粉末状の析出物が認められた.処理終了時,-S9処理の70.0 μg/mLの用量で白色粉末状の析出物が認められ,+S9処理の70.0 μg/mL以上の用量で白色粉末状の析出物が認められた.
変異原性の強さに関する相対的比較値であるD20値の最小値は0.306(mg/mL),TR値の最大値は66.7(mg当たり)と算出された.
以上の試験結果から,本試験条件下において2-(4-モルホリニルジチオ)ベンゾチアゾールのチャイニーズ・ハムスター培養細胞に対する染色体異常誘発性に関し,陽性と判定した.
なお,本被験物質[2-(4-モルホリニルジチオ)ベンゾチアゾール]について,Ames試験で陰性との報告3)があった.類縁体であるbenzothiazolについてもAmes試験で陰性との報告3)があった.さらに,類縁体であるmorpholineについてもAmes試験および染色体異常試験で陰性結果4, 5)であったが,長期毒性試験で経口投与されたラットの肝臓と肺に腫瘍が少し認められたとの報告5)があった.

| 1) | Matsuoka A, Hayashi M, Ishidate M Jr: Chromosomal aberration tests on 29 chemicals combined with S9 mix in vitro. Mutation Res, 66:277-290(1979). |
| 2) | 日本環境変異原学会・哺乳動物試験分科会(編):「化学物質による染色体異常アトラス」朝倉書店,東京(1988)pp. 31-35. |
| 3) | HPV Chemical Challenge Program: Benzothiazole-based thiazoles Category, American Chemistry Council. Available from URL: http://www.epa.gov/chemrtk/bnzthict/c13324tc.htm, November, 2001. |
| 4) | 労働省労働基準局安全衛生部化学物質調査課(監修):労働安全衛生法有害性調査制度に基づく既存化学物質変異原性試験データ集,日本化学物質安全・情報センター,東京(1996)p.68. |
| 5) | Morpholine. IARC Monogr Eval Carcinog Risks Hum, 47:199-213(1989). |
| 連絡先 | |||
| 試験責任者: | 益森勝志 | ||
| 試験担当者: | 赤星まゆみ,永井美穂, 菊池正憲,仲村渠奈美子, 尾  伸也,梶原玲子, 伸也,梶原玲子,嶋田佐和子,鈴木雅也 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田郡福田町塩新田582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | ||||
| Authors: | Shoji Masumori(Study director) Mayumi Akahoshi, Miho Nagai, Masanori Kikuchi, Namiko Nakandakari, Shin-ya Ozaki, Reiko Kajihara, Sawako Shimada, Masaya Suzuki | |||
| Biosafety Research Center, Foods, Drugs and Pesticides(An-pyo Center) | ||||
| 582-2 Shioshinden, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan | ||||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |||