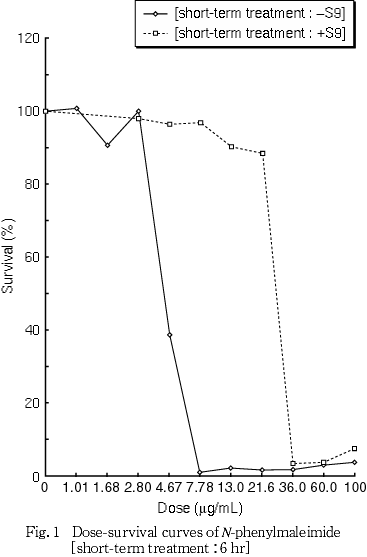
細胞増殖抑制試験結果をもとに,短時間処理法-S9処理では20.0 μg/mLを最高濃度とし,0.625〜20.0 μg/mLの6用量を,+S9処理では60.0 μg/mLを最高濃度とし,3.75〜60.0 μg/mLの5用量を設定した.S9 mix存在下および非存在下で6時間処理(18時間の回復時間)後,標本を作製し,検鏡することにより染色体異常誘発性を検討した.-S9処理では0.625〜5.00 μg/mL,+S9処理では3.75〜30.0 μg/mLのそれぞれ4用量について顕微鏡観察を実施した.
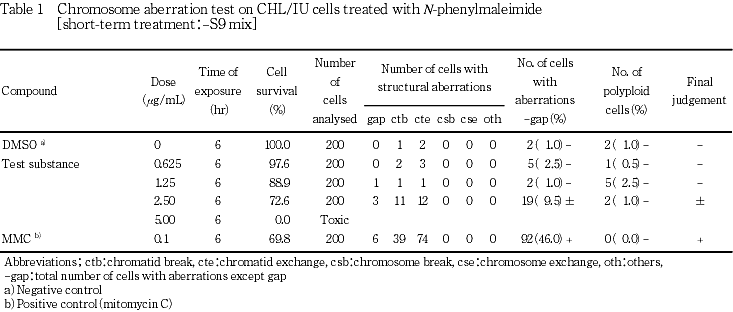
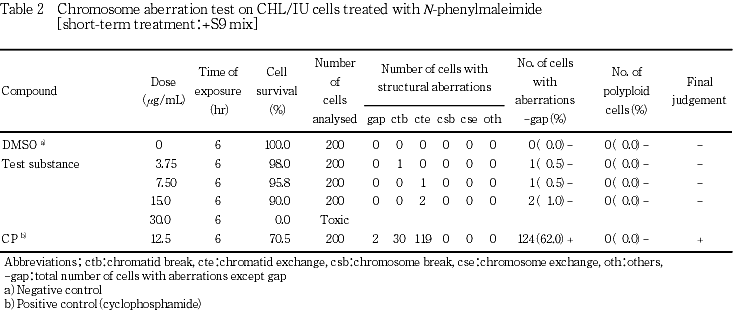
その結果,S9 mix存在下では染色体構造異常の明確な増加は観察されなかったが,S9 mix非存在下では,高用量群においてのみ染色体構造異常の出現頻度が疑陽性(±)となった.従って,1.50〜5.00 μg/mLの8用量を用いた確認試験を実施した.顕微鏡観察については2.50〜5.00 μg/mLの6用量について実施した.その結果,試験用量に依存した染色体構造異常の増加が観察された.
以上の結果より,本試験条件下ではN-フェニルマレイミドは,染色体異常を誘発する(陽性)と結論した.
| 成 分 | S9 mix 1 mL中の量 |
| S9 | 0.3 mL |
| MgCl2 | 5 μmol |
| KCl | 33 μmol |
| G-6-P | 5 μmol |
| NADP | 4 μmol |
| HEPES緩衝液(pH 7.2) | 4 μmol |
| 精製水 | 残 量 |
細胞を10 vol%中性緩衝ホルマリン液(和光純薬工業(株))で固定した後,0.1 w/v%クリスタル・バイオレット(関東化学(株))水溶液で10分間染色した.色素溶出液(30 vol%エタノール,1 vol%酢酸水溶液)を適量加え,5分間程度放置して色素を溶出した後,580 nmでの吸光度を測定した.各用量群について溶媒対照群での吸光度に対する比,すなわち細胞生存率を算出した.
その結果,細胞増殖を50 %抑制する濃度は,短時間処理法-S9処理で4.47 μg/mLおよび+S9処理で27.6 μg/mLと算出された(Fig. 1).
なお,被験物質暴露終了時,pHの変動,析出等の特筆すべき変化は観察されなかった.

-S9処理において染色体構造異常の出現に関し,1用量のみ疑陽性と判定されたことから,5.00 μg/mLを最高処理濃度とした確認試験を実施し,交差0.50 μg/mLで減じた計8用量を設定した.
なお,陽性対照として,-S9処理でマイトマイシンC(MMC:協和醗酵工業(株))を0.1 μg/mL,+S9処理でシクロホスファミド(CP:塩野義製薬(株))を12.5 μg/mLの用量で試験した.
すべての標本をコード化した後,マスキング法で観察した.
各試験群の構造異常を有する細胞あるいは倍数性細胞の出現頻度を,石館ら3)の基準に従って判定した.染色体異常を有する細胞の出現頻度が5 %未満を陰性(-),5 %以上10 %未満を疑陽性(±),10 %以上を陽性(+)とした.最終的には再現性あるいは用量に依存性が認められた場合に陽性と判定した.
なお,統計学的手法を用いた検定は実施しなかった.
また,分裂中期像の20 %にいずれかの異常を誘発するのに必要な被験物質濃度であるD20値を最小二乗法により算出し,一定濃度(mg/mL)あたりの交換型異常(cte)出現数を示す比較値であるTR値を,染色分体交換の出現頻度(%)を被験物質濃度(mg/mL換算)で割ることにより算出した.
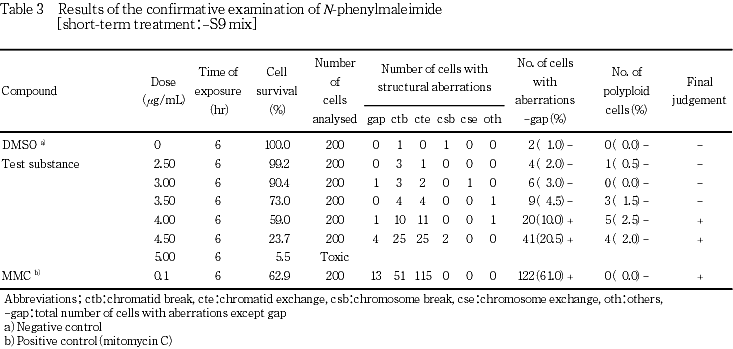
本被験物質処理群の-S9処理で染色体構造異常の出現頻度が疑陽性と判定されたが,1用量のみの増加であることから,再現性あるいは用量依存性をみるため,確認試験を実施した.その結果,染色体構造異常の出現に明確な用量依存性が認められた(Table 3).また,試験用量に依存した細胞増殖抑制作用が認められた.一方,陽性対照では染色体構造異常の顕著な誘発が認められた.
変異原性の強さに関する相対的比較値であるD20値は0.005(mg/mL),TR値は2778と算出され,既知変異原性物質に比較してN-フェニルマレイミドの変異原性は中等度であることを示していた.なお,被験物質暴露終了時,pHの変動,析出等の特筆すべき変化は観察されなかった.
以上の試験結果から,本試験条件下においてN-フェニルマレイミドのチャイニーズハムスター培養細胞に対する染色体異常誘発性に関し,陽性と判定した.
なお,本被験物質についてはプレート法によるAmes試験で陰性4)との報告がある.類縁体であるN,N'-p-phenylenedimaleimide, N,N'-o-phenylenedimaleimidならびに1-phenyl-2-pyrrolidioneの変異原性に関する報告はなかった.
| 1) | A. Matsuoka, M. Hayashi and M. Ishidate Jr., Mutat. Res., 66, 277(1979). |
| 2) | 日本環境変異原学会・哺乳動物試験分科会編,“化学物質による染色体異常アトラス,”朝倉書店,東京,1988, pp.31-35. |
| 3) | 石館基監修,“<改訂>染色体異常試験データ集,”エル・アイ・シー,東京,1987, pp.19-24. |
| 4) | 大八化学社内データ(生活科学研究所にて試験実施),1985. |
| 連絡先 | |||
| 試験責任者: | 中嶋 圓 | ||
| 試験担当者: | 北澤倫世,菊池正憲,熊平智司,板倉真由実,鈴木ゆみ子 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田郡福田町塩新田582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | ||||
| Authors: | Madoka Nakajima(Study Director) Michiyo Kitazawa, Masanori Kikuchi, Satoshi Kumadaira, Mayumi Itakura, Yumiko Suzuki | |||
| Biosafety Research Center, Foods, Drugs and Pesticides(An-pyo Center) | ||||
| 582-2 Shioshinden, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan | ||||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |||