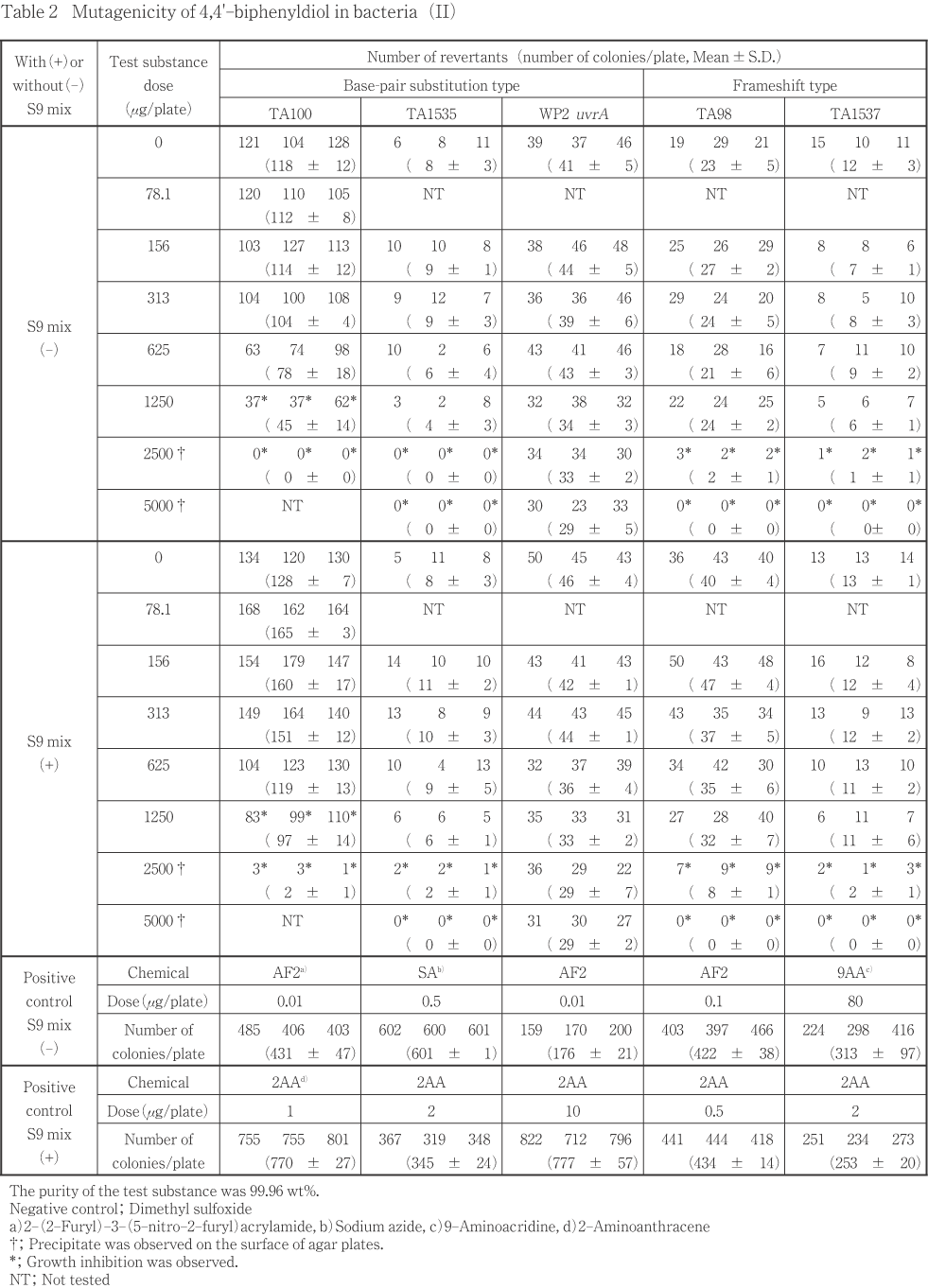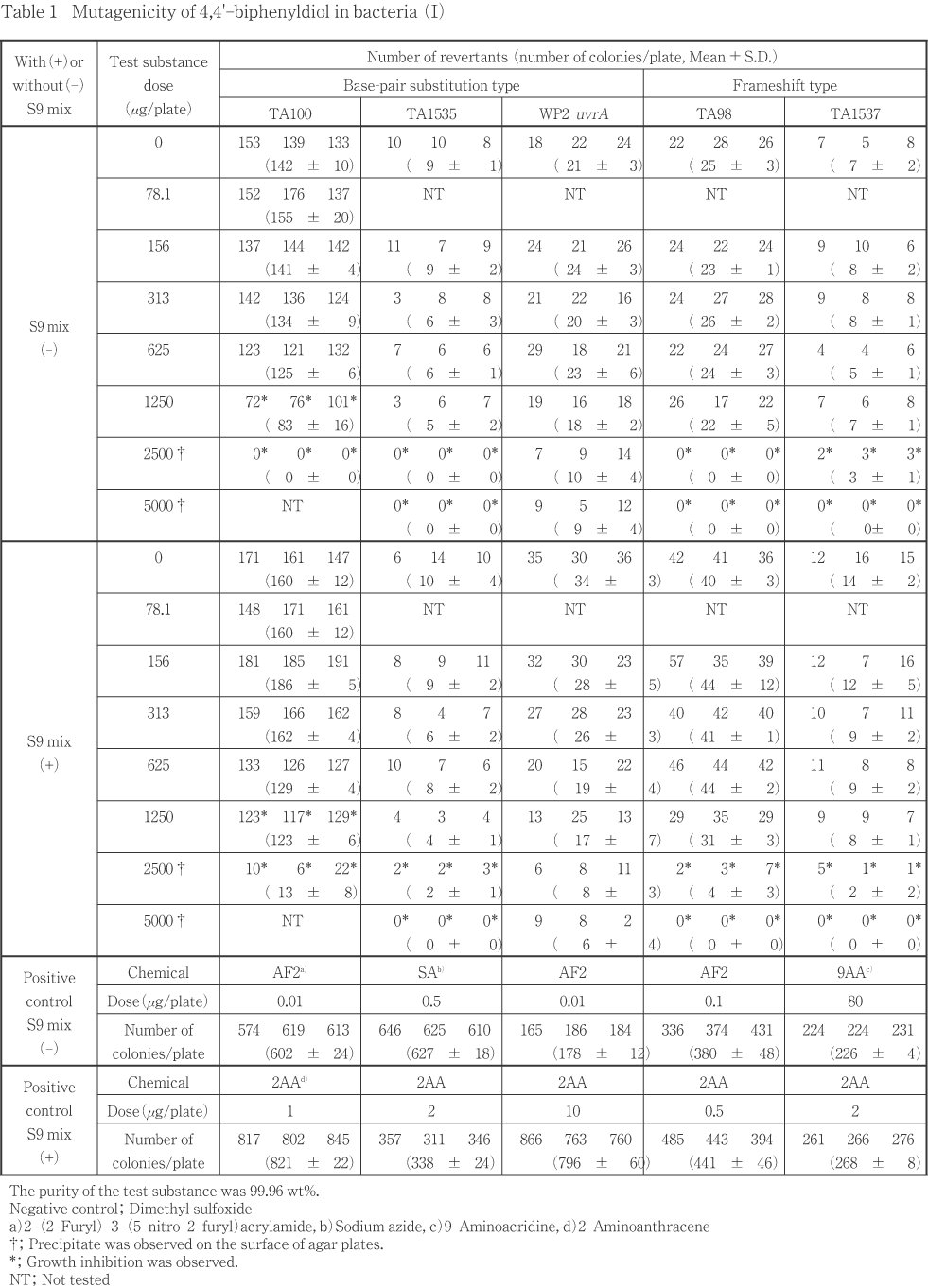
4,4'-ビフェニルジオールについて細菌を用いる復帰変異試験を実施した.
検定菌として,Salmonella typhimurium TA100,TA1535,TA98,TA15371)およびEscherichia coli WP2 uvrA2)の5菌株を用いた.WP2 uvrA以外の検定菌では用量設定試験で生育阻害が認められたことから,本試験はTA100については78.1〜2500 μg/plate ,それ以外の検定菌については156〜5000 μg/plateの範囲で実施した.
その結果,用いた5種の検定菌のいずれの用量においても,陰性対照値の2倍以上となる復帰変異コロニー数の増加は認められなかった.
以上の結果から4,4'-ビフェニルジオールは,用いた試験系において変異原性を有しないもの(陰性)と判定した.
4,4'-ビフェニルジオールは,白色結晶である.用いた被験物質は,ロット番号:020411,純度:99.96 %,製造:本州化学工業(和歌山)であり,本州化学工業から供与された.被験物質は,使用時まで密閉,遮光して室温で保管した.本ロットは,実験期間中安定であったことが被験物質提供者により確認されている.
4,4'-ビフェニルジオールは,ジメチルスルホキシド(DMSO,ロット番号:WAJ4459,和光純薬工業)に溶解して最高用量の調製液を調製した後,同溶媒で所定の濃度に希釈して速やかに試験に用いた.調製時に,発熱,発泡および変色は認められなかった.
用いた陽性対照物質および調製法は以下のとおりである.
各検定菌に用いた陽性対照物質は,当研究所で十分な蓄積データが得られている物質および用量とし,それぞれTable中に示した.
| 2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド | (AF2,和光純薬工業) |
| アジ化ナトリウム | (SA,和光純薬工業) |
| 9-アミノアクリジン | (9AA,Sigma Chem.) |
| 2-アミノアントラセン | (2AA,和光純薬工業) |
AF2,9AAおよび2AAはDMSOに,SAは超純水に溶解したものを-20℃で凍結保存し,解凍後,速やかに試験に用いた.
試験には,Salmonella typhimurium TA100,TA1535,TA98,TA1537およびEscherichia coli WP2 uvrAを用いた.
S. typhimuriumの4菌株は1997年8月7日に,E. coli WP2 uvrA株は1997年4月9日に日本バイオアッセイ研究センターの松島泰次郎博士から分与された.
検定菌は-80℃で凍結保存したものを用い,各菌株の特性確認は凍結保存菌の調製時に,アミノ酸要求性,UV感受性,膜変異(rfa),アンピシリン耐性因子pKM101(プラスミド)の有無および陰性対照と陽性対照の復帰変異コロニー数について調べ,特性が維持されていることを確認した.
試験に際して,ニュートリエントブロスNo. 2(Oxoid)を入れたL字型試験管に解凍した種菌を一定量接種し,37℃で10時間往復振とう培養したものを検定菌液とした.
分光光度計により660 nmの吸光度を測定し,検定菌液の増殖を確認した.
培地は,極東製薬工業製の最少グルコース寒天培地を用いた.なお,培地1 Lあたりの組成は下記のとおりである.
| 硫酸マグネシウム・七水和物 | 0.2 g |
| クエン酸・一水和物 | 2 g |
| リン酸水素二カリウム | 10 g |
| リン酸一アンモニウム | 1.92 g |
| 水酸化ナトリウム | 0.66 g |
| グルコース | 20 g |
| 大洋寒天(清水食品) | 15 g |
径90 mmのシャーレ1枚あたり30 mLを流して固めたものである.
下記の水溶液(A)および(B)または(C)を容量比10:1の割合で混合した.
| (A)バクトアガー(Difco) | 0.6 w/v% |
| 塩化ナトリウム | 0.5 w/v% |
| (B)Salmonella typhimurium用 | |
| L-ヒスチジン | 0.5 mmol/L |
| D-ビオチン | 0.5 mmol/L |
| (C)Escherichia coli用 | |
| L-トリプトファン | 0.5 mmol/L |
S9 mix 1 mLあたりの組成は下記のとおりである.
| S9* | 0.1 mL |
| 塩化マグネシウム | 8 μmol |
| 塩化カリウム | 33 μmol |
| グルコース-6-リン酸 | 5 μmol |
| NADH | 4 μmol |
| NADPH | 4 μmol |
|
ナトリウム-リン酸緩衝液(pH 7.4) |
100 μmol |
*:7週齢のSprague-Dawley系雄ラットをフェノバルビタール(PB)および5,6-ベンゾフラボン(BF)の併用投与で酵素誘導して作製したS9(キッコーマン)を用いた.
プレインキュベーション法3)により,S9 mix無添加条件およびS9 mix添加条件で試験を行った.
小試験管中に,被験物質調製液0.1 mL,S9 mix無添加条件では0.1 mol/Lナトリウム-リン酸緩衝液(pH 7.4)0.5 mL,S9 mix添加条件ではS9 mix 0.5 mL,検定菌液0.1 mLを混合し,37℃で20分間プレインキュベーションしたのち,約45℃に保温したトップアガー2 mLを加えて混和し,合成培地平板上に流して固めた.また,被験物質調製液の代わりに使用溶媒,または数種の陽性対照物質溶液を用いてそれぞれ陰性対照および陽性対照とした.同時に実施した他試験については,陰性および陽性対照の結果を共通とした.
培養は37℃で48時間行い,発生した復帰変異コロニー数をコロニーアナライザーまたは目視によって算定した.被験物質に由来する沈澱の有無は,肉眼により確認した.また,生育阻害の有無については,肉眼あるいは実体顕微鏡下で,寒天表面の菌叢の状態から判断した.用いた平板は用量設定試験においては,陰性および陽性対照では3枚ずつ,各用量については1枚ずつとした.また,本試験においては,両対照および各用量につき3枚ずつを用い,それぞれの平均値と標準偏差を求めた.陰性および陽性対照の復帰変異コロニー数の平均値を,それぞれ陰性対照値および陽性対照値とした.
用量設定試験は1回,本試験は同一用量について2回実施し,結果の再現性の確認をした.
用いた5種の検定菌のうち,1種以上の検定菌のS9 mix無添加条件あるいはS9 mix添加条件において,被験物質を含有する平板上における復帰変異コロニー数の平均値が,陰性対照値の2倍以上に増加し,その増加に再現性および用量依存性が認められた場合に,当該被験物質は本試験系において変異原性を有するもの(陽性)と判定することとした.
50.0〜5000 μg/plateの範囲で公比を約3として,用量設定試験を実施した.その結果,TA100のS9 mix無添加および添加条件では1500 μg/plate以上の用量で,TA1535,TA98およびTA1537のS9 mix無添加および添加条件では5000 μg/plateの用量で生育阻害が認められた.WP2 uvrAについては生育阻害は認められなかった.また,被験物質に由来する沈澱は,S9 mix無添加条件では1500 μg/plate以上の用量で,S9 mix添加条件では5000 μg/plateの用量で認められた.
したがって,最高用量を,TA100では2500 μg/plate,それ以外の検定菌では5000 μg/plate として,公比2で6用量を設定して2回の本試験を実施した(Table 1, 2).その結果,TA100のS9 mix無添加および添加条件では1250 μg/plate以上の用量で,TA1535,TA98およびTA1537のS9 mix無添加および添加条件では2500 μg/plate以上の用量で生育阻害が認められた.WP2 uvrAについては生育阻害は認められなかった.復帰変異コロニー数は,いずれの検定菌においても,陰性対照値の2倍以上となる増加は認められなかった.
以上の結果に基づき,4,4'-ビフェニルジオールは,用いた試験系において変異原性を有しないもの(陰性)と判定した.
なお4,4'-ビフェニルジオールは,当研究所で本試験と並行して実施したチャイニーズ・ハムスター培養細胞を用いる染色体異常試験では構造異常および倍数性ともに陽性の結果が得られている4).また,関連物質である4,4'-diaminodiphenylについては,復帰変異試験で陽性の結果が報告されている5).Biphenylについては復帰変異試験では陰性,染色体異常試験ではマウスS9を用いた代謝活性化法において陽性の結果が報告されている6-8).o-Phenylphenolについては復帰変異試験,染色体異常試験ともに陰性の結果が報告されている9).2,5-Dihydroxybiphenylについては染色体異常試験で陰性の結果が報告されている10).Phenolについては復帰変異試験では陰性,Allium cepaを用いた染色体異常試験では陰性の結果が報告されている11, 12).
| 1) | Maron DM, Ames BN:Revised methods for the Salmonella mutagenicity test. Mutation Res, 113:173-215(1983). |
| 2) | Green MHL:Mutagen testing using Trp+ reversion in Escherichia coli. In メHandbook of Mutagenicity Test Proceduresモ, Kilbey BJ, Legator M, Nichols W et al.(eds.), Elsevier, Amsterdam(1984)pp.161-187. |
| 3) | Matsushima T, Sugimura T, Nagao M et al.: Factors modulating mutagenicity in microbial tests. In メShort-term Test Systems for Detecting Carcinogensモ, Norpoth KH, Garner RC(eds.), Springer, Berlin(1980)pp.273-285. |
| 4) | 田中憲穂ら:4,4'-ビフェニルジオールのチャイニーズ・ハムスター培養細胞を用いる染色体異常試験.化学物質毒性試験報告,12:144-148(2005). |
| 5) | 賀田恒夫,石館基(監修):「環境変異原性データ集1」サイエンティスト社,東京(1980)p.60. |
| 6) | 労働安全衛生法有害性調査制度に基づく既存化学物質変異原性試験データ集,日本化学物質安全・情報センター,東京(1986)p.229. |
| 7) | 祖父尼俊雄(監修):「染色体異常試験データ集」1998年版,エル・アイ・シー,東京(1999)p.77. |
| 8) | 賀田恒夫,石館基(監修):「環境変異原性データ集1」サイエンティスト社,東京(1980)p.68. |
| 9) | 祖父尼俊雄(監修):「染色体異常試験データ集」1998年版,エル・アイ・シー,東京(1999)p.392. |
| 10) | 祖父尼俊雄(監修):「染色体異常試験データ集」1998年版,エル・アイ・シー,東京(1999)p.186. |
| 11) | 賀田恒夫,石館基(監修):「環境変異原性データ集1」サイエンティスト社,東京(1980)p.329. |
| 12) | 労働安全衛生法有害性調査制度に基づく既存化学物質変異原性試験データ集,日本化学物質安全・情報センター,東京(1986)p.196. |
| 連絡先 | |||
| 試験責任者: | 原 巧 | ||
| 試験担当者: | 須井 哉,大山徳子, 三枝克彦,加藤初美 | ||
| 7食品薬品安全センター秦野研究所 | |||
| 〒257-8523 秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Takumi Hara(Study Director) Hajime Sui, Noriko Ohyama, Katsuhiko Saegusa, Hatsumi Kato | ||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | |||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | ||