死亡は,雌雄とも1000 mg/kg以上の群で投与翌日から6日目にみられた.一般状態では,投与日(1日目)から自発運動の低下が250 mg/kg以上の群の雄および500 mg/kg以上の群の雌に,よろめき歩行が500 mg/kg以上の群の雌雄に,緩徐呼吸,腹臥位,横臥位,流涙および流涎が1000 mg/kg以上の群の雄および500 mg/kg以上の群の雌にみられ,2日目からは鼻周囲の汚れ,眼周囲の汚れおよび濃黄色尿の排泄または尿による下腹部の汚れが1000 mg/kg以上の群の雄および500 mg/kg以上の群の雌にみられた.生存例では,これらの症状は2から15日目までに250 mg/kg群から順次回復した.体重では,すべての被験物質投与群の雌雄で増加抑制または減少がみられたが,250および500 mg/kg群では4日目,1000 mg/kg群では6ないし8日目,2000 mg/kg群では11ないし15日目に回復した.病理学検査において,死亡例では,前胃に肉眼的に粘膜の肥厚がみられ,組織学的には粘膜下組織の浮腫がみられた.脾臓および胸腺では肉眼的および組織学的に萎縮がみられ,胸腺では肉眼的に白色化もみられた.また,膀胱では濃緑色尿の貯留がみられた.生存例では,前胃に肉眼的に粘膜の白色点がみられ,組織学的には粘膜に扁平上皮の過形成がみられた.
LD50値(95 %信頼限界)は,雄で933 mg/kg(583〜1494 mg/kg),雌で1231 mg/kg(838〜1808 mg/kg)であった.
投与経路は経口とし,16〜17時間絶食させた動物に胃管を用いて1回強制投与した.投与容量は10 mL/kgとし,各動物の投与液量は投与日の体重を基に算出した.

1000 mg/kg群の雄3例および雌1例ならびに2000 mg/kg群の雄3例および雌4例が2日目から6日目に死亡した.LD50値(95 %信頼限界)は,雄で933 mg/kg(583〜1494 mg/kg),雌で1231 mg/kg(838〜1808 mg/kg)であった.

500 mg/kg群では,投与後45分から雌雄の全例で自発運動の低下,多数例でよろめき歩行がみられた.また,雌では緩徐呼吸,腹臥位,横臥位,流涙または流涎も散見された.2日目には腹臥位,横臥位,流涙および流涎は回復したが,鼻周囲の汚れ,眼周囲の汚れまたは濃黄色尿の排泄が散見された.これらの症状は雄で2日目,雌で3日目にすべて回復した.
1000 mg/kg以上の群では,雌雄で投与後15分ないし30分から自発運動の低下および緩徐呼吸が全例にみられ,投与後30分ないし45分からはよろめき歩行,腹臥位,横臥位,流涙または流涎がほぼ全例にみられた.2日目からは,雌雄でこれらの症状に加えて鼻周囲の汚れ,眼周囲の汚れ,濃黄色尿の排泄または尿による下腹部の汚れが散見され,更に2日目から6日目には死亡例もみられた.生存例では,上述した症状は1000 mg/kg群の雄で12日目に,雌で7日目に,2000 mg/kg群の雌雄で15日目にすべて回復した.
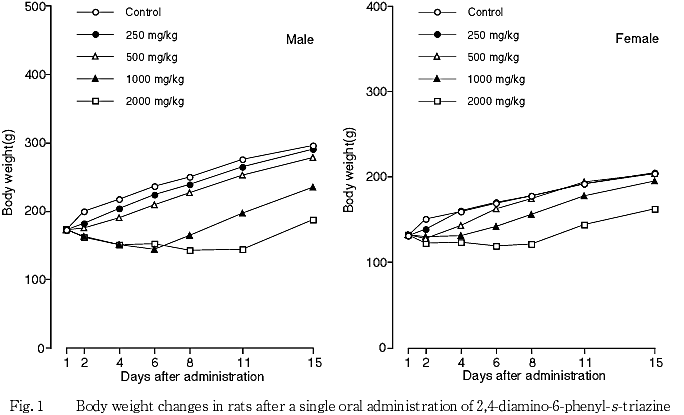
500 mg/kg以上の群では,雌雄で減少または増加抑制がみられたが,500 mg/kg群の雌雄では4日目に,1000 mg/kg群の雌雄では6ないし8日目に,2000 mg/kg群の雌雄では11ないし15日目に回復した.
生存例では,前胃に粘膜の白色点が2000 mg/kg群の雌1例にみられた.
生存例では,前胃に扁平上皮の過形成がみられた.
死亡は,1000 mg/kg以上の群の雌雄で投与翌日(2日目)から6日目までにみられた.LD50値(95 %信頼限界)は,雄で933 mg/kg(583〜1494 mg/kg),雌で1231 mg/kg(838〜1808 mg/kg)であった.
一般状態では,自発運動の低下が250 mg/kg以上の雄および500 mg/kg以上の群の雌にみられ,よろめき歩行が500 mg/kg以上の群の雌雄に,緩徐呼吸,流涙,流涎または濃黄色尿の排泄が1000 mg/kg以上の群の雄および500 mg/kg以上の群の雌にみられた.生存例では,これらの症状は2から15日目までに250 mg/kg群から順次回復した.なお,1000 mg/kg以上の群の雄および500 mg/kg以上の群の雌では,流涎,流涙または濃黄色尿の排泄に関連して鼻周囲,眼周囲または下腹部の汚れがみられたが,これらの変化は自発運動の低下や腹臥位または横臥位状態が持続したことによる身づくろい行動の抑制に伴った変化と考えられた.
体重では,すべての被験物質投与群の雌雄で増加抑制または減少がみられたが,250および500 mg/kg群では4日目、1000 mg/kg群では6ないし8日目,2000 mg/Kg群では11ないし15日目に回復した.
病理学検査において,死亡例では,1例のみではあるが肉眼的に前胃粘膜の肥厚がみられ,組織学的には前胃粘膜下組織の浮腫がみられたことから,本被験物質は弱い刺激性を有するものと考えられた.また,脾臓および胸腺では萎縮がみられたが,これらの所見を示した例では3ないし6日目の死亡に至るまでの間,緩徐呼吸,横臥位などの症状が継続してみられ,体重も明らかに減少していることから,衰弱に伴った変化であろうと考えられた.更に,膀胱では濃緑色尿の貯留がみられたが,被験物質の代謝物の尿中排泄によるものと考えられ,膀胱に組織学的な変化はみられなかった.そのほか,死亡例では出血によると思われる胸腺の黒赤色点がみられたが,本変化は死亡例ではしばしばみられる変化であり,死戦期に生じた変化と考えられた.一方,生存例では,2000 mg/kg群で肉眼的に前胃粘膜の白色点がみられ,組織学的には前胃に扁平上皮の過形成がみられた.本変化は前述の本被験物質の前胃粘膜に対する刺激性による障害の修復像と考えられた.
| 連絡先 | |||
| 試験責任者: | 緒方英博 | ||
| 試験担当者: | 木村栄介,浜村政夫,幸 邦憲,和泉宏幸,鍬先恵美子 | ||
| (株)パナファーム・ラボラトリーズ 安全性研究所 | |||
| 〒869-0425 熊本県宇土市栗崎町1285 | |||
| Tel 0964-23-5111 | Fax 0964-23-2282 | ||
| Correspondence | ||||
| Authors: | Hidehiro Ogata (Study director) Eisuke Kimura, Masao Hamamura, Kuninori Yuki, Hiroyuki Izumi, Emiko Kuwasaki | |||
| Safety Assessment Laboratory, Panapharm Laboratories Co., Ltd. | ||||
| 1285 Kurisaki-machi, Uto-shi, Kumamoto, 869-0425, Japan. | ||||
| Tel +81-964-23-5111 | Fax +81-964-23-2282 | |||