2-ヒドロキシベンズアルデヒドのラットを用いる
反復経口投与毒性・生殖発生毒性併合試験
Combined Repeat Dose and Reproductive/Developmental Toxicity Screening Test
of 2-Hydroxybenzaldehyde by Oral Administration in Rats
要約
2-ヒドロキシベンズアルデヒドはバラ科シモツケソウ類の花,タバコの葉等に含まれ,トマト,グレープ,シナモン,コーヒー,お茶等の匂いの成分としても存在する化学物質1)であり,構造的にはサリチル酸に非常に類似している2).また,本化学物質は石鹸,洗剤,香水等に0.005〜0.2%の濃度で含有されている1).本化学物質の毒性データでは,ラットのLD50値は経口投与で520 mg/kg,皮下投与で900 mg/kg,経皮投与で600 mg/kg,腹腔内投与で231 mg/kgであること,ラットに13日間反復混餌投与した場合,2%投与群では肝細胞の好塩基小体の著しい減少,膵腺房細胞からのチモーゲン顆粒の枯渇,1%投与群では肝および腎のマイクロボディーの数および大きさの増加,肝細胞の脂肪滴等の変化が起こること,さらに,乳頭腫または癌を誘発しないことが報告されている1).本化学物質はラット,マウスに100 mg/kgを単回皮下投与することによって低カルシウム血症が起こること,妊娠11日のラットに400 mg/kgを単回皮下投与することによりサリチル酸あるいはアスピリンの場合と同様に胎生期死亡の増加,口唇裂および多指等の外表奇形の出現が増加することが報告されている2).このサリチル酸類における胎児毒性の主たる要因の一つは低カルシウム血症であることも報告されている2).サリチル酸類の生殖発生毒性については多くの動物種で報告され,ヒトにおいてもプロスタグランジン生合成の抑制により遷延分娩,子宮からの出血等について報告されている3〜6).本試験はOECDによる既存化学物質の安全性点検に係わる毒性調査事業の一環として2-ヒドロキシベンズアルデヒドを雌雄ラットに1日1回,雄には交配2週間前から交配期間を通して剖検前日までの49日間,雌には交配2週間前から交配期間,妊娠期間を通して哺育3日までの41〜46日間経口投与し,反復投与による一般毒性学的な影響を検索するとともに,雌雄動物の性腺機能,交尾行動,受胎および分娩などの生殖発生に及ぼす影響について検索した.
1. 反復投与毒性
雄では,死亡例はなく,一般状態,体重,摂餌量,血液学検査値,血液生化学検査値,剖検所見および器官重量に被験物質投与の影響は認められなかった.病理組織学検査の結果,
40 mg/kg以上の被験物質投与群において肝臓の少葉周辺性脂肪化の程度およびその出現頻度が対照群に比べて減少した.
雌では,
40 mg/kg群の1母体が妊娠22日の分娩途中で,また,160 mg/kg群の1母体が妊娠22日に死亡した以外に死亡例はなく,一般状態の変化は観察されなかった.器官重量では160 mg/kg群において肝臓重量が高値を,卵巣重量が低値を示した.しかし,体重,摂餌量および剖検所見には被験物質投与の影響は認められなかった.病理組織学検査の結果,40 mg/kg以上の被験物質投与群において肝細胞内のグリコーゲン量の軽微な増加が観察された.
2. 生殖発生毒性
親動物に関して,雌の性周期および発情回数,雌雄の交尾および受胎,雌動物の妊娠期間および分娩に及ぼす被験物質投与の影響は認められなかった.哺育の異常は,
40 mg/kg以下の被験物質投与群には認められなかった.160 mg/kg群では哺育4日までに全児死亡の母動物が2例認められた.生児出産雌数,出産率,黄体数,着床痕数および着床率には被験物質投与の影響は認められなかった.
新生児では,哺育
0日の生存児数,死産児数,性比,分娩率および出生率には被験物質投与の影響は認められず,新生児および死産児に被験物質投与に起因すると考えられる外表異常は認められなかった.哺育期間中の児の死亡は,160 mg/kg群において多い傾向が見られ,同群の哺育4日の新生児生存率は低い傾向にあった.また,哺育0日および4日の体重は160 mg/kg群においてわずかに低値を示す傾向にあった.
以上の成績から,本試験条件下における一般毒性学的な無影響量は雌雄ともに
10 mg/kg/dayであると考えられた.また,生殖発生毒性的な無影響量は,雄に関しては160 mg/kg/day,雌に関しては40 mg/kg/day,新生児に関しては40 mg/kg/dayであると考えられた.
方法
1. 被験物質
2-ヒドロキシベンズアルデヒド[CAS No. 90-02-8,セイミケミカル(株),Lot No. 082316,純度99.3%,分子量122.12,比重1.167,融点-7℃,沸点196〜197℃]は,無色〜淡黄色透明油状液体であり,窒素置換し,密閉・室温・暗所条件下で保存した.なお,動物試験終了後に残余の被験物質を分析した結果,純度は99.3%であり,被験物質は安定であったことが確認された。
被験物質は,オリーブ油
(丸石製薬(株))に溶解し0.05,0.2,0.8および3.2%(w/v)濃度に調製した.なお,調製は1週間に2回の頻度で行った.調製後の被験液は,1日分ずつ褐色ガラス瓶に分注し,窒素置換した上で室温・暗所保存した.本被験物質の0.05〜3.2% (w/v)液は,窒素置換・室温・暗所保存条件下で8日間安定であることが確認されている.
被験液の濃度確認は雌雄の投与開始前および雄の投与最終週の
2回,各濃度液につい実施した.その結果,いずれの被験液も設定濃度の96.9〜104.0%の範囲であり,ほぼ設定濃度の2-ヒドロキシベンズアルデヒドが含有されていたことを確認した.
2. 使用動物および飼育条件
試験には,雌雄とも日本チャールス・リバー
(株)より7週齢で購入したSprague-Dawley(Crj:CD)系SPFラットを使用した.動物は,購入後7日間検疫・馴化飼育した後,一般状態に異常がなく,体重増加が良好な動物を8週齢で群分けして試験に使用した.群分け時の体重範囲は雄で294〜319 g,雌で 195〜223 gであった.
動物は,温度
22.5±3.5℃,相対湿度50±20%,換気回数1時間10〜15回,照明1日12時間(午前7時〜午後7時)の飼育室で飼育した.動物は,交配期間および妊娠17日から哺育4日までの期間を除き,金属製網ケージ[リードエンジニアリング(株)または理工電機(株)]に個別に収容し,飼育した.妊娠17日以降の母動物は,哺育4日まで床敷として木製チップ[ホワイトフレーク,日本チャールス・リバー(株)]を入れたプラスチック製エコンケージ[日本クレア(株)]に飼育した.
飼料は,オリエンタル酵母工業
(株)のNMF固型飼料を使用し,飼料および飲料水は,飼育期間中自由に摂取させた.
3. 群分け
群分けは,投与開始日に行った.動物は,雌雄とも群分け当日の体重,検疫・馴化期間中の増体重あるいは性周期の観察結果などにより選択した後,当日の体重で層別化し,コンピュータを用いたブロック配置法により各群に振り分けた.
1群の動物数は,雌雄各12匹とした.
4. 投与量,群構成,投与期間および投与方法
2-ヒドロキシベンズアルデヒドの投与量は,先に実施した予備試験の結果を参考にして2.5,10,40および160 mg/kgとした.
投与経路は,
OECDガイドラインに準じて強制経口投与とした.投与容量は,体重100 g当たり0.5 mlとし,個体毎の投与液量は,雄は各測定日の体重を,雌は交配前および交配期間中については各測定日の体重,妊娠期間中については妊娠0日,7日,14日および21日の体重,授乳期間中については哺育0日の体重を基準に算出した.
投与は,金属製胃ゾンデを用いて
1日1回強制経口投与した.対照群にはオリーブ油のみを同様に投与した.雄の投与期間は,交配前14日間およびその後35日間の計49日間,雌の投与期間は,交配前14日間,交配期間,妊娠期間および哺育3日までの41〜46日間とした.
5. 投与量の設定
2-ヒドロキシベンズアルデヒドの0,50,100,200および400 mg/kgを8週齢のSprague-Dawley(Crj:CD)系ラット雌雄各5匹に1日1回,14日間にわたって反復経口投与し,雌雄ラットに及ぼす影響について検討した.
その結果,
400 mg/kg群では雄の全例,雌の5例中4例が,200 mg/kg群では雄の5例中1例,雌の5例中2例が投与7日までに死亡した.しかし,100 mg/kg以下の投与群では一般状態,体重,摂餌量,血液学検査値,血液生化学検査値等に明らかな被験物質投与の影響は認められなかった.したがって,最高用量は,死亡例の認められた200 mg/kgと被験物質投与の影響が認められなかった100 mg/kgのほぼ中間量に相当する160 mg/kg/dayとし,以下,公比4で減じて高用量を40 mg/kg/day,中用量を10 mg/kg/day,低用量を2.5 mg/kg/dayに設定した.
6. 反復投与毒性に関する観察,測定および検査
1) 一般状態
一般状態の観察は,雌雄とも試験期間を通じて毎日行った.
2) 体重
雄の体重は,投与
1日,4日,8日,11日,15日,22日,29日,36日,43日および50日に測定した.雌の体重は,投与1日,4日,8日,11日および15日,交配期間中は週1回,妊娠期間中は妊娠0日,7日,14日および21日,哺育期間中は哺育0日および4日に測定した.
3) 摂餌量
摂餌量は,雄では投与開始日および剖検日を除く体重測定と同じ日に,雌では交配前は投与開始日を除く体重測定と同じ日,妊娠期間中は妊娠
1日,7日,14日および21日,哺育期間中は哺育1日および4日に前日からの残量を測定し,給餌量との差から1日摂取量を算出した.なお,交配期間中の摂餌量は測定しなかった.
4) 雄の血液学検査
雄の全動物について,剖検日の前日より約
16時間絶食させ,エーテル麻酔下で腹大動脈より採取した血液の一部に抗凝固剤,EDTA-2K処理した血液を用いて赤血球数(電気抵抗変化検出法),ヘモグロビン量(シアンメトヘモグロビン法),ヘマトクリット値(平均赤血球容積×赤血球数/10^3),血小板数(電気抵抗変化検出法),白血球数(電気抵抗変化検出法)をコールター全自動8項目血球アナライザーT890[(株)日科機]を用いて測定した.また,採取した血液の一部を3.8%クエン酸ナトリウム処理した血漿を用いてプロトロンビン時間(クロット法),活性化部分トロンボプラスチン時間(クロット法),フィブリノーゲン量(トロンボプラスチン法)を血液凝固測定装置ACL100(Instrumentation Laboratory)を用いて測定した.検査結果から,平均赤血球容積(MCV),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC)を算出した.
白血球百分率は
May-Giemsa染色塗抹標本,網赤血球率はBrecher法による超生体染色標本の鏡検により算出した.
5) 雄の血液生化学検査
雄の全動物について,血液学検査のための採血と同時に腹大動脈から採取して得られた血液を遠心分離
(3000 rpm,10分間)し,得られたヘパリン加血漿を用いてGOT,GPT,LDH(UV-rate法)を,また,血清を用いてAlP(Bessey-Lowry法),総コレステロール(CEH-COD-POD法),トリグリセライド(GK-GPO-POD法),リン脂質(PLD-ChoD-POD法),総ビリルビン(アゾビリルビン法),血糖(Hexokinase-G6PD法),尿素窒素(Urease-GLDH法),クレアチニン(Jaff 法),ナトリウム(イオン選択電極法),カリウム(イオン選択電極法),塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総蛋白質(Biuret法)を全自動分析装置(Monarch:Instrumentation Laboratory)を用いて測定した.また,全自動電気泳動装置 CLINISCAN2(株式会社ヘレナ研究所)を用いて蛋白質分画(セルロースアセテート膜による電気泳動法)を測定し,蛋白質分画比率からA/G比を算出した.
法),ナトリウム(イオン選択電極法),カリウム(イオン選択電極法),塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総蛋白質(Biuret法)を全自動分析装置(Monarch:Instrumentation Laboratory)を用いて測定した.また,全自動電気泳動装置 CLINISCAN2(株式会社ヘレナ研究所)を用いて蛋白質分画(セルロースアセテート膜による電気泳動法)を測定し,蛋白質分画比率からA/G比を算出した.
6) 病理検査
雄は,全動物を最終投与の翌日に,雌は全生存動物について哺育
4日にエーテル麻酔下で放血致死させて剖検し,心臓,胸腺,肝臓,腎臓,脾臓,精巣および精巣上体あるいは卵巣の重量を測定した.これらの器官に加えて,脳,下垂体,甲状腺(上皮小体を含む),肺(気管支を含む),副腎,子宮,腟および剖検で異常が認められた器官を採取し,リン酸緩衝10%ホルマリン液(精巣および精巣上体はブアン液)に固定した.なお,妊娠期間中に死亡した40および160 mg/kg群の母動物各1例,新生児が全て死亡した160 mg/kg群の母動物2例についても同様に処置した.
雌雄とも対照群および
160 mg/kg群の脳,心臓,肝臓,腎臓,副腎,脾臓,精巣および精巣上体あるいは卵巣について常法に従ってヘマトキシリン・エオジン染色を行い鏡検した.その結果,雌雄の肝臓に被験物質投与の影響が疑われたため,2.5,10および40 mg/kg群についても検査を行った.さらに,雄では肝臓の小葉周辺帯肝細胞の細胞質内に微細〜小型の空胞が観察されたため,その性状を詳細に検討するため対照群,40および160 mg/kg群の各3例についてオイルレッドO染色を実施した.また,雌の160 mg/kg群の肝臓においてヘマトキシリン・エオジン染色標本で肝臓の細胞質が腫大淡明化し明るくぬけて観察されたことから,その性状を詳細に検討するため160 mg/kg群の2例についてPAS反応および唾液消化後PAS反応を実施した.なお,40および160 mg/kg群の雌では剖検時に異常が観察された胸腺,肺,皮下結節についても鏡検した.
7. 生殖発生毒性に関する観察,測定および検査
1) 性周期観察および交配
交配前
14日間の性周期の観察を行った雌を同一群内の雄のケージに入れ1対1の組み合わせで終夜同居させた.同居期間は最長14日間として,交尾が確認されるまでとした. なお,交尾の確認は毎朝,腟栓形成あるいは腟垢中の精子の有無により行い,これらが確認された日を妊娠0日とした.交配結果から,各群について交尾率[(交尾確認動物数/交配動物数)×100],受胎率[(受胎動物数/交尾確認動物数)×100]および交尾までの同居日数を求めた.性周期観察は,投与開始日から交尾が確認されるまで毎日行い,発情期像発現回数および発情期から次の発情期までの日数を性周期とし,平均性周期を算出した.
2) 分娩および哺育状態
交尾が確認された雌については全例を自然分娩させ,分娩状態を観察した.午前
10時の時点で分娩が終了していた動物を当該日分娩とし,その日を哺育0日とした.午前10時を過ぎて分娩した場合は翌日を哺育0日とした.交尾確認後25日を経ても分娩が確認されなかった例については剖検し,妊娠の成否を確認した.
分娩終了が確認された母動物については出生児を哺育させ,哺育
4日まで毎日,哺育状態の観察を行った.これらの結果から,妊娠期間[哺育0日(分娩確認日)-妊娠0日],出産率[(生児出産雌数/受胎動物数)×100],着床率[(着床痕数/黄体数)×100],分娩率[(総出産児数/着床痕数)×100]を算出した.
8. 新生児の観察,測定および検査
1) 新生児の観察
哺育
0日に生存児数,死産児数を数え,性別および外表異常の有無を検査した.生存児は全例を母動物に哺育させ,死亡の有無の観察を毎日1回行った.また,死亡児は死後変化の著しいものを除いてリン酸緩衝10%ホルマリン液に固定し,保存した.これらの結果から,性比[雄/雌],出生率[(哺育0日の生存児数/総出産児数)×100],新生児生存率[(哺育4日の生存児数/哺育0日の生児数)×100]を算出した.
2) 体重
体重は,哺育
0日および4日に測定し,1腹毎に雌雄の平均値を算出した.
3) 剖検
全例の新生児を哺育
4日にエーテル麻酔下で放血致死させ,剖検した.
9. 統計解析
体重,摂餌量,発情期像発現回数,性周期,同居日数,妊娠期間,血液学および血液生化学検査値,器官重量,黄体数,着床痕数,出生児数,着床率,性比,分娩率,出生率および新生児生存率については,まず
Bartlett法により各群の分散の均一性の検定を行い,分散が均一の場合は一元配置分散分析を行い,分散が有意で各群の例数が等しいときにはDunnett法,各群の例数が異なるときにはScheff 法の多重比較検定で対照群と各被験物質投与群の有意差を検定した.分散が均一でない場合は,Kruskal-Wallisの順位検定を行い,有意であれば対照群と各被験物質投与群との平均順位の差について,各群の例数が等しいときはDunnett型,各群の例数が異なるときはScheff
法の多重比較検定で対照群と各被験物質投与群の有意差を検定した.分散が均一でない場合は,Kruskal-Wallisの順位検定を行い,有意であれば対照群と各被験物質投与群との平均順位の差について,各群の例数が等しいときはDunnett型,各群の例数が異なるときはScheff 型の検定を行った.交尾率,受胎率,出産率についてはχ^2検定を行った.なお,新生児に関するデータは1腹の平均を1標本とした.また,有意水準は5および1%とした.
型の検定を行った.交尾率,受胎率,出産率についてはχ^2検定を行った.なお,新生児に関するデータは1腹の平均を1標本とした.また,有意水準は5および1%とした.
結果
1. 反復投与毒性
1) 死亡動物および一般状態
40 mg/kg群の1例が妊娠22日の分娩途中で,また,160 mg/kg群の1例が妊娠22日に死亡した.その他,雌雄とも死亡例は認められず,一般状態の変化は,いずれの例においても観察されなかった.
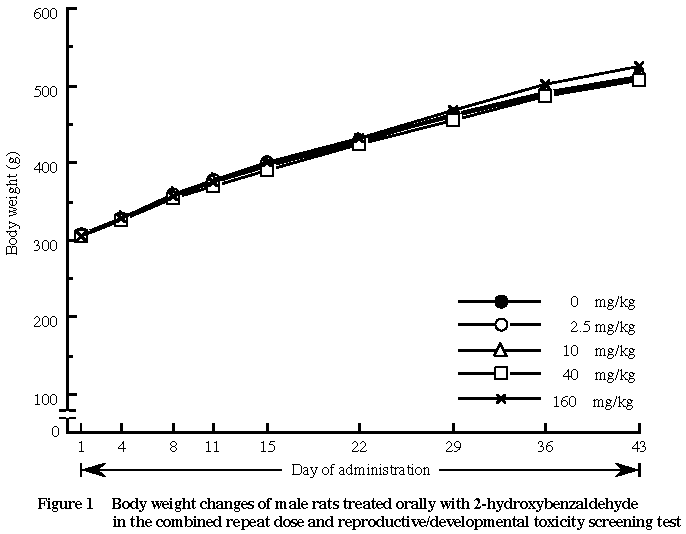
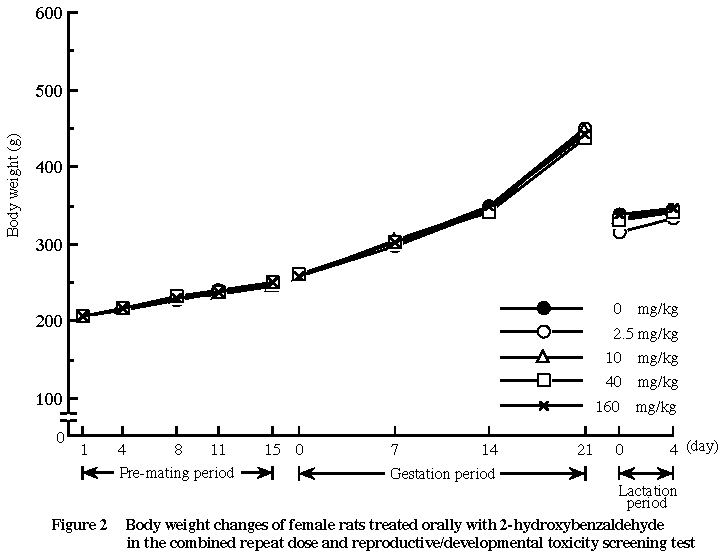
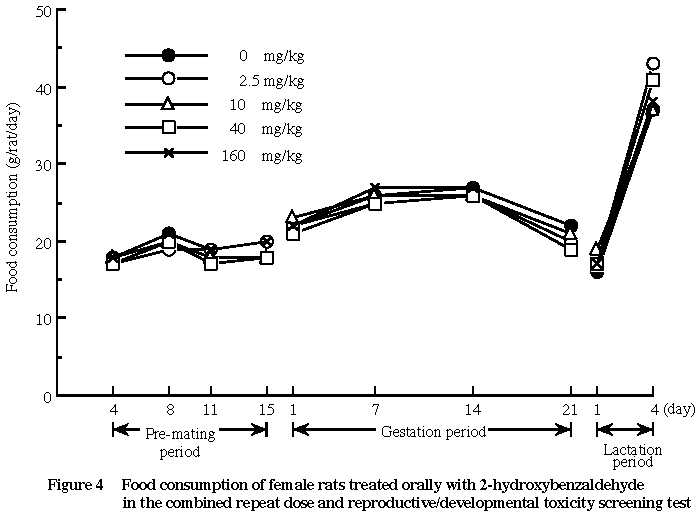
2) 体重および摂餌量(Fig. 1〜4)
各被験物質投与群の体重および摂餌量は,雌雄とも対照群とほぼ同様の推移を示し,被験物質投与による影響は認められなかった.

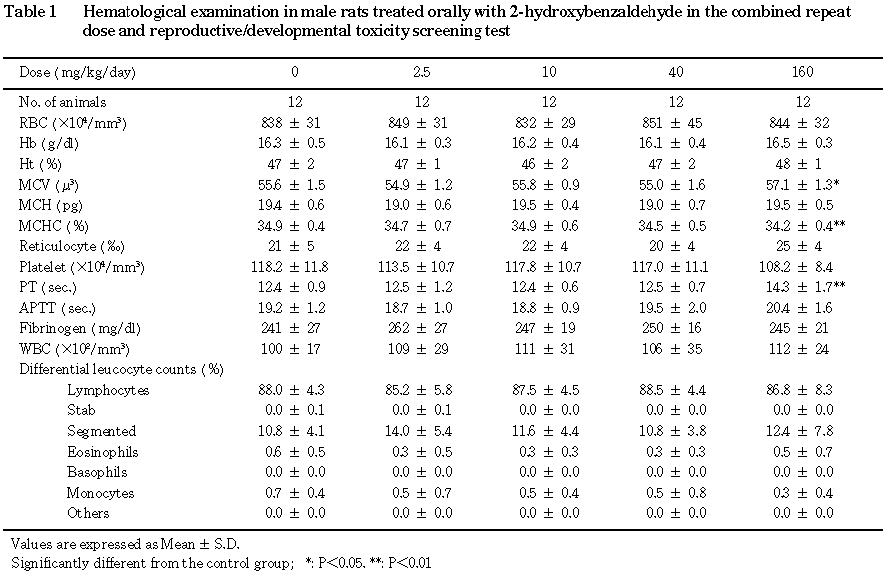
3) 雄の血液および血液生化学検査(Table 1,2)
40 mg/kg以下の被験物質投与群では血液および血液生化学検査のいずれの検査項目においても対照群との間に有意な差は認められなかった.160 mg/kg群では血液検査値において平均赤血球容積の高値,平均赤血球血色素濃度の低値,プロトロンビン時間の延長が,また,血液生化学検査では塩素の低値,A/G比およびアルブミン比率の高値,γ-グロブリン比率の低値に対照群との間に有意な差が認められた.しかし,これらのいくつかの項目はいずれも生理的変動の範囲内の値であり,血液凝固系の異常,総蛋白質の上昇,血液濃縮を疑わせる他の関連項目に変化が認められない単一項目における変化であったことから,被験物質投与の影響とは考えられなかった.

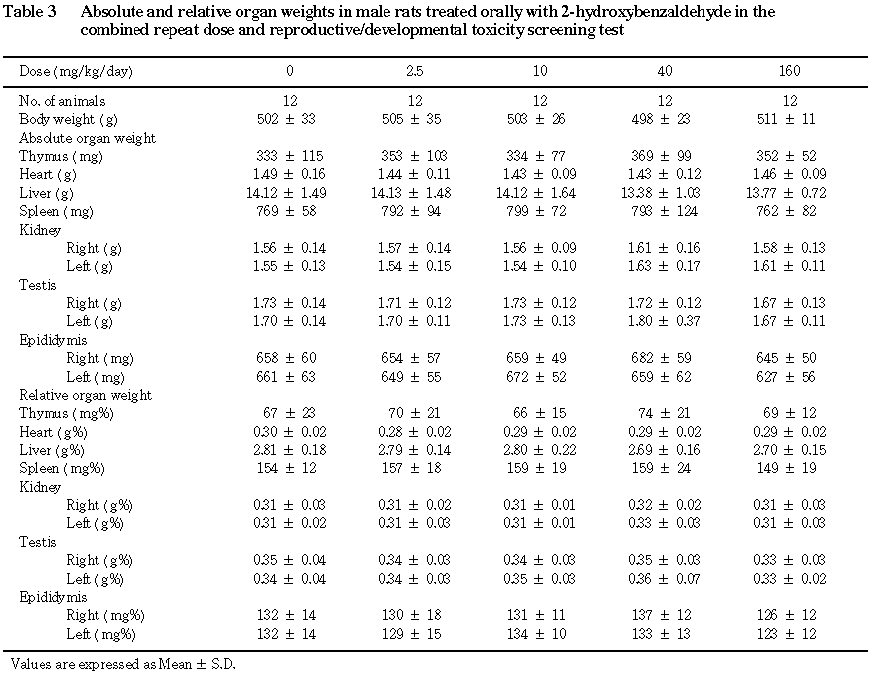
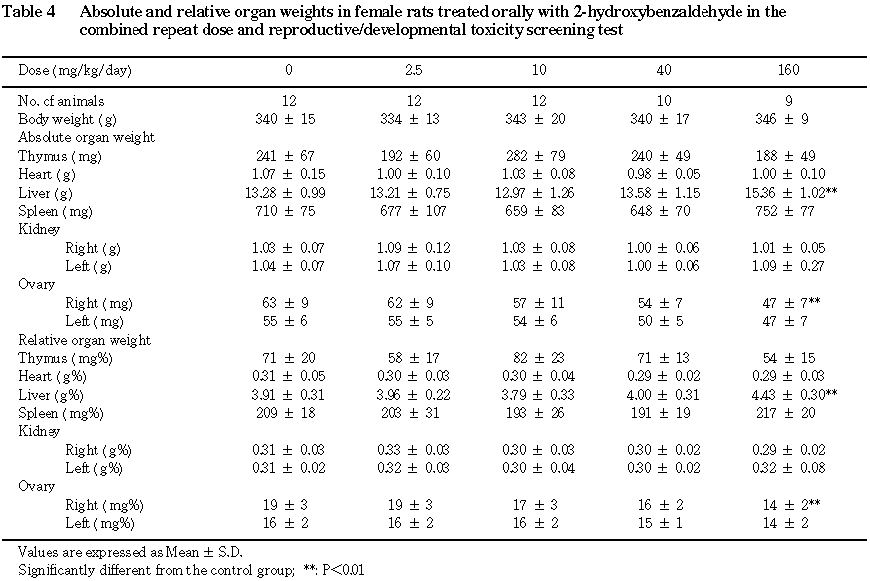
4) 器官重量(Table 3,4)
雄では絶対重量および相対重量ともに対照群と被験物質投与群との間に有意な差は認められなかった.雌では
160 mg/kg群において絶対重量および相対重量ともに肝臓が有意な高値を,右側卵巣が有意な低値を示した.
5) 剖検所見
計画解剖動物では,対照群および被験物質投与群の雌雄いずれの例においても異常所見は認められなかった.雌の死亡例の剖検では
40 mg/kg群の例において胸腺の萎縮,肝臓の一部退色および副腎の肥大が,160 mg/kg群の例では左側頸部に皮下結節,胸腺に暗赤色点散在および肺の暗赤色変化が観察された.また,全児死亡のため剖検した160 mg/kg群の例では外部所見として乳頭の未発達が観察された.
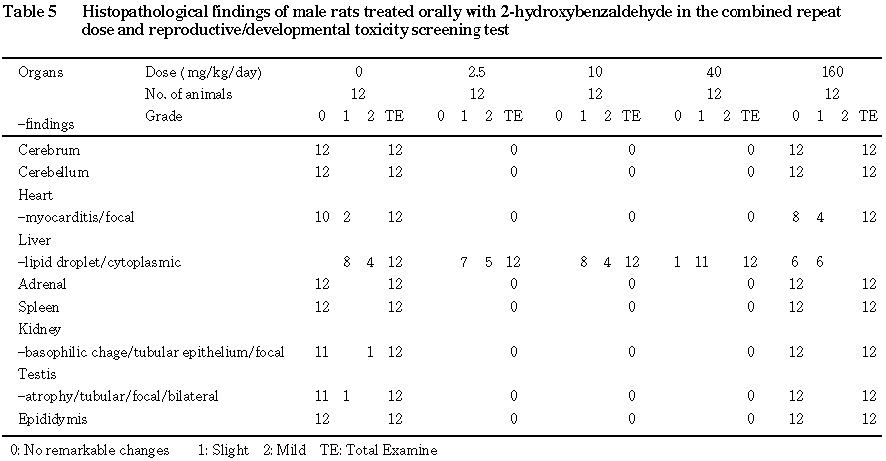
6) 病理組織学検査(Table 5,6)
雌雄とも被験物質投与に起因すると考えられる変化は肝臓で観察された.すなわち,雄では小葉周辺性脂肪化の程度および出現頻度は,
2.5および10 mg/kg群では対照群と同様であったのに反して,40 mg/kg群では減少傾向,160 mg/kg群では減少を示した.なお,小葉周辺帯肝細胞の細胞質内に空胞が認められたため対照群,40および160 mg/kg群の代表例についてオイルレッドO染色を実施し検索した結果,肝細胞細胞質内の空胞化はその程度に応じてオイルレッドO染色陽性を示したため,これらは脂肪であると判断した.雌では40および160 mg/kg群において肝細胞内に蓄積しているグリコーゲン量の軽微な増加が認められ,その頻度は40 mg/kg群では2例,160 mg/kg群では7例であった.また,40および160 mg/kg群の肝臓においてヘマトキシリン・エオジン染色標本で肝臓の細胞質が腫大淡明化し明るくぬけて観察されたことから,その性状を詳細に検討するため160 mg/kg群の代表例についてPAS反応および唾液消化後PAS反応を実施した結果,PAS反応陽性,唾液消化後PAS反応陰性であった.
その他,被験物質投与に関連した変化は雌雄ともに認められなかった.
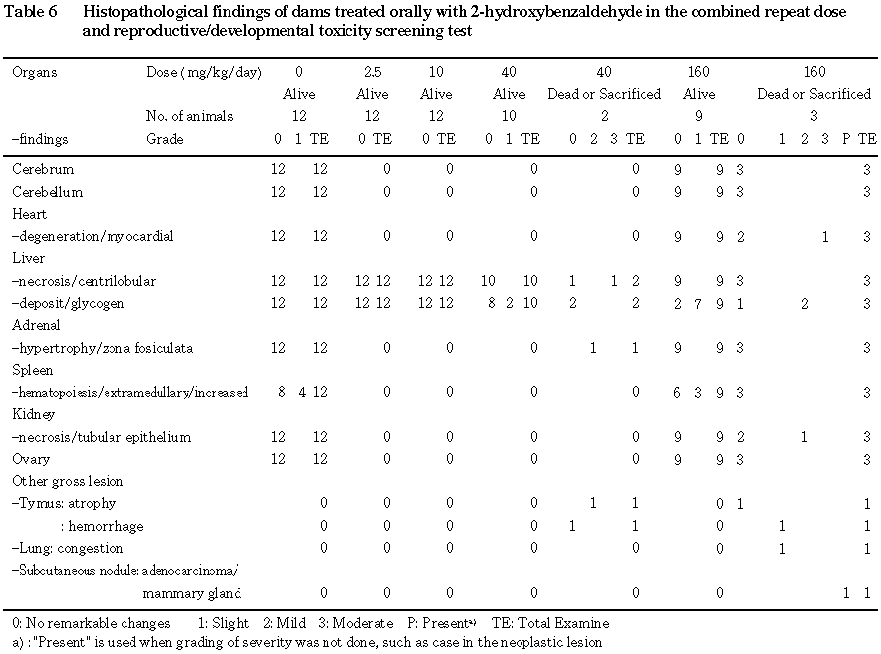
死亡例および全児死亡のため安楽死させた雌の所見として,
40 mg/kg群の死亡例では肝臓に中等度の小葉中心性壊死,副腎に軽度な束状帯肥大および胸腺に軽度な萎縮が,160 mg/kg群の死亡例では心臓に中等度の心筋変性,腎臓に軽度な尿細管上皮細胞壊死,胸腺に軽微な出血および肺に軽微なうっ血,乳癌が認められた.また,160 mg/kg群の安楽死させた2例においては肝臓に軽度なグリコーゲン量の増加が認められた.
2. 生殖発生毒性
1) 生殖機能(Table 7)
被験物質投与群における発情期から次の発情期までの日数
(性周期)は対照群とほぼ同様で有意な差は認められなかった.交尾は対照群および被験物質投与群のいずれにおいても同居開始後5日以内に成立し,各群の交尾率は100%であった.また,交尾までに要した平均日数には対照群と被験物質投与群との間に有意な差は認められなかった.非妊娠動物は対照群および被験物質投与群のいずれにも認められず,各群の受胎率は100%であった.

2) 分娩および哺育状態(Table 8)
40 mg/kg群の1例が妊娠22日の分娩途中で死亡した以外に分娩の異常は対照群および被験物質投与群のいずれにも観察されなかった.しかし,160 mg/kg群では分娩途中の死亡例は認められないことから,40 mg/kg群における死亡が分娩異常に起因したものであるとは考えられない.また,40 mg/kg群の1例では妊娠25日においても分娩が観察されなかったため,剖検したところ着床痕が観察された.妊娠期間,黄体数,着床痕数,着床率,出産率および分娩率には対照群と被験物質投与群との間に有意な差は認められなかった.
哺育状況では,
160 mg/kg群において乳頭の未発達例が2例に観察され,全ての新生児が哺育2日あるいは3日に死亡した.その他には哺育状況の異常は認められなかった.性比,出生率および新生児生存率には対照群と被験物質投与群との間に有意な差は認められなかった.なお,哺育期間中の児の死亡は,160 mg/kg群において多い傾向がみられたため,同群の哺育4日の平均生存児数が少なく,新生児生存率も低い傾向にあった.

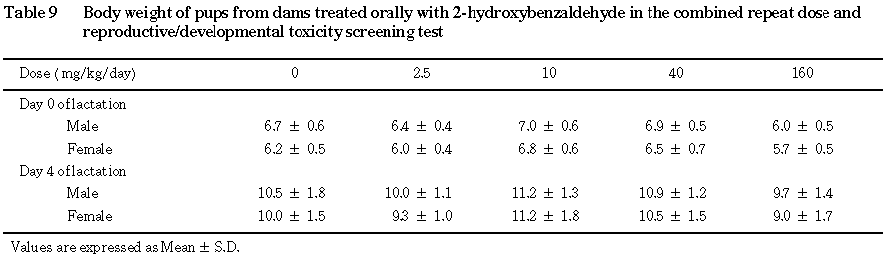
3) 新生児の形態,体重および剖検所見(Table 9)
生存児および死産児数の外表検査では,短躯および痕跡尾が対照群の死産児に1例,痕跡尾が
160 mg/kg群の生存児に1例観察されたのみであった.哺育0日および4日の体重は,160 mg/kg群において対照群に比べてわずかに低値を示す傾向にあったが,有意な差は認められなかった.40 mg/kg以下の投与群における体重は対照群とほぼ同等の値であった.哺育4日の剖検では,いずれの例においても異常は認められなかった.
考察
1. 反復投与毒性
雄では,死亡例はなく,一般状態,体重,摂餌量,血液学検査値,血液生化学検査値,剖検所見および器官重量には被験物質投与の影響は認められなかった.なお,血液学検査において
160 mg/kg群にプロトロンビン時間の延長が認められたが,血液凝固系に関連する他の項目に変化が認められない単一項目における変化であった.また,本被験物質はラットおよびマウスにおいて低カルシウム血症を起こすことが報告2)されているが,本試験では血液凝固因子の1つであるカルシウムの低下は認められなかった.これらのことから,この変化が被験物質投与による影響とは考えられない.病理組織学検査において被験物質投与に起因すると考えられる変化は肝臓で認められた.すなわち,対照群において観察される小葉周辺性脂肪化の程度およびその出現頻度が40 mg/kg以上の被験物質投与群で減少した.しかし,その機序は明らかではなかった.
雌では,
40 mg/kg群の1母体が妊娠22日の分娩途中で,160 mg/kg群の1母体が妊娠22日に死亡した.死亡例の病理組織学検査において,死亡に直接関連すると考えられる共通した所見は両者には認められなかった.その他,一般状態,体重,摂餌量および剖検所見に被験物質投与の影響は認められなかった.器官重量では160 mg/kg群において肝臓の高値,卵巣の低値が認められたが,40 mg/kg以下の被験物質投与群には対照群との間に有意な差は認められなかった.病理組織学検査において被験物質投与に起因すると考えられる変化は雄と同様に肝臓で認められたが,その変化は雄と異なっていた.すなわち,肝細胞内にグリコーゲン量の軽微な増加が40 mg/kg群の少数例,160 mg/kg群の多数例に観察された.なお,40および160 mg/kg群の肝臓においてヘマトキシリン・エオジン染色標本で肝細胞の細胞質が腫大淡明化し明るくぬけていたため,その性状をPAS反応および唾液消化後PAS反応で検索したところ,細胞内に分布するグリコーゲンを反映するものと考えられた.
以上のことから,
2-ヒドロキシベンズアルデヒドの反復投与により,160 mg/kg群において雌の肝臓重量が高値を,卵巣重量が低値を示し,病理組織学検査では雌雄に相違はあるものの40 mg/kg以上の投与群において肝臓に変化が認められた.したがって,本試験条件下における2-ヒドロキシベンズアルデヒドの一般毒性学的な無影響量は,雌雄ともに10 mg/kg/dayであると判断される.
2. 生殖発生毒性
雌の性周期,雌雄の交尾および受胎および雌の妊娠期間ならびに分娩に及ぼす被験物質投与の影響は認められなかった.哺育状況では,
160 mg/kg群において乳頭の未発達に起因すると考えられる全新生児の死亡例が2例認められた.しかし,乳頭の未発達と被験物質投与の影響との関係については明らかではなかった.40 mg/kg以下の被験物質投与群には哺育の異常は認められなかった.新生児出産雌数,出産率,黄体数,着床痕数および着床率には被験物質投与の影響は認められなかった.
新生児に関して,生存児数,死産児数,性比,分娩率および出生率には被験物質投与の影響は認められなかった.また,新生児および死産児に被験物質投与に起因する外表異常は認められなかった.哺育期間中の児の死亡は,対照群との間に有意な差は認められないものの
160 mg/kg群において多い傾向がみられ,新生児生存率が低い傾向にあった.また,哺育0日および4日の体重は160 mg/kg群においてわずかに低値を示す傾向にあった.サリチル酸あるいはアスピリンの150 mg/kgを妊娠8日〜14日までの7日間にわたって経口投与した試験では新生児の発育遅延,離乳率の低下が報告6)されている.したがって,本被験物質160 mg/kgの投与により新生児の生存および発育に及ぼす影響が示唆された.しかし,40 mg/kg以下の投与群においては新生児の生存および発育に及ぼす被験物質投与の影響は認められなかった.新生児の哺育4日の剖検では,いずれの例においても異常は認められなかった.
以上のことから,生殖発生毒性的には性周期,交尾および受胎,妊娠期間および分娩に及ぼす被験物質投与の影響はいずれの投与群においても認められなかった.しかし,
160 mg/kg群では全新生児が死亡した母動物が2例認められ,また,新生児の生存・発育に及ぼす影響が示唆された.したがって,本試験条件下における生殖発生毒性的な無影響量は,雄に関しては160 mg/kg/day,雌に関しては40 mg/kg/day,新生児に関しては40 mg/kg/dayであると判断される.
文献
| 1) | D. L. J. Opdyke, Fd Cosmet. Toxicol., 17, 903 (1979) |
| 2) | H. Saito, A. Yokoyama, S. Takeno, T. Sakai, K. Ueno, H. Masumura and H. Kitagawa, Res. Comm. Chem. Path. Pharmacol., 38, 209 (1982) |
| 3) | C. A. Kimmel, J. G. Wilson and H. J. Shumacher, Teratology, 4, 15 (1971) |
| 4) | R. P. Koshakji and A. R. Schulert, Biochem. Pharmacol., 22, 407 (1973) |
| 5) | K. S. Khera, Toxicol. Appl. Pharmacol., 37, 149 (1975) |
| 6) | S. Tanaka, K. Kawashima, S. Nakaura, S. Nagao, T. Kuwamura, A. Takanaka and Y. Omori, Cong. Anom., 13, 73 (1973) |
| 連絡先 |
| 試験責任者: | 梅村建夫 |
| 試験担当者: | 杉沢健一,石倉寿一,石井孝広,田村一利,茂呂光夫,勝亦倶慶
|
| (株)ボゾリサーチセンター 函南研究所 |
| 〒419-01 静岡県田方郡函南町桑原三本松1308 |
| Tel 0559-78-7851 | Fax 0559-78-7898 | |
| Correspondence |
| Authors: | Tatsuo Umemura(Study Director)
Kenichi Sugisawa,
Toshikazu Ishikura,
Takahiro Ishii,
Kazutoshi Tamura,
Mitsuo Moro,
Tomoyoshi Katsumata |
| Bozo Research Center Inc. Kannami Laboratory |
| 1308 Kuwahara-Sanbonmatsu, Kannami-cho, Tagata-gun, Shizuoka-ken, 419-01, Japan |
| Tel +81-559-78-7851 | Fax +81-559-78-7898 | |

 法),ナトリウム(イオン選択電極法),カリウム(イオン選択電極法),塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総蛋白質(Biuret法)を全自動分析装置(Monarch:Instrumentation Laboratory)を用いて測定した.また,全自動電気泳動装置 CLINISCAN2(株式会社ヘレナ研究所)を用いて蛋白質分画(セルロースアセテート膜による電気泳動法)を測定し,蛋白質分画比率からA/G比を算出した.
法),ナトリウム(イオン選択電極法),カリウム(イオン選択電極法),塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総蛋白質(Biuret法)を全自動分析装置(Monarch:Instrumentation Laboratory)を用いて測定した.また,全自動電気泳動装置 CLINISCAN2(株式会社ヘレナ研究所)を用いて蛋白質分画(セルロースアセテート膜による電気泳動法)を測定し,蛋白質分画比率からA/G比を算出した.
 法の多重比較検定で対照群と各被験物質投与群の有意差を検定した.分散が均一でない場合は,Kruskal-Wallisの順位検定を行い,有意であれば対照群と各被験物質投与群との平均順位の差について,各群の例数が等しいときはDunnett型,各群の例数が異なるときはScheff
法の多重比較検定で対照群と各被験物質投与群の有意差を検定した.分散が均一でない場合は,Kruskal-Wallisの順位検定を行い,有意であれば対照群と各被験物質投与群との平均順位の差について,各群の例数が等しいときはDunnett型,各群の例数が異なるときはScheff 型の検定を行った.交尾率,受胎率,出産率についてはχ^2検定を行った.なお,新生児に関するデータは1腹の平均を1標本とした.また,有意水準は5および1%とした.
型の検定を行った.交尾率,受胎率,出産率についてはχ^2検定を行った.なお,新生児に関するデータは1腹の平均を1標本とした.また,有意水準は5および1%とした.












