チモールのマウスを用いる小核試験
Micronucleus Test of Thymol on Mice
要約
OECD既存化学物質安全性点検に係る毒性調査事業の一環として,チモールの生体内における細胞遺伝学的影響を評価するために,Crj:BDF1雄および雌マウスを用い,強制経口投与による小核試験を,毒性予備試験および小核予備試験を行い,投与量および標本作製時期を設定した後,小核本試験を実施し,陰性の結果を得た.
毒性予備試験を行った結果,雄および雌マウスにおける最大耐量は,それぞれ
2000 mg/kgおよび1250 mg/kg であった.小核予備試験において,2000,1750および 1500 mg/kgを雄マウスに投与したところ,いずれの場合にも,死亡例が観察されたため,1250 mg/kgを雄および雌マウスに投与し,投与後24,48および72時間に骨髄の塗抹標本を作製した.小核出現頻度は,24時間群と他の群との間に明瞭な差は認められなかった.また,赤血球中に占める幼若赤血球の比率を指標とした骨髄細胞の増殖抑制も,認められなかった.これらの結果から,雄雌ともに小核本試験でのチモールの最高用量を1250 mg/kgとし,標本作製時期を投与後24時間に決定した.
チモールの
312.5,625および1250 mg/kgを雄および雌マウスにそれぞれ投与し,投与後24時間目に標本を作製した.小核出現頻度はいずれの投与群においても,溶媒対照群と比較して統計学的に有意な増加は認められず,用量依存性も認められなかった.また,全赤血球中に占める幼若赤血球の比率は,いずれの投与群においても,溶媒対照群との間に有意差は認められず,被験物質が標的細胞を充分暴露した証拠は得られなかった.しかし,高用量に近い用量で致死となっていることから,充分評価に耐える試験結果であると考えられる.
以上の結果から,チモールは,本試験条件下で
Crj:BDF1雄および雌マウスの骨髄細胞において,小核誘発作用を示さないと結論した.
方法
1.実験動物および飼育条件
実験には,日本チャールス・リバー
(株)(CRJ)から購入した8週齢のCrj:BDF1(C57BL/6とDBA/2の近交系間F1)雄および雌マウスを,1週間以上予備飼育した後,異常の認められなかった動物を9週齢で試験に供した.
動物は,床敷としてホワイト・フレーク
(R)(CRJ)を入れたTPX樹脂製ケージ(CRJ)に1匹ずつ収容し,バリアーシステムの飼育室(設定温度:23±1℃,設定湿度:55±5%,換気回数:約15回/時間,明暗サイクル:午前7時点灯,午後7時消灯)で,マウス繁殖用固型飼料(NMF)と水道水を自由に摂取させて飼育した.動物の群分けは自由群分け(無作為抽出)により行った.
2. 被験物質
チモール
(CAS. No. 89-83-8,ロット番号:CAN1119,和光純薬(株)製造)は,白色結晶で,融点51.5℃,沸点 233.5℃,分子式C10H14O,分子量150.22,純度98%以 上(不純物として,不揮発物0.05%以下,他のフェノール類を限度内含む)の物質である.被験物質は,室温に保存した.
3. 検体の調製と投与方法
検体の投与容量はマウス体重
kg当り10 mlとした.投与検体は所要量を正確に採取し,局方オリブ油に懸濁して最高用量の原液を調製した.それ以下の用量については,最高用量の調製液を上記の溶媒で希釈して所定の濃度に調製した.また,投与検体はすべて用時調製とし,単回強制経口投与した.
試験に先立ち,
156.3 mg/kg群および1250 mg/kgの投与検体について室温遮光条件下でチモールの局方オリブ油中での安定性を調べた.その結果,調製4時間後における各濃度の平均含量は,それぞれ初期値(0時間)の平均値に対して,103および96.6 %であった。また,同検体について,含量測定試験を行った.その結果,156.3 mg/kg群および1250 mg/kgの投与検体について,含量はそれぞれ99.1および105%であった.
また,陽性対照物質,サイクロフォスファミド
(CPA, Sigma Chemical Co.)は,局方生理食塩液に溶解して所定の濃度に調製し,50 mg/kgを単回強制経口投与した.
4. 標本の作製
小核の観察のための骨髄標本は,
Schmidの方法1, 2)に従って作製した.すなわち,投与後所定の時間に頚椎脱臼法によりマウスを致死させて左右の大腿骨を摘出した.その両骨端を切断して,骨髄細胞を0.6 mlのウシ胎児血清(Hazleton)で洗い出し,遠沈管に集め,1000 rpm で5分間遠心分離して,上清を除いた.沈渣をピペッティング後,細胞浮遊液の一部をスライドグラス上に塗抹(各個体につき3枚の標本)し,それぞれの骨髄標本に試験系識別番号および暗番号を記し,室温で一晩自然乾燥させた.乾燥した骨髄標本は5分間メタノールで固定し,標本観察時まで室温保存した.
5. 骨髄標本のアクリジンオレンジ(A.O.)蛍光染色および小核試験の観察
骨髄標本のアクリジンオレンジ
(A.O.)螢光染色および小核の観察は,林らの方法3, 4)に従って行った.0.04 mg/mlのA.O.溶液を上記のメタノールで固定済の骨髄標本上に数滴滴下し,カバーグラスをかけ,カバーグラス上から濾紙で余分な溶液を十分吸い取り,螢光顕微鏡下で観察した.
骨髄標本はそれぞれの個体について,
2名の観察者によりブラインド法で観察した.1個体あたり2000個の幼若赤血球(polychromatic erythrocytes)を観察し,その中の小核を有するものの数を記録した.また赤血球を1個体あたり500個観察し,その中の幼若赤血球の比率を調べて,骨髄細胞の増殖抑制の指標とした.
6. 有意差検定
それぞれの小核出現頻度について,
Fisherの正確確率検定法5)により,溶媒対照群と,各検体投与群および陽性対照群との間で5%水準で有意差検定を行った.検定にあたっては,多重性を考慮して,Bonferroniの補正6)を行った.更に,小核出現頻度の用量(対数値)依存性についてCochran-Armitageの傾向検定7)を5%水準で行った.また,赤血球中に占める幼若赤血球の比率について,それぞれ溶媒対照群と,各検体投与群および陽性対照群との間で,t検定を行った.検定にあたっては,多重性を考慮して,Bonferroniの補正を行った.
7. 毒性予備試験(投与用量の決定)
小核試験に用いるチモールの投与量を決定するために,雄雌ともに各群
5匹からなる7群を設け,投与量をそれぞれ,500, 750, 1000, 1250, 1500, 1750および2000 mg/kgとした.投与当日を0日として4日間にわたり毎日一般状態を観察し、死亡の有無を調べた.
その結果、投与直後,すべての投与群において自発運動の低下が認められ,用量の増加とともに,よろめき歩行,腹臥、呼吸促迫などの毒性徴候が現れた.死亡例は,雄では認められず,雌では
1500および1750 mg/kg群で各2匹確認された.したがって,チモールの強制経口投与によるCrj:BDF1雄および雌マウスの最大耐量は,雄では2000 mg/kg,雌では1250 mg/kgであると判断し,それぞれを小核予備試験に用いる投与用量とした.
8. 小核予備試験(標本作製時期の決定)
雄マウスに,チモールの
2000 mg/kgを投与したところ,15匹中7匹の死亡例が観察された.そこで雄マウスについて,さらに用量を下げて小核予備試験を実施したところ,1750mg/kg群で15匹中2匹,1500 mg/kg群で15匹中1匹の死亡が認められた.したがって小核予備試験において,雄,雌ともに同用量の1250 mg/kgを用いることとなったため,標本観察は雄マウスについてのみ行うこととした.雄マウス各5匹ずつからなる3群(24時間群,48時間群および72時間群)を設けた.
9. 小核本試験
小核予備試験において,雄雌いずれの投与群においても,小核の誘発および骨髄増殖抑制が観察されなかったので,小核本試験に用いる高用量を雄雌ともに
1250 mg/kgとし,これをもとに公比2で減じ,中用量を 625 mg/kg,低用量を312.5 mg/kgとした.また,高用量で,死亡が認められた場合にそなえて,低用量の1/2量の 156.3 mg/kg群も用意し,溶媒対照群,陽性対照群を含めて雄雌それぞれ計6群を設定した,各群5匹の動物を無作為に割り当てた.標本作製時期は小核予備試験の結果に基づき,雄雌ともに投与後24時間とした。
結果および考察
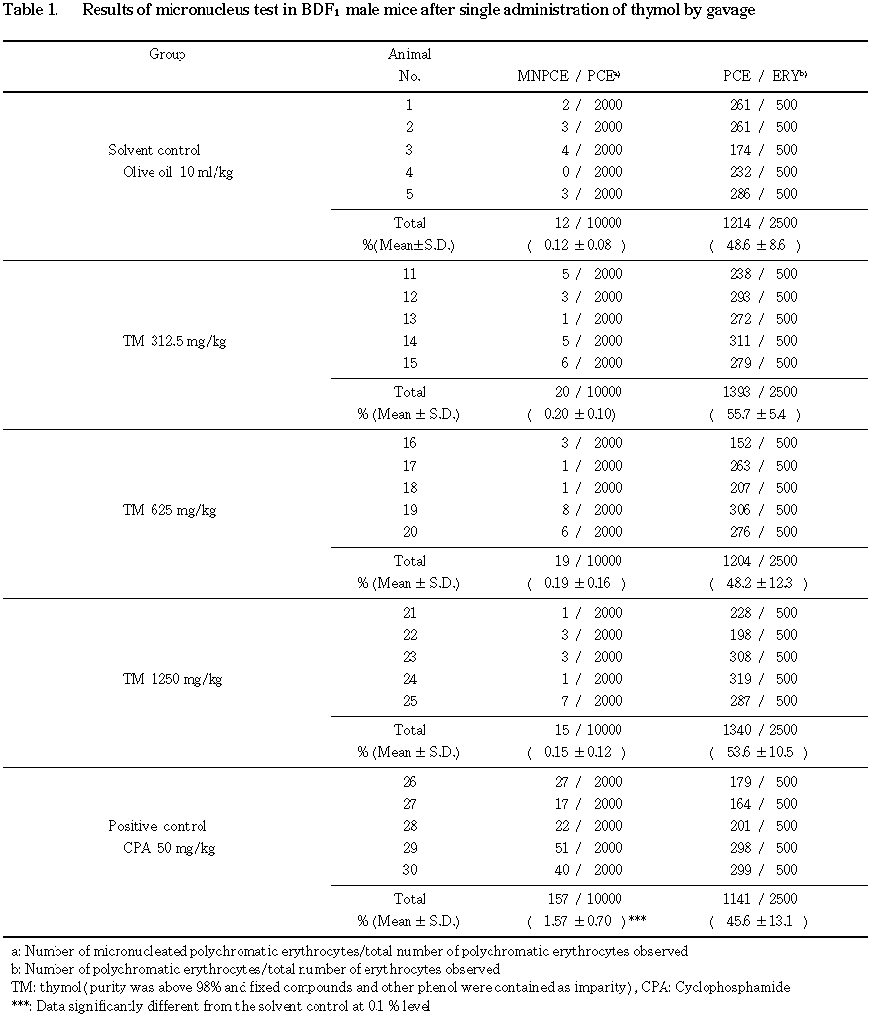
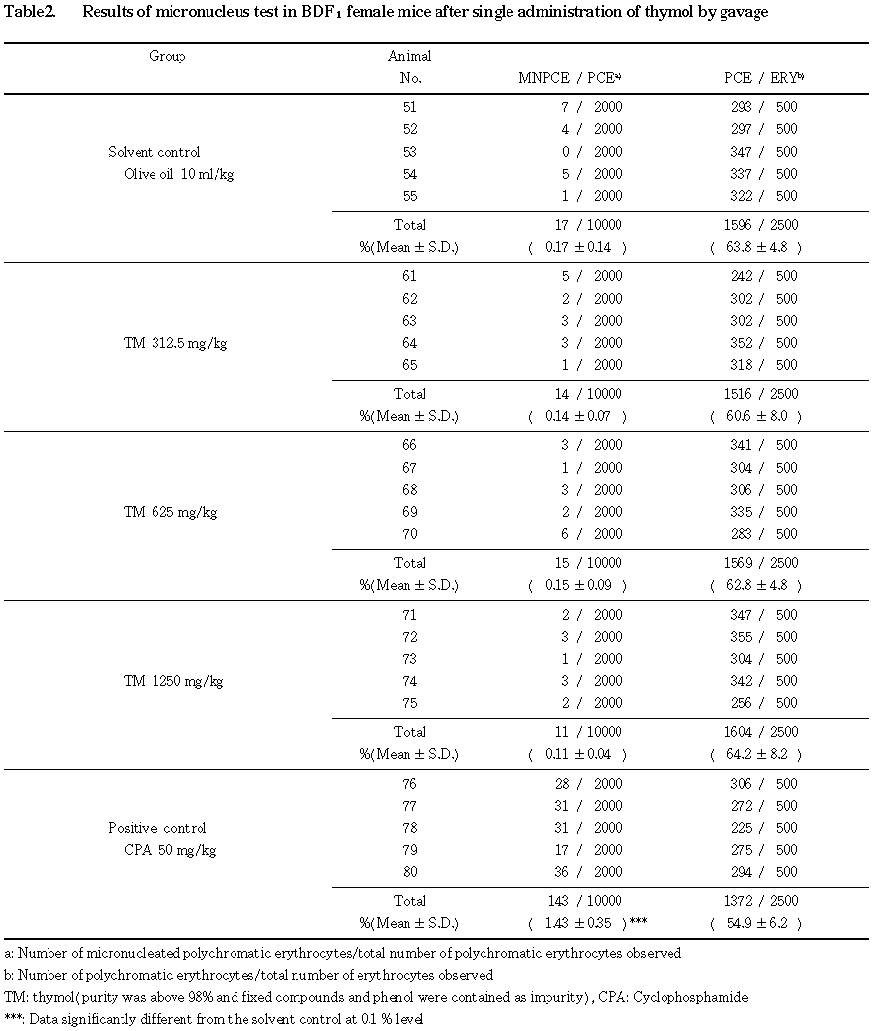
雄および雌の小核本試験の結果をそれぞれ
Table 1および2に示す.雄雌ともに溶媒対照群と陽性対照群の小核出現頻度は,それぞれの過去5年間の背景データのばらつきの範囲内(平均値±3×標準偏差)であった.Fisherの正確確率検定法(Bonferroniの補正)による有意差検定の結果,小核出現頻度はチモールのいずれの投与群においても,溶媒対照群と比較して統計学的に有意な増加は認められなかった.さらに,Cochran-Armitageの傾向検定の結果においても,用量に依存した有意な増加傾向は認められなかった.一方,CPAを50 mg/kg投与した陽性対照群での小核出現頻度は,5%水準で有意な増加がみられた.また,全赤血球中に占める幼若赤血球の比率は,いずれの投与群においても,溶媒対照群との間に有意差は認められず,被験物質が標的細胞を充分暴露した証拠は得られなかった.しかし,高用量に近い用量で致死となっていることから,充分評価に耐える試験結果であると考えられる.
以上の結果から,チモールは,本試験条件下で
Crj:BDF1雄および雌マウスの骨髄細胞において,小核誘発作用を示さないと結論した.
文献
| 1) | W. Schmid, Mutat. Res., 31, 9, (1975). |
| 2) | W. Schmid, "Chemical Mutagens," Vol. 4. ed. by A. Hollender, Plenum Press, New York, London, 1976, pp. 76-78. |
| 3) | M. Hayashi, T. Sofuni, M. Ishidate, Jr., Mutat. Res., 120, 241, (1983) |
| 4) | 林 真, "小核試験," サイエンティスト社,東京, 1991,pp. 44-55. |
| 5) | 吉村 功 編, "毒性・薬効データの統計解析,” サイエンティスト社,東京,1987,pp. 76-78. |
| 6) | 吉村 功,大橋靖雄 責任編集,"毒性試験講座14,毒性試験データの統計解析," 地人書館,東京,1992,pp.18-222. |
| 7) | 吉村 功 編,"毒性・薬効データの統計解析," サイエンティスト社,東京,1987,pp. 67-69. |
| 連絡先 |
| 試験責任者: | 澁谷 徹 |
| 試験担当者: | 堀谷尚古,加藤恵基,原 巧,関野早苗,松木容彦,飯田さやか,中込まどか |
| | | |
| Correspondence |
| Authors: | Tohru Shibuya(Study Director)
Naoko Horiya,
Motoe Katoh,
Takumi Hara,
Sanae Sekino,
Yasuhiko Matsuki,
Sayaka Iida,
Madoka Nakagomi |
| Hatano Research Institute, Food and Drug Safety Center |
| 729-5 Ochiai, Hadano-shi, Kanagawa 257 Japan |
| Tel:+81-463-82-4751 | Fax:+81-463-82-9627 | |


