
試験は,指標菌株としてSalmonella typhimurium TA100,TA1535,TA98,TA1537およびEsherichia coli WP2 uvrAを用い,S9 mix非存在(直接法)および存在(代謝活性化法)下でプレインキュベーション法により行った.
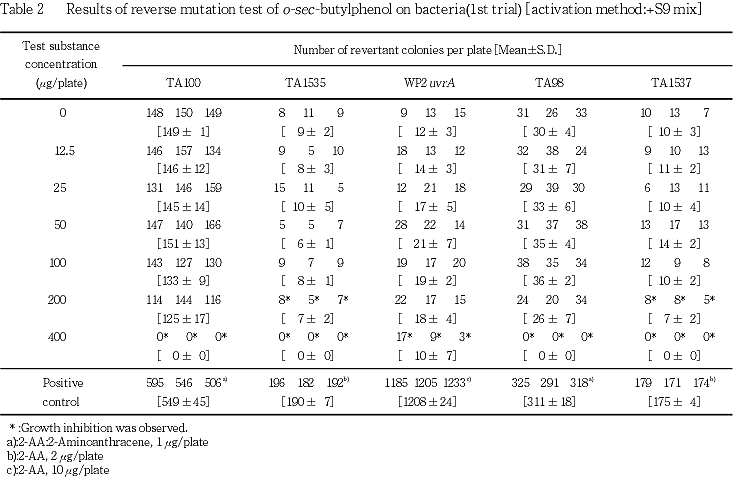
20〜5000 μg/plateの範囲で行った濃度設定試験では,代謝活性化の有無にかかわらず,いずれの菌株においても200 μg/plate以上の濃度で生育阻害が認められたが,200 μg/plateにおける直接法でのWP2 uvrA並びに代謝活性化法でのTA98,TA100およびWP2 uvrAの生育阻害は軽度であった.したがって,本試験は,全菌株とも400 μg/plateを最高濃度とし,以下公比2で計6濃度を設定して行った.
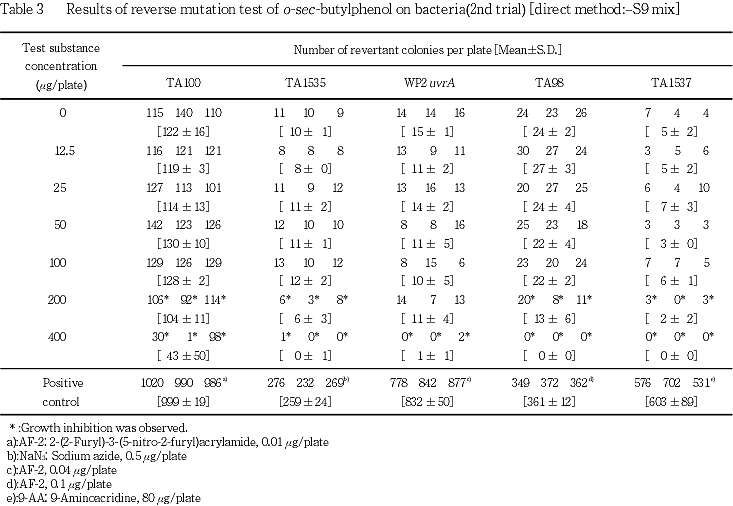
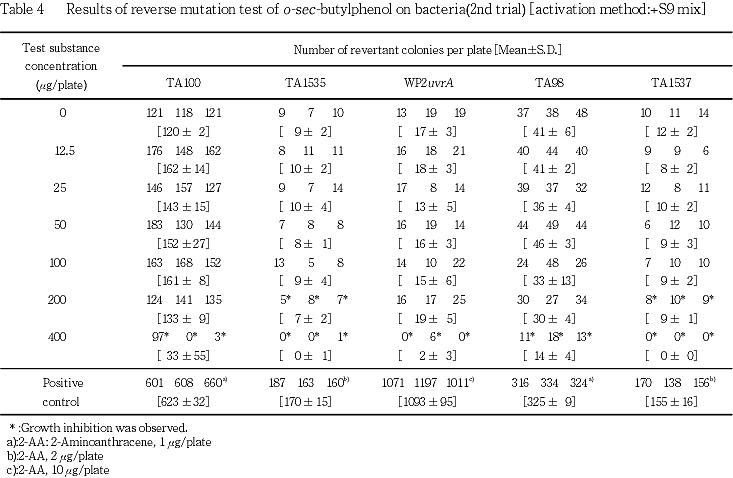
試験を2回行った結果,代謝活性化の有無にかかわらず,全ての菌株において復帰変異コロニー数の明らかな増加は認められなかった.菌の生育阻害については,TA1535およびTA1537では,代謝活性化の有無にかかわらず200 μg/plate以上で認められ,TA98およびTA100では,直接法の場合は200 μg/plate以上,代謝活性化法の場合は400 μg/plateで認められた.また,WP2 uvrAでは直接法および代謝活性化法ともに400 μg/plateで生育阻害が認められた.
以上の成績から,o-sec-ブチルフェノールの細菌に対する遺伝子突然変異誘発性は陰性と判定した.
試験に際して,各凍結菌株を解凍後,その30 μLをニュートリエントブロス(Bacto nutrient broth dehydrated, Difco Laboratories)液体培地15 mLに接種し,37℃で12時間振盪培養した.培養後の懸濁菌液は濁度を測定し,濁度と生菌数の換算式より1 mLあたり1×10^9以上の生菌数が得られていることを確認し,試験菌液とした.
各菌株の遺伝的特性検査は,凍結保存菌の調製時並びに各実験ごとに行い,本試験に用いた菌株が規定の特性を保持していることを確認した.
実験終了後,被験物質提供元において残余被験物質を分析した結果,安定性に問題はなかった.
| AF-2 | : | 2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド(和光純薬工業(株)) |
| 2-AA | : | 2-アミノアントラセン(和光純薬工業(株)) |
| NaN3 | : | アジ化ナトリウム(和光純薬工業(株)) |
| 9-AA | : | 9-アミノアクリジン(Aldrich Chemical Co.) |
| 硫酸マグネシウム・七水塩 | 0.2 g |
| クエン酸・一水塩 | 2 g |
| リン酸水素二カリウム | 10 g |
| リン酸一アンモニウム | 1.92 g |
| 水酸化ナトリウム | 0.66 g |
| グルコース | 20 g |
| 寒天(OXOID Agar No.1) | 15 g |
試験管に使用溶媒0.1 mL,被験物質供試液0.1 mLあるいは陽性対照物質溶液0.1 mLを入れ,次いで直接法では0.1 Mリン酸ナトリウム緩衝液(pH 7.4)を0.5 mL,代謝活性化法ではS9 mixを0.5 mL加え,続いて試験菌液0.1 mLを分注し,37℃で20分間振盪培養した.培養終了後,45℃に保温したトップアガー2 mLを加えた混合液をプレート上に重層した.37℃で48時間培養後,復帰変異コロニーを計数し,同時に指標菌株の生育阻害の有無を実体顕微鏡を用いて観察した.プレートは,濃度設定試験では各濃度とも1枚,本試験では3枚を使用した.本試験は,同一濃度を用いて2回行った.
| 1) | 被験物質処理群において溶媒対照値の2倍以上の復帰変異コロニー数が出現する. |
| 2) | 被験物質濃度の増加とともに復帰変異コロニー数が増加する(濃度依存性). |
| 3) | 2回にわたる本試験の結果から,復帰変異コロニー数の増加に再現性が認められる. |
試験を2回行った結果(Tables 1〜4),直接法および代謝活性化法のいずれの場合も,供試した全ての菌株における復帰変異コロニー数は,溶媒対照値の2倍を越えるものではなかった.菌の生育阻害については,TA1535およびTA1537では,代謝活性化の有無にかかわらず 200 μg/plate以上で認められ,TA98およびTA100では,直接法の場合は200 μg/plate以上,代謝活性化法の場合は400 μg/plateで認められた.また,WP2 uvrAでは直接法および代謝活性化法ともに400 μg/plateで生育阻害が認められた.
以上の成績から,本実験条件下では,o-sec-ブチルフェノールの遺伝子突然変異誘発性は陰性と判定した.
o-sec-ブチルフェノールの変異原性については,すでにTA98,TA100,TA1535およびTA1537を用いた復帰変異試験で陰性3)との報告があり,WP2 uvrAを加えた今回の試験においても陰性結果が確認された.o-sec-ブチルフェノールの類縁化合物であるρ-sec-ブチルフェノール4),ρ-tert-ブチルフェノール5, 6)および2,6-ジ-tert-ブチルフェノール6)は,いずれもS. typhimuriumおよびE. coliを,また,2,4,6-トリ-tert-ブチルフェノール7)は,S. typhimuriumを用いた復帰変異試験で陰性と報告され,ρ-tert-ブチルフェノール6)および2,6-ジ-tert-ブチルフェノール6)においては,酵母を用いた遺伝子突然変異試験でも陰性と報告されている.これら類縁化合物の試験結果も考え合せるとo-sec-ブチルフェノールのin vitroにおける遺伝子突然変異誘発性は低いものと判断される.

| 1) | D. M. Maron, B. N. Ames, Mutat. Res., 113, 173(1983). |
| 2) | M. H. L. Green, "Handbook of Mutagenicity Test Procedures," 1, Vol.3, eds. by B. J. Kilbey, M. Legator, W. Nichols, C. Ramel, Elsevier, Amsterdam, New York, Oxford, 1984, pp. 161-187. |
| 3) | K. Mortelmans, S. Haworth, T. Lawlor, W. Speck, B. Tainer, E. Zeiger, Environ. Mutagen., 8(suppl.7), 1(1986). |
| 4) | 厚生省生活衛生局企画課生活化学安全対策室監修,"化学物質毒性試験報告,"Vol. 2,化学物質点検推進連絡協議会,東京,1995, p. 343. |
| 5) | 厚生省生活衛生局企画課生活化学安全対策室監修,"化学物質毒性試験報告,"Vol. 4,化学物質点検推進連絡協議会,東京,1996, p. 295. |
| 6) | B. J. Dean, T. M. Brooks, G. Hodson-Walker, D. H. Hutson, Mutat. Res., 153, 57(1985). |
| 7) | 石館 基 監修,"微生物を用いる変異原性試験データ集,"エル・アイ・シー,東京,1991, pp. 560-561. |
| 連絡先 | |||
| 試験責任者: | 野田 篤 | ||
| 試験担当者: | 野田 篤,昆 尚美 | ||
| (財)畜産生物科学安全研究所 | |||
| 〒229-1132 神奈川県相模原市橋本台3-7-11 | |||
| Tel 042-762-2775 | Fax 042-762-7979 | ||
| Correspondence | ||||
| Authors: | Atsushi Noda (Study director) Naomi Kon | |||
| Research Institute for Animal Science in Biochemistry and Toxicology | ||||
| 3-7-11 Hashimotodai, Sagamihara-shi, kanagawa, 229-1132, Japan | ||||
| Tel +81-42-762-2775 | Fax +81-42-762-7979 | |||