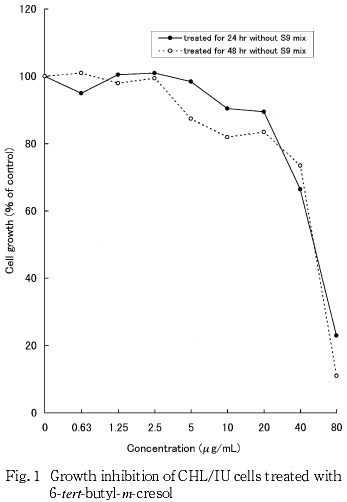
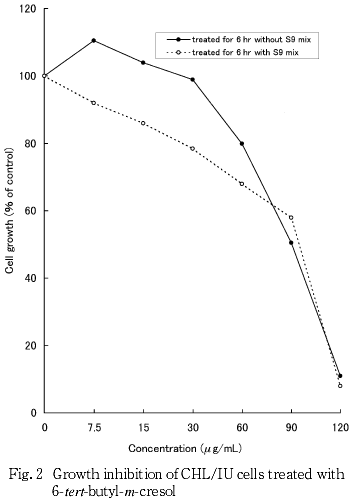
染色体異常試験に用いる濃度を決定するため,細胞増殖抑制試験を行った結果,連続処理法の場合は,24時間および48時間処理ともに80 μg/mL,短時間処理法の場合は,S9 mix非存在および存在下ともに120 μg/mLの濃度で,いずれも50 %を上回る細胞増殖抑制が認められた.したがって,染色体異常試験における濃度は,連続処理法の場合,10,20,40,60および80 μg/mL,短時間処理法の場合,7.5,15,30,60,90および120 μg/mLとした.
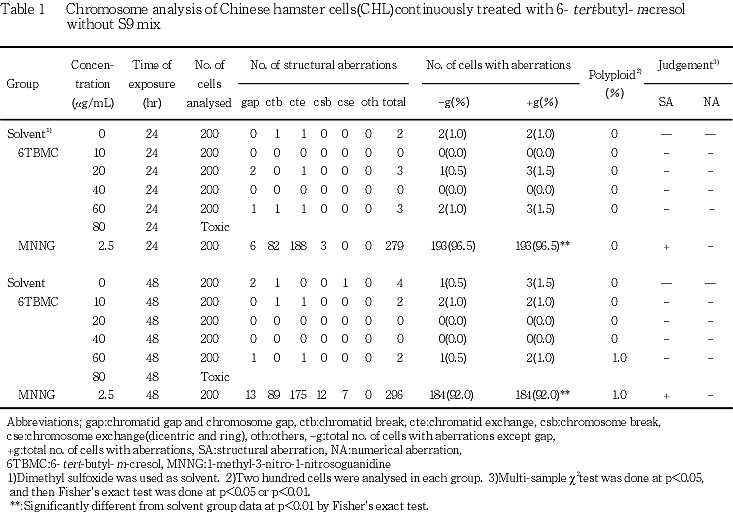
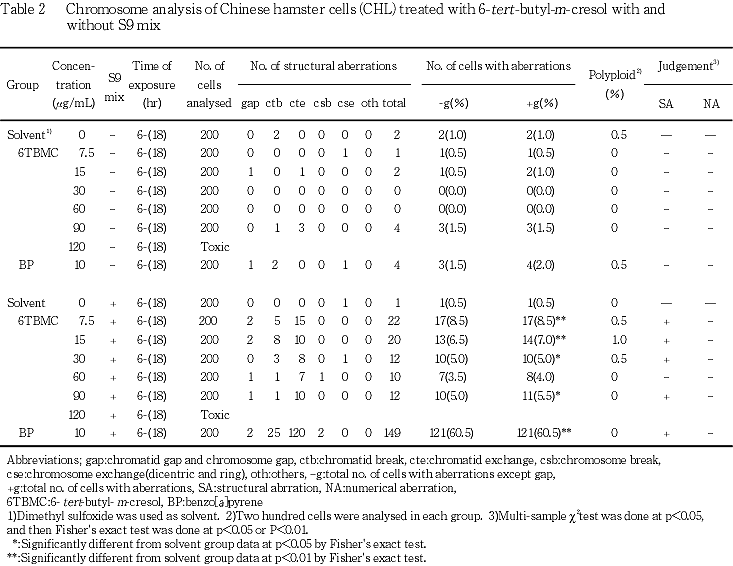
試験の結果,連続処理法においては,染色体異常を有する細胞の増加は認められなかった.短時間処理法においては,S9 mix非存在下では染色体異常を有する細胞の増加は認められなかった.一方,S9 mix存在下では60 μg/mLを除く7.5 μg/mL以上の濃度で染色体構造異常細胞の有意な増加(出現頻度8.5,7.0,5.0および5.5 %)が認められたが,濃度依存的な増加ではなかった.連続処理法および短時間処理法ともに最高濃度の80および120 μg/mLでは,細胞に対する毒性のため観察可能な分裂中期像は認められなかった.
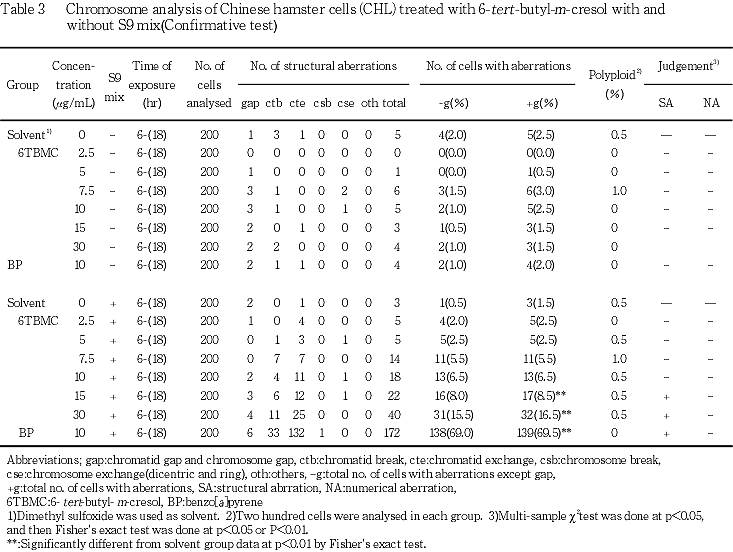
そこで,短時間処理法において,2.5,5,7.5,10,15および30 μg/mL濃度を設定し,確認試験を行った.その結果,S9 mix非存在下では染色体異常細胞の増加は認められなかったが,S9 mix存在下では濃度依存的な染色体構造異常細胞の増加が認められ,15および30 μg/mLでの増加(出現頻度8.5および16.0 %)は,統計学的に有意なものであった.
以上の成績から,6-tert-ブチル-m-クレゾールは,CHL/IU細胞に対し染色体異常を誘発する(陽性)と結論した.
連続処理法では,培養開始3日後に被験物質を加え,24時間および48時間処理した.また,短時間処理法では,培養開始3日後にS9 mix非存在および存在下で6時間処理し,処理終了後,新鮮培養液でさらに18時間培養した.
実験終了後,被験物質提供元において残余被験物質を分析した結果,安定性に問題はなかった.
その結果(Fig. 1, 2),連続処理法の場合は,24時間および48時間処理ともに80 μg/mLで50 %を上回る細胞増殖抑制が認められ,50 %細胞増殖抑制濃度は40〜80 μg/mL間にあるものと判断された.短時間処理法の場合は,S9 mix非存在および存在下ともに120 μg/mLで50 %を上回る細胞増殖抑制が認められ,S9 mix非存在下では90 μg/mLでほぼ50 %細胞増殖抑制を示し,S9 mix存在下では90〜120 μg/mL間に50 %細胞増殖抑制濃度があるものと判断された.

陽性対照として,連続処理法では1-methyl-3-nitro-1-nitrosoguanidine(MNNG, Aldrich Chemical Co.)を2.5 μg/mL,短時間処理法では3,4-benzo[a]pyrene(B[a]P, Sigma Chemical Co.)を10 μg/mLの濃度で用いた.陽性対照物質の溶媒には,いずれもDMSO(和光純薬工業(株))を使用した.
ギャップを含めた染色体構造異常細胞および倍数性細胞の出現頻度について,多試料χ^2検定を行い有意差(有意水準5 %以下)が認められた場合は,フィッシャーの直接確率法を用いて溶媒対照群と各濃度群との間の有意差検定(有意水準は多重性を考慮して,5 %または1 %を処理群の数で割ったものを用いた.)を行った.
その結果,溶媒対照群と比較して,被験物質による染色体異常細胞の出現頻度が2濃度以上で有意に増加し,かつ濃度依存性あるいは再現性が認められた場合,陽性と判定した.
短時間処理法による結果をTable 2に示した.S9 mix非存在下では,染色体の構造異常および倍数性細胞の誘発作用は認められなかった.一方,S9 mix存在下においては,60 μg/mLを除く7.5 μg/mL以上の濃度で染色体構造異常細胞の有意な増加(出現頻度8.5,7.0,5.0および5.5 %)が認められたが,濃度依存的な増加ではなかった.S9 mix非存在および存在下ともに,倍数性細胞の誘発作用は認められなかった.
なお,連続処理法および短時間処理法ともに最高濃度の80および120 μg/mLでは,被験物質の細胞に対する毒性のため,観察可能な分裂中期像が認められなかった.
そこで,短時間処理法において,2.5,5,7.5,10,15および30 μg/mL濃度を設定し,確認試験を行った.その結果,S9 mix非存在下では染色体異常細胞の増加は認められなかったが,S9 mix存在下では濃度依存的な染色体の構造異常の増加が認められ,15 μg/mL以上での増加(出現頻度8.5および16.0 %)は,統計学的に有意なものであった.
以上の成績から,6-tert-ブチル-m-クレゾールは,その代謝物に染色体構造異常を誘発する作用があると 考えられた.したがって,本実験条件下では,6-tert-ブチル-m-クレゾールのCHL/IU細胞に対する染色体異常誘発性は陽性と判定した.陽性結果が得られたため,D20値2) (分裂中期像の20 %に異常を誘発させる被験物質の推定濃度)を,明らかな濃度依存性が認められた確認試験の結果に基づいて算出したところ,本被験物質のD20値は,短時間処理法において0.038 mg/mLであった.本試験結果は,CHL/IU細胞において,染色体異常を有する細胞の出現頻度が5 %以上10 %未満を疑陽性,10 %以上を陽性とする石館らの判定基準3)からみても,陽性と判断されるものであった.
6-tert-ブチル-m-クレゾールの類縁化合物については,4-tert-ブチルフェノールでは,CHL/IU細胞を用いた染色体異常試験において連続処理法24時間および48時間処理で倍数性細胞の誘発作用が,また,短時間処理法S9 mix存在下では構造異常および倍数性細胞の誘発作用が報告されている4).また,2-sec-ブチルフェノールでもCHL/IU細胞を用いた染色体異常試験において連続処理法48時間処理および短時間処理法S9 mix存在下で構造異常細胞の誘発作用が認められ5),さらに,4-sec-ブチルフェノールでは同様の試験において,連続処理法48時間処理および短時間処理法S9 mix存在下での構造異常細胞の誘発に対し,疑陽性の判定が示されており6),本被験物質と構造式が比較的類似するこれらの物質では,ほぼ同様の結果が報告されている.一方,4-tert-ブチルフェノールおよび2,6-tert-ブチルフェノールでは,ラット肝細胞を用いた染色体異常試験において陰性7),また,2,2'-メチレンビス(6-tert-ブチル-ρ-クレゾール)および4,4'チオビス(6-tert-ブチル-m-クレゾール)4)ではCHL/IU細胞を用いた染色体異常試験において陰性と報告されている.
| 1) | 日本環境変異原学会・哺乳動物試験分科会編,"化学物質による染色体異常アトラス,"朝倉書店,東京,1988, pp. 16-37. |
| 2) | 厚生省生活衛生局企画課生活化学安全対策室 監修,"化審法毒性試験法の解説 改訂版,"化学工業日報社,東京,1992, pp. 51-52. |
| 3) | 石館 基 監修,"改定増補 染色体異常試験データ集,"エル・アイ・シー,東京,1987, p. 19. |
| 4) | 厚生省生活衛生局企画課生活化学安全対策室監修,"化学物質毒性試験報告,"Vol. 4,化学物質点検推進連絡協議会,東京,1996. |
| 5) | 厚生省生活衛生局企画課生活化学安全対策室監修,"化学物質毒性試験報告,"Vol. 7,化学物質点検推進連絡協議会,東京,1999, p. 232. |
| 6) | 厚生省生活衛生局企画課生活化学安全対策室監修,"化学物質毒性試験報告,"Vol. 2,化学物質点検推進連絡協議会,東京,1995, p. 347. |
| 7) | B. J. Dean, T. M. Brooks, G. Hodson-Walker, D. H. Hutson, Mutat. Res., 153, 57(1985). |
| 連絡先 | |||
| 試験責任者: | 野田 篤 | ||
| 試験担当者: | 野田 篤,昆 尚美 | ||
| (財)畜産生物科学安全研究所 | |||
| 〒229-1132 神奈川県相模原市橋本台3-7-11 | |||
| Tel 042-762-2775 | Fax 042-762-7979 | ||
| Correspondence | ||||
| Authors: | Atsushi Noda (Study director) Naomi Kon | |||
| Research Institute for Animal Science in Biochemistry and Toxicology | ||||
| 3-7-11 Hashimotodai, Sagamihara-shi, kanagawa, 229-1132, Japan. | ||||
| Tel +81-42-762-2775 | Fax +81-42-762-7979 | |||