雌動物では,500 mg/kg投与群において,自発運動減少および腹臥姿勢が回復しないまま,あるいはそれに加えて,鎮静,紅涙,体温低下,触発反応の喪失,流涙,呼吸困難あるいは褐色尿などを示した後の投与3-5日に,13例中3例が死亡し,2例を瀕死剖検した.病理学検査から,これらの動物には剖検の数日前から胸腔内諸組織に炎症性の変化が生じていたものと推測された.病理組織学検査では,胸腔内諸組織の炎症性変化の他に,腎臓の近位尿細管の脂肪変性,ならびに脾臓における白脾髄および赤脾髄の萎縮も認められた.
生存例では,100 mg/kg以上の投与群において,投与開始後,雄と同様の一般状態の変化が観察され,さらに,500 mg/kg投与群では,それらが翌日まで持続する例,四肢の伸展およびよろめき歩行を示す例,また,途中剖検例にも認められた種々の一般状態の変化が,いずれも投与初期に認められた.体重増加抑制は,100 mg/kg投与群の妊娠初期および500 mg/kg投与群の投与初期に,また,摂餌量の抑制は,500 mg/kg投与群の投与初期および妊娠初期に認められた.哺育4日の病理学検査では,肝臓は,100 mg/kg以上の投与群において,また,腎臓,脳および副腎は,500 mg/kg投与群において重量あるいは比体重値が増加し,100 mg/kg以上の投与群の肝臓に腫大あるいは暗色化が認められ,胸腺には小型化が認められた.また,100 mg/kg以上の投与群に,肺と肋骨胸膜あるいは横隔膜との癒着が認められ,さらに,500 mg/kg投与群では,心外膜と心嚢の癒着,心嚢と肺,胸腺,あるいは肋骨胸膜との癒着,心嚢の白濁,ならびに心嚢の肥厚が観察された.病理組織学検査では,100 mg/kg以上の投与群に曇り硝子様を呈する小葉中心性肝細胞肥大が,また,500 mg/kg投与群では心外膜の線維化および細胞浸潤,胸腺の萎縮ならびに被膜の線維化および細胞浸潤が認められた.これらの他に,途中剖検例の多くに認められた胸腺被膜の水腫が100 mg/kg以上の投与群に,腎臓の近位尿細管の脂肪変性,および脾臓における白脾髄の萎縮が500 mg/kg投与群に,また,胸腺被膜上の好中球を含む滲出物が100 mg/kg投与群にそれぞれ少数例認められた.しかし,20 mg/kg投与群では,いずれの検査・観察項目にも,被験物質投与の影響は認められなかった.
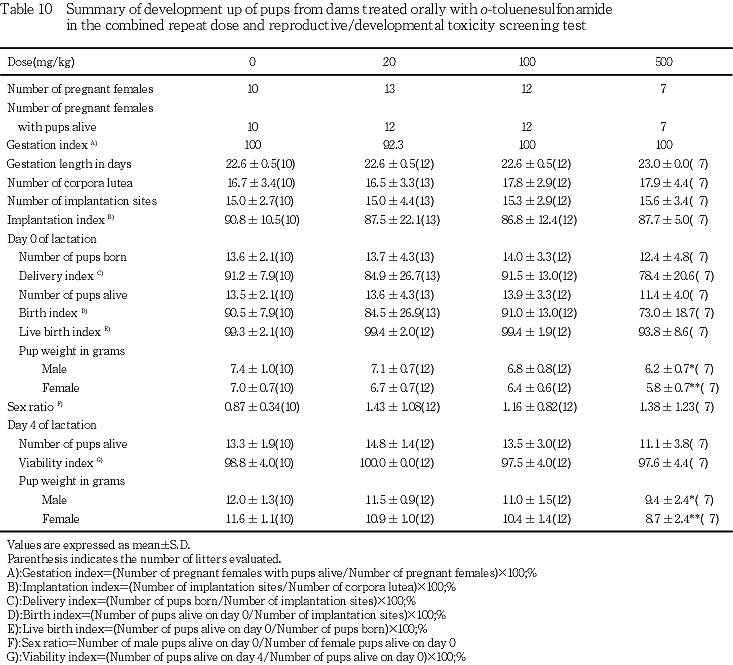
出生児については,被験物質投与に起因した形態異常は観察されなかったが,500 mg/kg投与群における哺育0および4日の生存児数,ならびに分娩率が低下傾向を示し,哺育0および4日における雌雄生存児体重に低下が認められた.
投与検体は,0.5 w/v%カルボキシメチルセルロースナトリウム(CMC Na) 水溶液(日局カルメロースナトリウム:丸石製薬,製造番号:6Z09; 日局注射用水:光製薬,製造番号: 9707SA)に懸濁して,いずれの用量においても1回の投与液量が5 mL/kg体重になるように含量を調整し,冷蔵保管して使用した.投与検体中に含まれる被験物質の含量および均一性を,秦野研究所において確認した.
各動物は,基準温湿度各24±1℃,および50-65 %,換気回数約15回/時間,照明12時間(午前7時-午後7時)に制御された飼育室で,金属製ケージに個別に収容して飼育し,固型飼料(CE-2,日本クレア)および飲料水(水道水,秦野市水道局給水)を自由に摂取させた.妊娠14日 (精子確認日=妊娠0日)以後の母動物は,ラット用繁殖ケージに収容し,床敷として紙パルプ製チップ(ALPHA-dri,加商)を適宜供給した.
各用量の投与検体は,雌雄各13匹から成る各群の動物に対して剖検の前日まで,毎日1回,調製検体をマグネティックスターラーで攪拌しながらラット用胃管を用いて経口投与した.すなわち,雄に対しては交配前14日間,交配期間14日間および交配期間終了後14日間までの連続42日間,また,雌に対しては,交配前14日間と最長14日間の交配期間中(交尾まで),ならびに交尾雌では妊娠期間を通して剖検前日哺育3日(分娩日=哺育0日)まで,交尾後,分娩の認められなかった動物に対しては,妊娠24日相当日まで,それぞれ投与した.毎日の投与は,原則として一定時刻の間(通常9-12時)に行い,各動物の投与液量(5 mL/kg)は,雄ならびに交配前および交配期間中の雌については週1回の測定体重を基に,また,交尾後の雌については妊娠0日(交尾確認日)の体重を基にそれぞれ算出した.
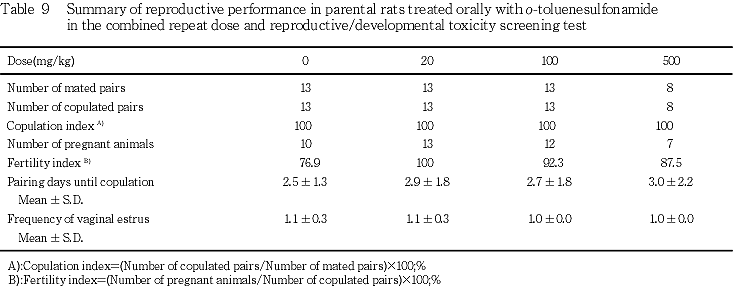
分娩を確認した全例について妊娠期間(妊娠0日から分娩日までの日数)を算定し,出産率[(生児出産雌数/受胎動物数)×100]を各群について求めた.
 法),アルカリフォスファターゼ活性(ALP;GSCC法),GOTおよびGPT活性(IFCC法),総ビリルビン濃度(Jendrassik/Grof法),カルシウム濃度(OCPC法),無機リン濃度(Inorg. phos.;モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,全自動電解質分析装置EA05(A&T)を用いてイオン電極法により,カルシウム,ナトリウムおよびカリウムの各濃度を測定した.また,A/G比は上記の測定結果に基づいて算出した.
法),アルカリフォスファターゼ活性(ALP;GSCC法),GOTおよびGPT活性(IFCC法),総ビリルビン濃度(Jendrassik/Grof法),カルシウム濃度(OCPC法),無機リン濃度(Inorg. phos.;モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,全自動電解質分析装置EA05(A&T)を用いてイオン電極法により,カルシウム,ナトリウムおよびカリウムの各濃度を測定した.また,A/G比は上記の測定結果に基づいて算出した.
雌では,500 mg/kg投与群において,投与3日に3例が死亡し,投与3および5日に2例を瀕死屠殺した.これらの動物は,いずれも初回投与後は自発運動減少および腹臥姿勢が認められたものの,いずれも翌日までに回復していた.しかし,投与を反復するのに従い, 症状の回復が不良となり,鎮静,紅涙,呼吸困難,流涙,着色尿などを示して死亡または瀕死状態に至った.生存例では,100 mg/kg以上の投与群において,死亡および瀕死屠殺例に観察されたのと同様な投与後の自発運動減少および腹臥姿勢が認められた.100 mg/kg投与群では腹臥姿勢は,散発的にしか認められず,いずれも翌日までに回復したが,500 mg/kg投与群では,死亡あるいは瀕死状態の動物が認められた時期に,よろめき歩行あるいは四肢の伸展を示す例,あるいは,鎮静,体温低下,紅涙,褐色尿など死亡あるいは瀕死状態の動物と同様の症状を示す例があった.また,投与初期には,前日の投与後に認められた自発運動減少および腹臥姿勢が回復しないまま継続して認められた例もあった.流涎は,上記のような重篤な症状が500 mg/kg投与群に認められなくなった時期から,主に投与後一過性に現れ,100 mg/kg投与群にも認められるようになった.この他,被験物質投与とは無関係な変化として脱毛が対照群および100 mg/kg投与群に認められた.20 mg/kg投与群に一般状態の異常は観察されなかった.
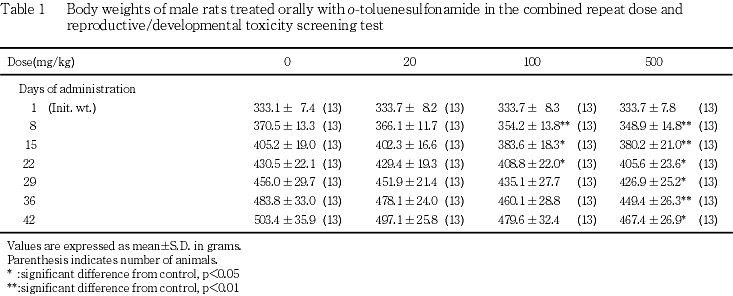
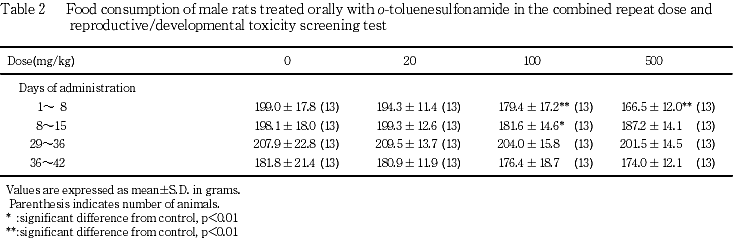
雌では,交配前の投与初期には,500 mg/kg投与群の投与8日の体重ならびに投与1-8日の摂餌量が,それぞれ対照群と比較して有意(p<0.01,p<0.05)な低値を示した.妊娠および哺育期には,100 mg/kg以上の投与群の体重増加が抑制を受け,両群ともに妊娠7日および哺育4日の体重が対照群と比較して有意(p<0.01,p<0.05)な低値を示した.また,500 mg/kg投与群の妊娠0-7日の摂餌量も対照群と比較して有意(p<0.05)な低値を示した.20 mg/kg投与群については,いずれの時期も対照群との間に有意差は認めなかった.

(肝臓)
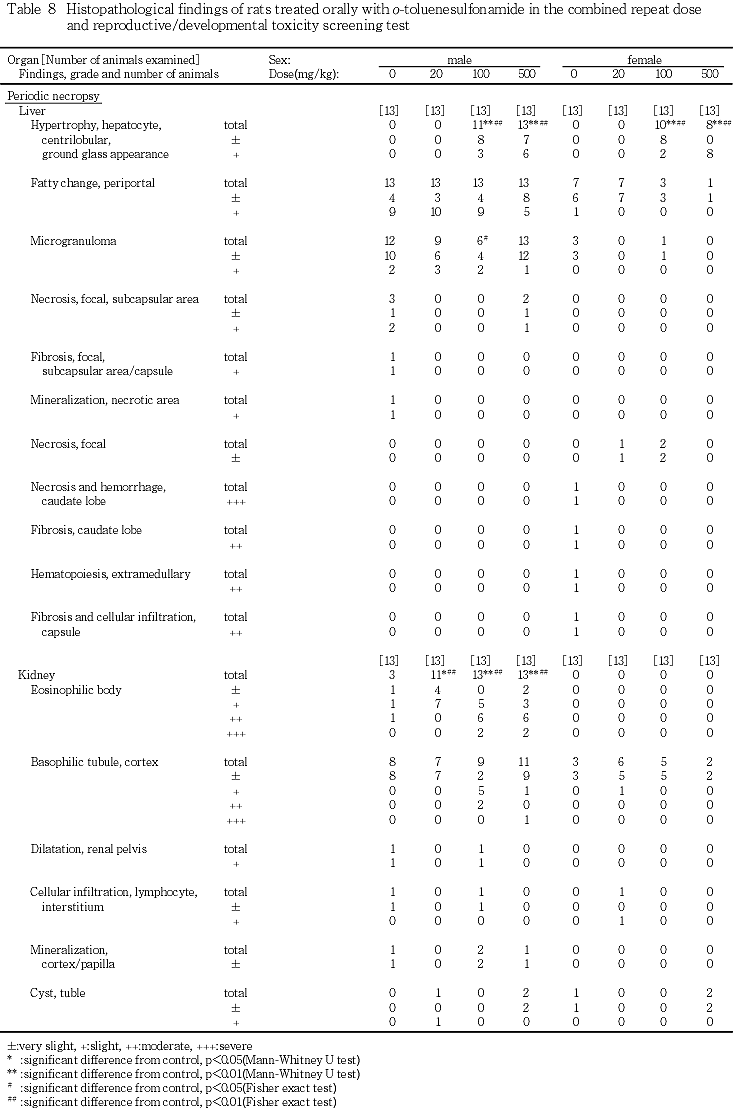
被験物質の用量に依存した変化としては,100 mg/kg以上の投与群に細胞質が軽微な曇り硝子様を呈する小葉中心性の肝細胞肥大が認められた(p<0.01).一方, 被験物質の用量とは関連なく,門脈周囲性の肝細胞の脂肪化および小肉芽腫,被膜下の限局性壊死巣,被膜および被膜下の限局性線維化ならびに壊死および鉱質沈着が観察された.これらの中で,100 mg/kg投与群における小肉芽腫の頻度は,対照群と比較して有意(p<0.05)な低値であった.
(腎臓)
対照群を含む各投与群でeosinophilic bodyが認められたが,対照群と比較すると,被験物質各投与群で頻度および程度が用量に依存して有意(p<0.01)に増加した.Eosinophilic bodyの認められた腎臓についてPAS染色を実施したが,陽性反応は認められなかった.被験物質の用量とは関連なく,皮質の好塩基性尿細管,腎盂の拡張,間質のリンパ球浸潤あるいは限局性線維化,皮質あるいは乳頭部の鉱質沈着,尿細管の嚢胞が観察された.
(膀胱)
各投与群の粘膜固有層にリンパ球や好中球の浸潤が散見され,そのうち100および500 mg/kg投与群の例には,粘膜上皮のびまん性あるいは限局性の過形成も認められたが,いずれも被験物質投与に関連した変化ではなかった.
(脾臓)
検査を実施した対照群および500 mg/kg投与群の全例に, 被験物質投与の有無とは関連なく髄外造血および褐色色素の沈着が観察された.
(精巣および精巣上体)
検査を実施した対照群および500 mg/kg投与群に生殖細胞の減少を伴う精細管の萎縮が認められ,そのうちの対照群の1例にはライディッヒ細胞のびまん性の過形成が認められた.また,精巣上体では,対照群の間質にリンパ球の浸潤が認められた他,両投与群に精巣上体管腔内の精子の減少あるいは細胞残屑が観察されたが,いずれも被験物質投与に関連した変化ではなかった.
(剖検時異常器官)
表には示していないが,暗色点が観察された対照群の肺には軽度な限局性の出血が,暗色点および白色点の観察された対照群の肺にはごく軽度な泡沫細胞の集簇が,暗色点および白色点の観察された500 mg/kg投与群の肺には,ごく軽度な限局性の出血および軽度な泡沫細胞の集簇が観察された.また,内部に暗赤色調域の観察された500 mg/kg投与群の眼球の硝子体には中等度の出血が認められた.
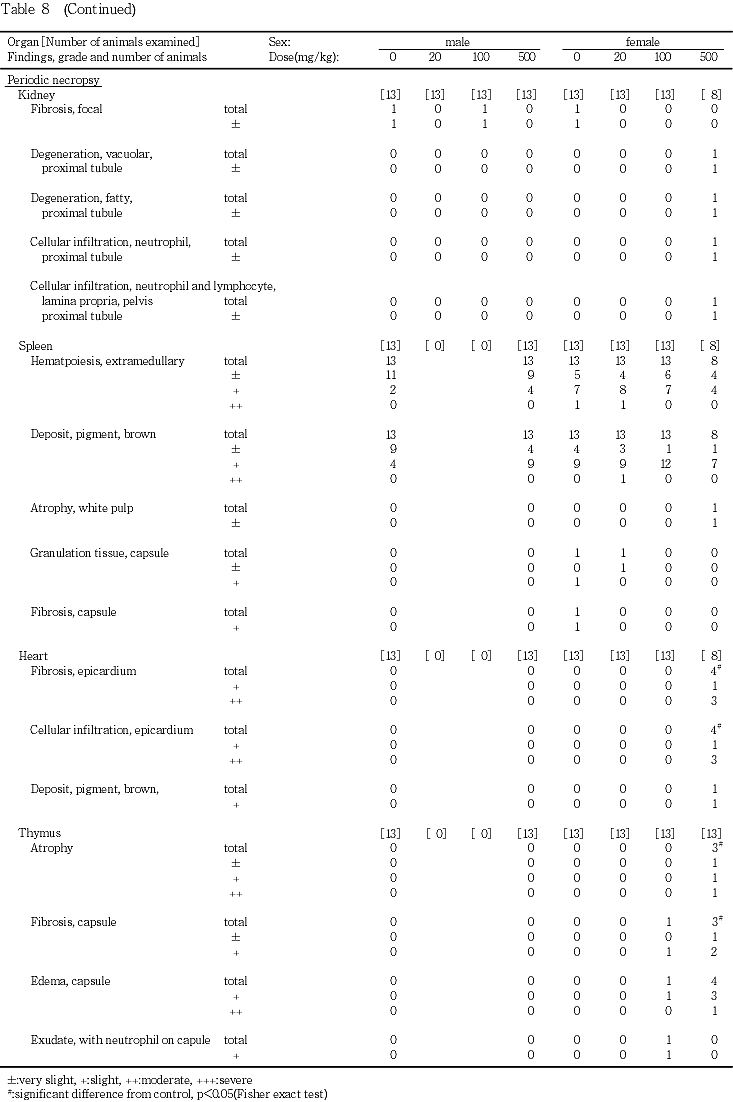

(肝臓)
被験物質の用量に依存した変化としては,100 mg/kg以上の投与群に細胞質が軽微な曇り硝子様を呈する小葉中心性の肝細胞肥大が認められた(p<0.01).この所見は,500 mg/kg投与群では,定期解剖例の全例に認められたもので,途中剖検例(死亡例および瀕死屠殺例)には認められなかった.被験物質の用量とは関連のない所見としては,門脈周囲性の肝細胞の脂肪化および小肉芽腫が認められた.また,剖検時に尾状葉に異常が認められた対照群の例には,尾状葉の壊死,出血および線維化,髄外造血,ならびに被膜の線維化および細胞浸潤が認められた.
(腎臓)
500 mg/kg投与群において4例の近位尿細管に脂肪沈着によると考えられる空胞が観察されたため,対照群の1例を対照として,これらの動物について,oil red O染色を行ったところ,脂肪変性であることが確認された.また,その頻度は対照群と比較して有意(p<0.05)な高値を示した.この変化は,主に,途中解剖例に認められたもので,定期解剖例については対照群との間に有意差は認められなかった.空胞変性は,500 mg/kg投与群の定期解剖例の1例に認められたが,途中剖検例には観察されなかった.この他,500 mg/kg投与群の定期解剖例に,乳頭部の管腔の好中球浸潤,腎盂粘膜の固有層の好中球およびリンパ球の浸潤が観察されたが,対照群との間に有意差は認められなかった.以上の他には,皮質の好塩基性尿細管,限局性の線維化が,間質のリンパ球浸潤および皮質あるいは乳頭部の鉱質沈着,皮髄境界部の尿細管の嚢胞が,被験物質の用量とは関連なく観察された.
(脾臓)
500 mg/kg投与群において,白脾髄および赤脾髄の萎縮が認められ,それらの頻度は対照群と比較して有意(p<0.05)な高値であった.白脾髄の萎縮は,主に途中剖検例に認められたものであり,赤脾髄の萎縮は定期解剖例には認められず,途中剖検例すべてに認められた変化である.従って,定期解剖例における頻度を対照群と比較すると,有意差は認められなくなった.髄外造血および褐色色素の沈着は対照群を含む各投与群の全例に観察された.また,被膜の肉芽組織が対照群および20 mg/kg投与群に,被膜の線維化が対照群に観察されたが,これらの所見の頻度および程度に対照群と被験物質各投与群との間で有意差は認められなかった.
(心臓)
500 mg/kg投与群の定期解剖例に,心外膜の線維化および細胞浸潤が認められた.心外膜の細胞浸潤は,追加観察を行った途中剖検例にも認められ,これらの所見の頻度は,定期解剖例のみを対象としても,500 mg/kg投与群の全例を対象としても,対照群と比較して有意(p<0.05)な高値であった.また,500 mg/kg投与群の途中剖検例には心外膜下の細胞浸潤が,途中剖検例および定期解剖例には心外膜の色素沈着が観察された.これらの所見の頻度および程度については,対照群との間に有意差は認められなかった.
(胸腺)
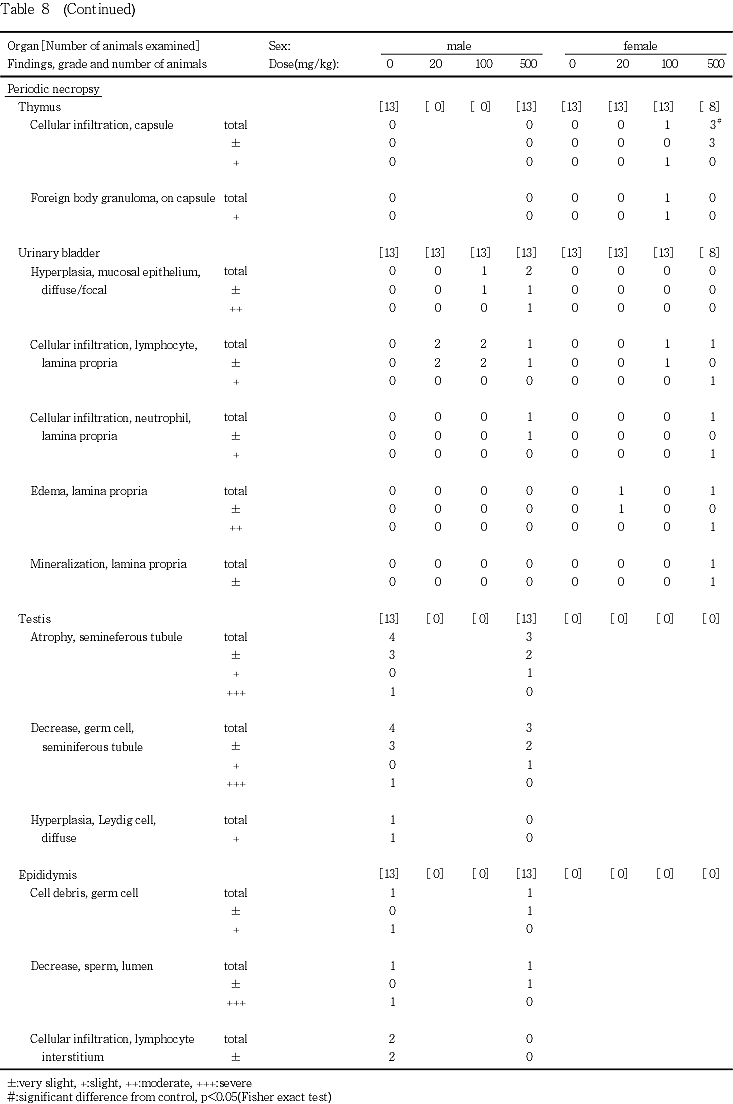
500 mg/kg投与群の途中剖検例および定期解剖例に萎縮が観察され,その頻度は,定期解剖例のみを対象としても,500 mg/kg投与群の全例を対象としても,対照群と比較して有意(p<0.05,p<0.01)な高値であった.また,100 mg/kg以上の投与群において,被膜の線維化,水腫,および細胞浸潤,ならびに被膜上の好中球を含む滲出物が認められた.500 mg/kg投与群におけるこれらの所見の頻度を対照群と比較すると,全例を対象にすると被膜の水腫および細胞浸潤が有意(p<0.05,p<0.01)な高値を示し,定期解剖例を対象とすると,被膜の線維化および細胞浸潤が有意(p<0.05)な高値を示した.100 mg/kg投与群については,対照群との間に有意差は認められなかった.この他,100 mg/kg投与群には,被膜上の異物肉芽腫が観察されたが,その頻度については,対照群との間に有意差は認められなかった.
(膀胱)
500 mg/kg投与群の1例の粘膜固有層に,リンパ球および好中球の浸潤と鉱質沈着を伴う水腫が認められたほか,他の被験物質投与群の粘膜固有層にも,リンパ球の浸潤あるいは水腫が各1例観察されたが,各群間の頻度に差は認められなかった.
(剖検時異常器官)
表には示していないが,500 mg/kg投与群の肺には,途中剖検例および定期解剖例ともに,ごく軽度ないし軽度な限局性の出血ならびに好中球およびリンパ球の細胞浸潤が認められ,途中剖検例にはごく軽度ないし中等度の水腫およびマクロファージの浸潤ならびに胸膜上に好中球を含む滲出物が認められた.この滲出物に異物の混入している例も認められた.また,100 mg/kg投与群ならびに500 mg/kg投与群の定期解剖例にはごく軽度ないし軽度な泡沫細胞の集簇および軽度ないし中等度の胸膜の線維化が観察され,100 mg/kg投与群ならびに500 mg/kg投与群の途中剖検例には,ごく軽度ないし中等度の胸膜の細胞浸潤が観察された.この他,100 mg/kg投与群では胸膜上に中等度の異物肉芽腫が観察された.
追加観察を行った途中剖検例2例の食道については,1例に,軽度な,穿孔,粘膜および筋層の変性ならびに好中球の浸潤,および食道外膜下および胸腔の中等度の出血が観察された.他の1例には肉眼観察で微細な穿孔の認められた部位の組織所見に異常は認められなかったが,胸膜上には,好中球を含む滲出物が軽度に認められ,異物も観察された.また,横隔膜の胸膜面に軽度な細胞浸潤が観察され,好中球を含む滲出物も軽度に認められた.脂肪組織との癒着が観察された対照群の横隔膜については,腹膜に,中等度の肉芽組織,線維化および出血が認められた.
以上の所見の他に,脱毛が認められた対照群の皮膚には軽度な毛包の減少が,また,子宮角に胎盤遺残が認められた20 mg/kg投与群の子宮内膜には胎盤の遺残体が認められた.
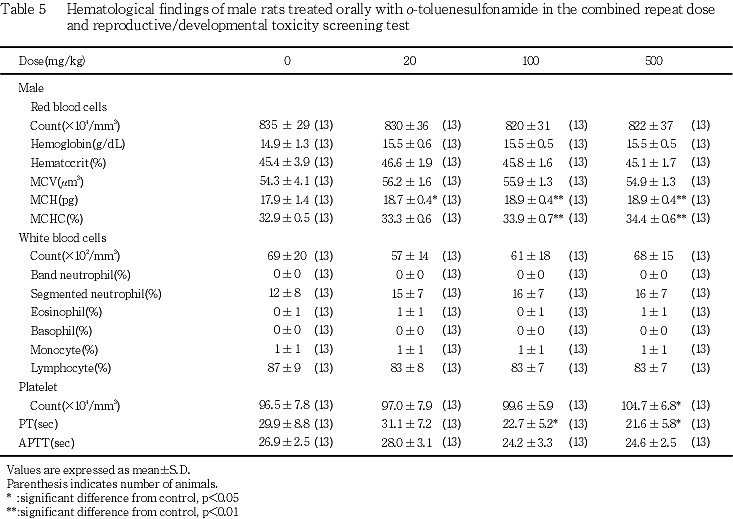
42日間投与後の雄動物の血液学検査では,MCHが被験物質各投与群において,また,MCHCが100 mg/kg以上の投与群においてそれぞれ増加した.しかし,これらの数値の算出の基礎となった,HbおよびRBCあるいはHtには被験物質の用量に依存した変化は認められなかったことから,これらの数値の変動は,偶発的変化である可能性が高い.この他,500 mg/kg投与群では血小板数が増加した.増加の程度は僅かであるが,被験物質の用量に依存して変化していることから,被験物質投与による影響であると推測される.
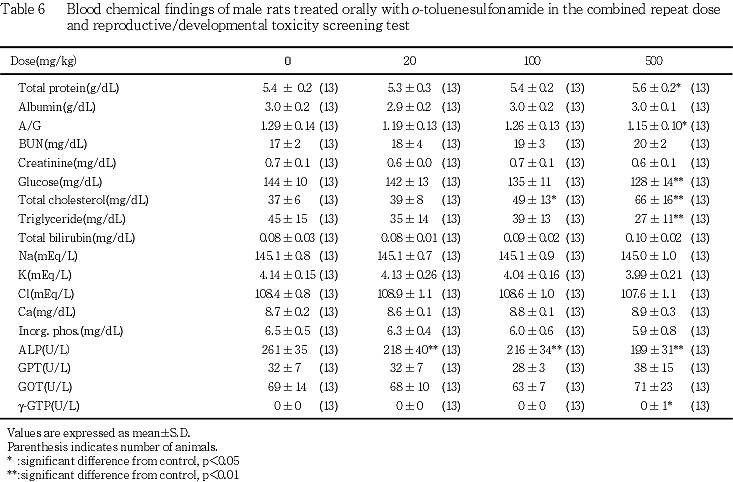
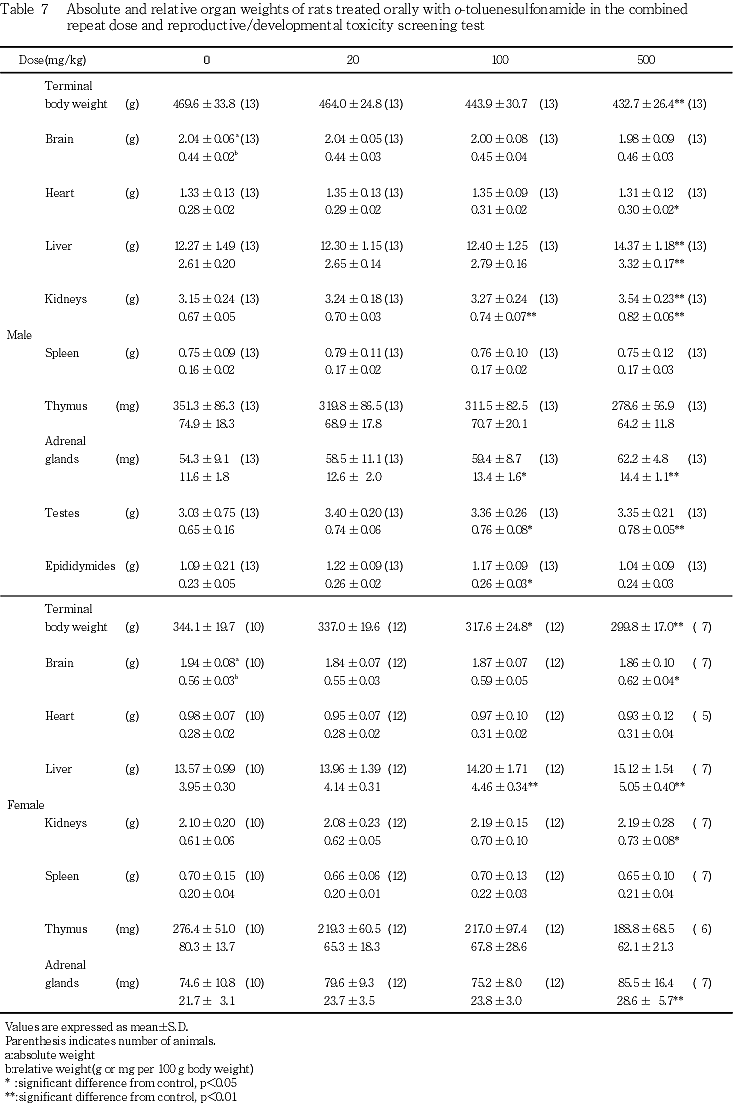
雄動物の血液生化学検査では,すべての被験物質投与群においてALPが低下し,100 mg/kg以上の投与群において総コレステロール濃度が増加した.また,500 mg/kg投与群ではブドウ糖濃度およびトリグリセライド濃度が低下した.ALPの低下および血中コレステロール濃度の上昇は,甲状腺機能低下の際にも認められる変化であること14),スルホンアミド類には,ブドウ糖濃度を低下させる作用も認められていること10)から,これらの変化はスルホンアミド類の毒性作用あるいは薬理作用に関連した変化であることが疑われた.しかし,スルホンアミド類に属する4-メチルベンゼンスルホンアミドについて実施された反復投与毒性・生殖発生毒性併合試験15)では,ALP,血中コレステロール濃度およびブドウ糖濃度へ4-メチルベンゼンスルホンアミドの影響は認められなかった.また,100 mg/kg以上の投与群の一部の雌動物の甲状腺,ならびに対照群および100 mg/kg投与群の各1例の膵臓の病理について実施した組織学検査では,被験物質投与の影響を示唆する病変は認められなかった.従って,本被験物質がスルホンアミドとして甲状腺および膵臓に影響を及ぼす可能性は否定できないが,それは明瞭な形態変化を起こさない軽微な影響であると判断された.この他,グロブリン類の増加によると考えられる総蛋白濃度の増加およびγ-GTP活性の上昇が500 mg/kg投与群において認められたが,軽微な変化であった.器官重量については,500 mg/kg投与群において,肝臓重量および腎臓重量が増加し,これらの比体重値が100 mg/kg以上の投与群で増加した.病理組織学検査では,これらの投与群に曇り硝子様の肝細胞の小葉中心性肥大が認められていることから,肝臓重量の増加は,肝細胞肥大を反映したものと考えられる.腎臓については,尿細管上皮におけるeosinophilic body形成の増強がすべての被験物質投与群において認められた.これらの他,100 mg/kg以上の投与群において副腎重量比体重値が増加した.重量もやや高値を示していること,ならびに500 mg/kg投与群の雌においても同様の変化が認められていることから,被験物質投与による影響であると考えられるが,病理組織学検査では,雌雄ともに副腎に異常は観察されなかった.以上のように,本試験では,すべての用量の被験物質がALPを低下させ,腎臓の尿細管上皮におけるeosinophilic bodyの形成を増強させたことから,反復投与毒性に関しては,雄動物に対するo-トルエンスルホンアミドの無影響量は求められなかった.
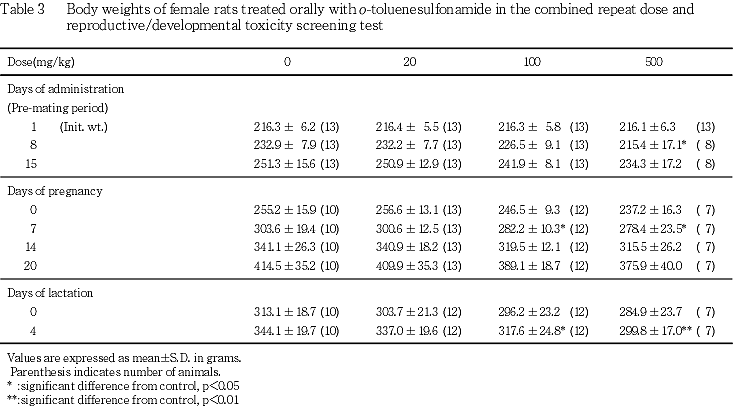
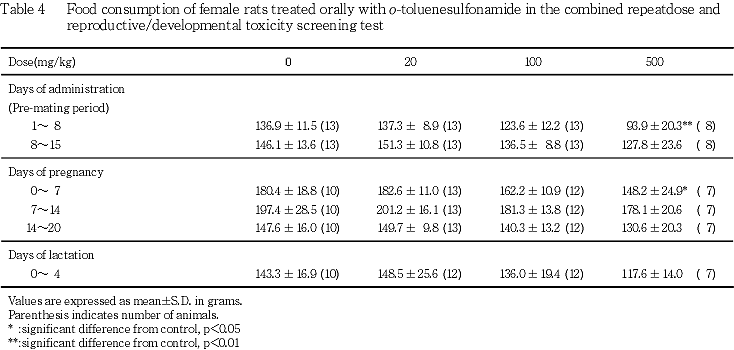
雌についても,100 mg/kg以上の投与群において,自発運動量減少および腹臥姿勢といった一般状態の異常が投与開始後から認められた.さらに,500 mg/kg投与群において投与2日後からこれらの症状が投与翌日に至っても消失しない,あるいはさらに進行して,鎮静,呼吸困難,体温低下,触発反応の消失などの経過を辿り,投与3日後から5日の間に死亡または瀕死状態に至る例が認められた.
死亡あるいは瀕死動物の剖検では,いずれの動物にも胸水の貯留が観察され,病理組織学検査では,肺水腫および胸膜を含む胸腔内諸器官漿膜の細胞浸潤を伴う滲出と水腫,心外膜の色素沈着,肺の水腫,限局性出血ならびに炎症細胞の浸潤などが認められた.さらに,異常器官として保存された肺とともに残存していた2例の食道について検索したところ,出血および炎症細胞の浸潤を伴う穿孔あるいは胸腔内の滲出物中の食餌様物質の混入が認められた.これらのことから,いずれの動物も胸腔内諸組織の炎症により死亡あるいは瀕死状態に至ったものと判断された.一方,o-トルエンスルホンアミドの単回投与試験16)では,死亡動物の肉眼解剖所見から,死因は強い中枢抑制であると推測されている.本試験においても,自発運動減少,腹臥姿勢,鎮静など,単回投与試験16)においてみられたのと類似した変化が,死亡あるいは瀕死動物で特に著しく認められたが,脳の病理組織学検査において明瞭な異常は観察されず,上記の死亡原因に中枢への影響がさらに加わったのかどうかは不明である.
生存例の中にも,途中剖検例と同時期に,自発運動減少,腹臥姿勢,鎮静など変化が翌日まで回復しないものが認められた.また,生存例の定期解剖では,100 mg/kg以上の投与群に,途中剖検例にみられた病変の陳旧性変化と考えられる,胸腔内諸器官漿膜の癒着などが認められ,病理組織学検査では,これらの部位に線維化および細胞浸潤,異物肉芽腫などが認められ,心外膜の線維化および細胞浸潤,ならびに胸腺被膜の線維化および細胞浸潤の頻度が増加した.従って,生存例の中にも投与期間の比較的早い時期に胸腔内諸組織の炎症があったものと推測される.これらの変化の他に,500 mg/kg投与群における胸腺の萎縮ならびに腎臓および副腎の比体重値の増加は,高用量群のみに観察された変化であることから,被験物質投与による影響であると考えられる.これらの結果から,雌に対するo-トルエンスルホンアミドの反復投与毒性に関する無影響量は,20 mg/kg/dayであると推測される.
雌雄ともに,500 mg/kg投与群において,摂餌量および体重増加の抑制が投与初期に認められた.とくに雌では,胸腔内組織の炎症を示唆する病変の認められなかった例にも著しい体重減少や,翌日に至っても鎮静などの症状が回復しない例が認められ,被験物質投与の影響が,性差をもって投与初期に認められた.性差は,単回投与試験16)において推定されたLD50値にも現れている.こうした,毒性発現にみられる性差および時期の特徴については,被験物質の代謝排泄が関与している可能性がある.すなわち,経口投与されたo-トルエンスルホンアミドの排泄を,Wistar系雌ラットを用いて調べた成績17)では,o-トルエンスルホンアミドの大部分は尿中に排泄され,24時間排泄率は本被験物質の用量増加に伴い低下して,200 mg/kg投与では43 %になる.o-トルエンスルホンアミドは,尿中では,主に2-sulphamoylbenzyl alcohol,あるいは,そのグルクロン酸または硫酸抱合体として認められることから,2-sulphamoylbenzyl alcoholへの変換は,P450水酸化酵素により行われるものと考えられる.P450水酸化酵素の発現については性差が著しく,また,誘導を受けやすいことが知られている18).従って,P450水酸化酵素の発現が少ない雌では,解毒が遅れて毒性が強く現れ,さらに,反復投与により雌雄ともに酵素誘導が生じて,毒性が軽減されたものと推測される.100 mg/kg以上の投与群の雄動物および生存例の雌動物では,肝臓重量あるいはその比体重値が増加し,病理組織学検査において小葉中心性肝細胞肥大が認められたこと,および,これらの動物の肝細胞細胞質は,軽度ではあるが,曇り硝子様を呈していたことは,酵素誘導があったことを支持する所見であると考える.
生殖毒性については,交尾率,受胎率,交尾までの期間とその間に回帰した発情期の回数,妊娠黄体数ならびに着床数に被験物質投与の影響は認められなかったことから,500 mg/kgまでは雌雄動物の生殖能力に影響を及ぼさないものと考えられる.
出生児については,妊娠初日から母動物を250 mg/kg/dayまでの用量で経口曝露すると,被験物質の用量に依存して,生後15日の出生児に尿路結石が認められることが報告されている19)が,生後4日に剖検した本試験の出生児に形態異常は認められなかった.しかし,哺育0日における生存児数が500 mg/kg投与群において減少の傾向を示し,分娩率および生児出産率にも低下の傾向が認められた.さらに哺育0および4日における出生児体重が低下し,500 mg/kgでは,出生児の生存性および体重に影響を及ぼすことが明らかになった.同様の変化は,交配前あるいは妊娠初日から250 mg/kg/dayで経口曝露された動物の出生児8, 19),あるいは4-メチルベンゼンスルホンアミドの併合試験15)においても認められている.スルホンアミド類によって甲状腺機能低下が誘発される12)が,胎児期,あるいは生後間もなく甲状腺ホルモンが不足すると成長阻害が起こる20).被験物質の胎盤通過性および乳汁移行性については不明であり,母動物および新生児の甲状腺に肉眼的異常は観察されなかった.また,少数例ではあるが100 mg/kgおよび500 mg/kg投与群の母動物について実施した甲状腺の病理組織検査では異常は観察されなかった.これらのことから,新生児の生存性および体重増加の抑制は,被験物質投与による影響であると考えられるが,母動物および新生児の甲状腺ホルモン分泌との関連性についてはさらに検討を要するものと考えられる.100 mg/kg以下の投与群には,被験物質投与の影響は認められなかったことから,被験物質の出生児に対する無影響量は,100 mg/kg/dayであると推測される.
以上の成績から,本試験条件下におけるo-トルエンスルホンアミドの無影響量は,反復投与毒性に関しては,雄では求められなかったが,雌については,20 mg/kg/dayであると結論される.生殖発生毒性に関しては,雌雄親動物では500 mg/kg/dayであり,出生児については100 mg/kg/dayであると結論される.
| 1) | 丹後俊郎,"医学への統計学,"古川俊之監,朝倉書店,東京,1985. |
| 2) | 石居進,"生物統計学入門,"培風館,東京,1992. |
| 3) | 佐久間昭,"薬効評価-計画と解析,"東京大学出版会,東京,1977. |
| 4) | C. W. Dunnett, Biometrics, 20, 482(1964). |
| 5) | H. Scheffe, Biometrika, 40, 87(1953). |
| 6) | W. H. Kruskal, W. A. Wallis, J. Amer. Statist. Assoc., 47, 583(1952). |
| 7) | B. Stavric, R. Lacombe, A. W. By, J. Ass. Offic. Anal. Chem., 57, 678(1974). |
| 8) | D. L. Arnold, C. A. Moodie, P. F. McGuire, B. T. Collins, S. M. Charbonneau, I. C. Munro, Toxicol. Appl. Pharmacol., 51, 455(1979). |
| 9) | T. C. Daniels, E. C. Jorgensen, Diuretics. in "Textbook of Organic Medical and Pharmaceutical Chemistry," 6, eds. by C. O. Wilson, O. G. Gisvol, R. F. Doerge, J. B. Lippincott, Co., Philadelphia, 1971, pp. 599-624. |
| 10) | "The Pharmacological Basis of Therapeutics," eds. by A. G. Gilman, T. W. Rall, A. S. Nies, P. Taylor, Pergamon, New York, 1990. |
| 11) | Z. Gregus, C. D. Klassen, Mechanisms of toxicity. in "Casarett & Doull's Toxicology―The Basic Sciences of Poisons," 5, ed. by C. D. Klaassen, McGraw-Hill, New York, 1996, pp. 35-74. |
| 12) | C. C. Capen, Toxic responses of the endocrine system. in "Casarett & Doull's Toxicology―The Basic Sciences of Poisons," 5, ed. by C. D. Klaassen, McGraw-Hill, New York, 1996, pp. 617-640. |
| 13) | H. R. Rice, D. E. Cohen, Toxic responses of the skin. in "Casarett & Doull's Toxicology―The Basic Sciences of Poisons," 5, ed. by C. D. Klaassen, McGraw-Hill, New York, 1996, pp. 529-546. |
| 14) | 谷本義文,"実験動物の血液・尿生化学,"ソフトサイエンス社,東京,1988. |
| 15) | 厚生省生活衛生局企画課生活化学安全対策室監修,"化学物質毒性試験報告,"Vol. 1,化学物質点検推進連絡協議会,東京,1994, p. 33. |
| 16) | 厚生省生活衛生局企画課生活化学安全対策室監修,"化学物質毒性試験報告,"Vol. 7,化学物質点検推進連絡協議会,東京,1999, p. 131. |
| 17) | A. G. Renwick, L. M. Ball, D. L. Corina, R. T. Williams, Xenobiotica, 8, 461(1978). |
| 18) | I. G. Sipes, A. J. Gandolfi, Biotransformation of toxicants. in "Casarett & Doull's Toxicology―The Basic Sciences of Poisons," 4, eds. by M. O. Amdur, J. Doull, C. D. Klaassen, McGraw-Hill, New York, 1991, pp. 88-126. |
| 19) | D. L. Arnold, C. A. Moodie, H. C. Grice, S. M. Charbonneau, B. Stavric, B. T. Collins, P. F. McGuire, Z. Z. Zawidzka, I. C. Munro, Toxicol. Appl. Pharmacol., 52, 113(1980). |
| 20) | 小林英司,"内分泌現象,"基礎生物学選書,5,本城ら編.裳華房.東京.1976. |
| 連絡先 | |||
| 試験責任者: | 長尾哲二 | ||
| 試験担当者: | 代田眞理子,松本亜紀,関 剛幸,笠間菊子,加藤博康,丸茂秀樹,畔上二郎,三枝克彦,稲田浩子,中尾美津男,安生孝子 | ||
| (財)食品薬品安全センター | |||
| 〒257-8523 神奈川県秦野市落合725-3 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Tetsuji Nagao (Study director) Mariko Shirota, Aki Matsumoto, Takayuki Seki, Kikuko Kasama, Hiroyasu Kato, Hideki Marumo, Jiro Azegami, Katuhiko Saegusa, Hiroko Inada, Mitsuo Nakao, Takako Anjo | |||
| Hatano Research Institute, Food and Drug Safety Center in Reproductive Toxicology | ||||
| 729-5 Ochiai, Hadano city, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||