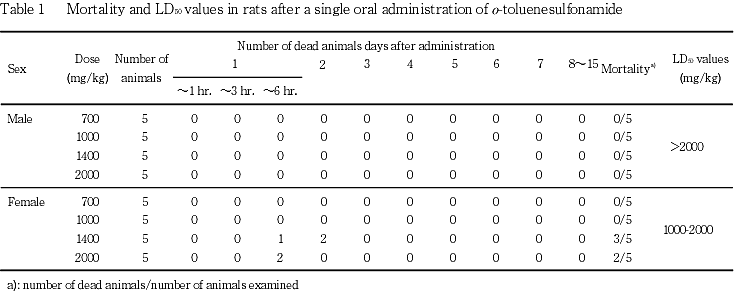
その結果,雄では死亡例はみられなかったが,雌では1400 mg/kg投与群で3例,2000 mg/kg投与群では2例が死亡した.雌雄ともに全群で,投与直後から鎮静,脱力,側臥位,刺激に対し無反応,呼吸促迫,呼吸数減少,体温低下,カタレプシー等の強い毒性症状がみられた.
体重推移において,雄では観察第2日に1400および2000 mg/kg投与群で体重増加が抑制される傾向がみられたが,観察第11日では全ての投与群で差はみられなかった.雌では全ての投与群で観察第2日に軽度の体重減少あるいは増加抑制がみられたが,その後生存例においてはいずれも体重は増加した.
死亡例の剖検所見においては,死因につながる様な被験物質による器質的変化が認められなかったことから,死亡の主要因は強い中枢抑制作用ではないかと推定された.
これらのことより,o-トルエンスルホンアミドの本試験条件下におけるLD50値は,雌では1000〜2000 mg/kgの間にあり,雄では2000 mg/kgを上回ると推定された.
調製においては,各濃度毎に被験物質を秤量し,0.5 w/v% CMC Na水溶液(日本薬局方カルメロースナトリウム,製造番号:6Z09,丸石製薬(株),および日本薬局方注射用水,製造番号:9707SA,光製薬(株),を用いて調製)を加えて攪拌して懸濁液とした.なお,1.00および200 mg/mLの被験物質を0.5 w/v% CMC Na水溶液で調製した懸濁液は,冷蔵・遮光の条件下で8日間は安定であり,また,投与検体中の平均含量は,所定濃度内であることを確認した.
その結果,1000 mg/kg投与群では体温低下,呼吸緩徐等の症状は認められるものの,死亡はみられなかった.以上より,本試験では,700,1000,1400および2000 mg/kg投与群を設定した.
投与容量は,体重1 kg当たり10 mLとし,投与液量は投与前約18時間絶食させた後,投与直前に測定した体重を基に算出し,ラット用胃管を用いて強制的に単回経口投与した.
給餌は投与後4時間に再開した.

雌では,700および1000 mg/kg投与群ともに投与後2時間以降において刺激に対して無反応の個体が現れ,さらにカタレプシーがみられ,ほぼ投与後6時間までこれらが持続した.観察第2日には,700 mg/kg 投与群でよろめき歩行,排便量の減少,活動性の低下,軽い振戦が,1000 mg/kg投与群で側臥位姿勢,体温低下,呼吸数減少が観察された.1400 mg/kg投与群では,投与後2時間以降,呼吸数減少や呼吸減弱等の呼吸異常が全例で認められ,投与後6時間まで持続した.強い毒性症状を示したのは投与後3時間であった.観察第2日には,側臥位姿勢,体温低下,よろめき歩行,活動性の低下あるいは排便量の減少がみられた.2000 mg/kg投与群では,投与直後から強い毒性症状が各個体にみられ,投与後3時間でそれらの徴候はピークを示した.観察第2日には,1400 mg/kg投与群と同様の変化がみられた.
観察期間終了時屠殺例においては,いずれの動物にも被験物質投与によると考えられる異常所見は認められなかった.
雌雄ともに全群で,投与直後から鎮静,脱力,側臥位,刺激に対し無反応,呼吸促迫,呼吸数減少,体温低下,カタレプシー等の強い毒性症状がみられ,雄では死亡例はみられなかったが,雌では1400 mg/kg投与群で3例,2000 mg/kg投与群では2例が死亡した.
体重推移において,雄では観察第2日に1400および2000 mg/kg投与群で体重増加が抑制される傾向がみられ,700および1000 mg/kg投与群の中にも体重増加が抑制される個体がみられた.しかし,いずれの投与群でもその後体重は増加し,観察第11日の時点では全ての投与群で差はみられなかった.雌では全ての投与群で観察第2日に軽度の体重減少あるいは増加抑制がみられたが,その後生存例においてはいずれも体重は増加した.
死亡例の剖検所見においては,肺の赤色化,胃粘膜の白濁,左右腎臓の被膜下皮質に微小なシスト等が観察されたが,死因につながる様な被験物質による器質的変化が認められなかったことから,死亡の主要因は強い中枢抑制作用ではないかと推定された.
これらのことより,o-トルエンスルホンアミドの本試験条件下におけるLD50値は,雌では1000〜2000 mg/kgの間にあり,雄では2000 mg/kgを上回ると推定された.
| 連絡先 | |||
| 試験責任者: | 大原直樹 | ||
| 試験担当者: | 勝村英夫,高島宏昌,松本浩孝,一原佐知子,稲田浩子,永田伴子,畔上二郎,安生孝子,三枝克彦 | ||
| (財)食品薬品安全センター 秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Naoki Ohara(Study director) Hideo Katsumura, Hiromasa Takashima, Hirotaka Matsumoto, Sachiko Ichihara, Hiroko Inada, Tomoko Nagata, Jiro Azegami, Takako Anjo, Katsuhiko Saegusa | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||