試験は,指標菌株としてSalmonella typhimurium TA100,TA1535,TA98,TA1537およびEscherichia coli WP2 uvrAを用い,S9 mix非存在(直接法)および存在(代謝活性化法)下でプレインキュベーション法により行った.
用量は,用量設定試験の結果から菌の生育阻害が認められる用量を最高用量とし,直接法および代謝活性化法ともに6.25〜200 μg/plateの範囲(公比2)で設定した.
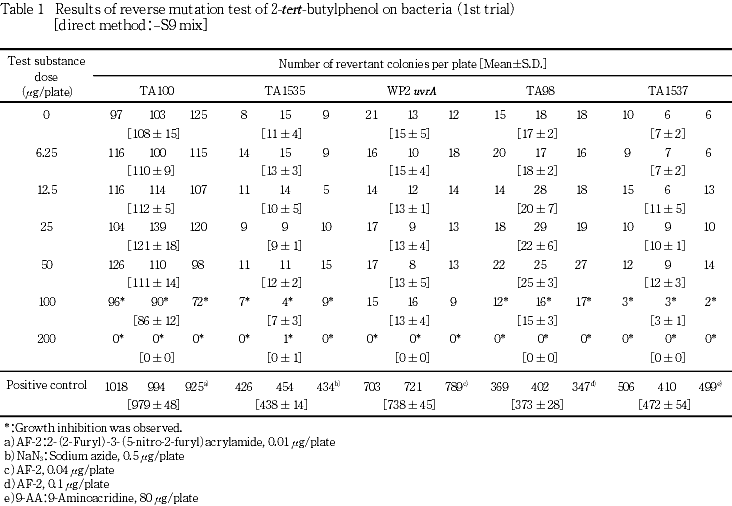
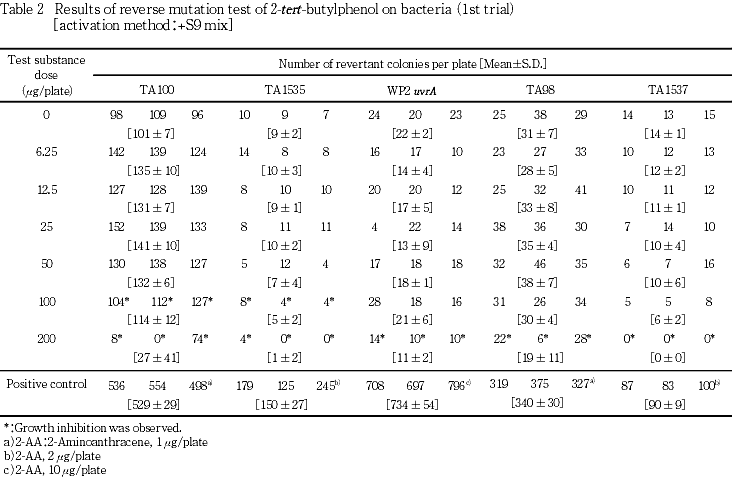
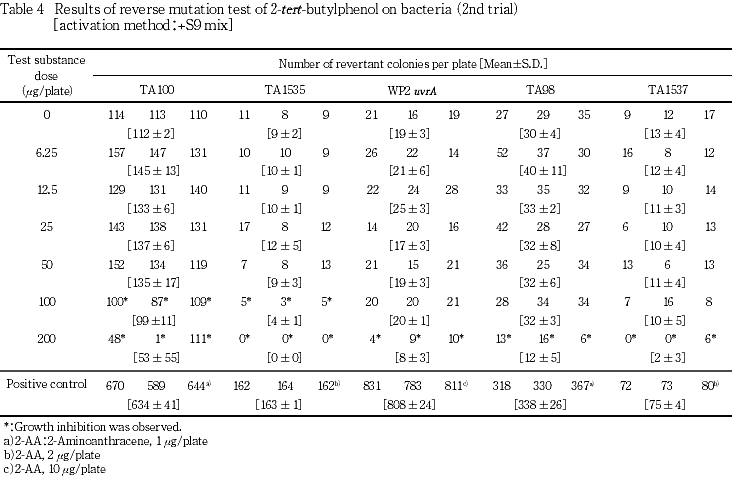
試験を2回行った結果,代謝活性化の有無にかかわらず,全ての菌株において復帰変異コロニー数の増加は認められなかった.菌の生育阻害については,直接法の場合,S. typhimuriumでは100 μg/plate以上で,WP2 uvrAでは200 μg/plate以上で認められ,代謝活性化法の場合は,TA100およびTA1535では100 μg/plate以上で,TA98,TA1537およびWP2 uvrAでは200 μg/plate以上で認められた.
以上の成績から,2-tert-ブチルフェノールの細菌に対する遺伝子突然変異誘発性は陰性と判定した.
試験に際して,各凍結菌株を解凍後,その25 μLをニュートリエントブロス(Bacto nutrient broth dehydrated, Difco Laboratories)液体培地15 mLに接種し,37 ℃で12時間振盪培養した.培養後の懸濁菌液は濁度を測定し,濁度と生菌数の換算式より1 mLあたり1 × 109以上の生菌数が得られていることを確認し,試験菌液とした.
各菌株の遺伝的特性検査は,凍結保存菌の調製時並びに各実験ごとに行い,本試験に用いた菌株が規定の特性を保持していることを確認した.
実験終了後,残余被験物質を分析した結果,安定性に問題はなかった.
| AF-2 | : | 2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド(和光純薬工業(株)) |
| 2-AA | : | 2-アミノアントラセン(和光純薬工業(株)) |
| NaN3 | : | アジ化ナトリウム(和光純薬工業(株)) |
| 9-AA | : | 9-アミノアクリジン(Aldrich Chemical Co.) |
AF-2および2-AAはDMSO(和光純薬工業(株))に,NaN3 および9-AAは蒸留水((株)大塚製薬工場)に溶解した.
| 硫酸マグネシウム・七水塩 | 0.2 g |
| クエン酸・一水塩 | 2 g |
| リン酸水素二カリウム | 10 g |
| リン酸一アンモニウム | 1.92 g |
| 水酸化ナトリウム | 0.66 g |
| グルコース | 20 g |
| 寒天(OXOID Agar No. 1) | 15 g |
試験管に使用溶媒,被験物質供試液あるいは陽性対照物質溶液を0.1 mL入れ,次いで直接法では0.1 Mリン酸ナトリウム緩衝液(pH 7.4)を0.5 mL,代謝活性化法ではS9 mixを0.5 mL加え,続いて試験菌液0.1 mLを分注し,37 ℃で20分間振盪培養した.培養終了後,45 ℃に保温したトップアガー2 mLを加えた混合液をプレート上に重層した.37 ℃で48時間培養後,復帰変異コロニーを計数し,同時に指標菌株の生育阻害の有無を実体顕微鏡を用いて観察した.プレートは,用量設定試験では各用量とも1枚,本試験では3枚を使用した.本試験は,同一用量を用いて2回行った.
但し,明確な用量依存性が認められない場合においても,陽性値を示す試験結果に再現性が認められれば陽性と判定することとした.
試験を2回行った結果(Tables 1〜4),直接法および代謝活性化法のいずれの場合も,供試した全ての菌株において復帰変異コロニー数は,溶媒対照値の2倍を越えることはなかった.菌の生育阻害については直接法の場合,S. typhimuriumでは100 μg/plate以上で,WP2 uvrAでは200 μg/plateで認められ,代謝活性化法の場合は,TA100およびTA1535では100 μg/plate以上で,TA98,TA1537およびWP2 uvrAでは200 μg/plateで認められた.
以上の成績から,本実験条件下では,2-tert-ブチルフェノールの遺伝子突然変異誘発性は陰性と判定した.
2-tert-ブチルフェノールの類縁化合物である4-tert-ブチルフェノール3, 4),2-sec-ブチルフェノール5, 6),4-sec-ブチルフェノール7),2,4-ジ-tert-ブチルフェノール8),2,6-ジ-tert-ブチルフェノール3),2,4,6-トリ-tert-ブチルフェノール9),6-tert-ブチル-m-クレゾール10),4,4'-チオビス(6-tert-ブチル-m-クレゾール)11)および2,2'-メチレンビス(6-tert-ブチル-ρ-クレゾール)12)は,いずれもS. typhimuriumおよびE. coli,またはS. typhimuriumを用いた復帰変異試験で陰性と報告されている.また,4-tert-ブチルフェノールおよび2,6-ジ-tert-ブチルフェノールにおいては酵母を用いた遺伝子突然変異試験でも陰性3)と報告されている.


| 1) | D. M. Maron, B. N. Ames, Mutat. Res., 113, 173(1983). |
| 2) | M. H. L. Green, “Handbook of Mutagenicity Test Procedures,” 1, Vol. 3, eds. by B. J. Kilbey, M. Legator, W. Nichols, C. Ramel, Elsevier, Amsterdam, New York, Oxford, 1984, pp.161-187. |
| 3) | B. J. Dean, T. M. Brooks, G. Hadson-Walker, D. H. Hutson, Mutat. Res., 153, 57(1985). |
| 4) | 澁谷徹,坂本京子,川上久美子,原巧,堀谷尚古,松木容彦,中込まどか,飯田さやか,化学物質毒性試験報告,4, 295(1996). |
| 5) | K. Mortelmans, S. Haworth, T. Lawlor, W. Speck, B. Tainer, E. Zeiger, Environ. Mutagen., 8(suppl.7), 1(1986). |
| 6) | 野田篤,昆尚美,化学物質毒性試験報告,7, 227(1999). |
| 7) | 澁谷徹,坂本京子,原巧,加藤基恵,石原尚古,川上久美子,松木容彦,北嶋美似子,化学物質毒性試験報告,2, 343(1995). |
| 8) | 野田篤,昆尚美,化学物質毒性試験報告,8, 387(2001). |
| 9) | 石館基監修,“微生物を用いる変異原性試験データ集,”エル・アイ・シー,東京,1991, pp.560-561. |
| 10) | 野田篤,昆尚美,化学物質毒性試験報告,7, 195(1999). |
| 11) | 澁谷徹,原巧,坂本京子,川上久美子,清水ゆり,松木容彦,中込まどか,中尾美津男,飯田さやか,化学物質毒性試験報告,4, 239(1996). |
| 12) | 澁谷徹,原巧,坂本京子,川上久美子,清水ゆり,松木容彦,中込まどか,中尾美津男,飯田さやか,化学物質毒性試験報告,4, 423(1996). |
| 連絡先 | |||
| 試験責任者: | 野田 篤 | ||
| 試験担当者: | 野田 篤,昆 尚美 | ||
| (財)畜産生物科学安全研究所 | |||
| 〒229-1132 神奈川県相模原市橋本台3-7-11 | |||
| Tel 042-762-2775 | Fax 042-762-7979 | ||
| Correspondence | ||||
| Authors: | Atsushi Noda(Study director) Naomi Kon | |||
| Research Institute for Animal Science in Biochemistry and Toxicology 3-7-11 | ||||
| Hashimotodai, Sagamihara-shi, kanagawa, 229-1132 Japan | ||||
| Tel +81-42-762-2775 | Fax +81-42-762-7979 | |||