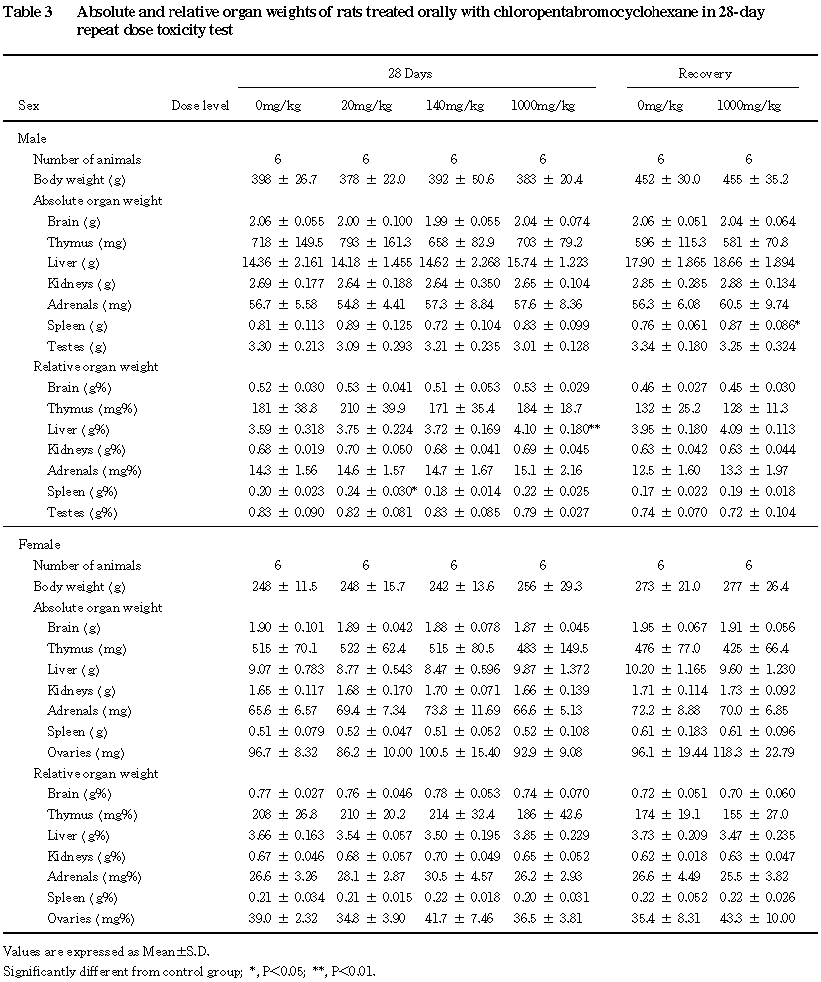
1000 mg/kg/day群の雄において,肝臓の相対重量の増加がみられ,また腎臓の尿細管上皮の硝子滴出現が多く認められた.これらはいずれも回復期間終了時には回復した.その他,全観察期間を通して死亡は認められず,一般状態,体重,摂餌量,血液学検査および尿検査でも被験物質投与に起因した変化は認められなかった.
以上の結果より,本試験条件下におけるクロロペンタブロモシクロヘキサンの無影響量は雄で 140 mg/kg/day,雌で1000 mg/kg/dayと考えられる.
検疫・馴化期間を含めた全飼育期間中,温度 20〜25℃,湿度40〜70%,換気約12回/時,照明12時間(7:00〜19:00)に自動調節された飼育室を使用した.動物は,実験動物用床敷(ベータチップ:日本チャールス・リバー(株))を敷いたポリカーボネート製ケージに1ケージ当り2匹で収容し飼育した.
動物には,実験動物用固型飼料 (MF:オリエンタル酵母工業(株))および5 μmのフィルター濾過後,紫外線照射した水道水を,それぞれ自由摂取させた.
被験物質は 28日間毎日1回,午前中に胃ゾンデを用いて強制経口投与した.投与液量は10 ml/kgとし,至近測定日の体重を基に算出した.対照群には同様に溶媒を投与した.
 法),カルシウム(O-CPC法),無機リン(UV法),GOT (SSCC改良法),GPT (SSCC改良法),γ-GTP (SSCC改良法),ALP (GSCC改良法),ナトリウム,カリウム,クロール(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
法),カルシウム(O-CPC法),無機リン(UV法),GOT (SSCC改良法),GPT (SSCC改良法),γ-GTP (SSCC改良法),ALP (GSCC改良法),ナトリウム,カリウム,クロール(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
投与終了時解剖動物の対照および 1000 mg/kg群の雌雄の心臓,肝臓,脾臓,腎臓,副腎を対象に,常法に従いヘマトキシリン・エオジン染色標本を作製し,鏡検した.
その結果,雄の腎臓に被験物質投与に起因した変化が認められたので,投与終了時の他の群と回復終了時の雄全例の腎臓についても同様に検査を実施した.また,肉眼的に変化のみられた投与期間終了時の 1000 mg/kg群の雄1例の甲状腺と回復期間終了時の1000 mg/kg群の雌1例の胃についても同様に検査した.
 法により平均値の比較検定を行った.分散が一様でない場合にはKruskal-Wallisの検定を行い,Dunnett型またはScheff
法により平均値の比較検定を行った.分散が一様でない場合にはKruskal-Wallisの検定を行い,Dunnett型またはScheff 型の順位和検定を行った.尿検査で得られた計数データについては,Armitageのχ^2検定を用いた.有意水準は5%以下とした.
型の順位和検定を行った.尿検査で得られた計数データについては,Armitageのχ^2検定を用いた.有意水準は5%以下とした.
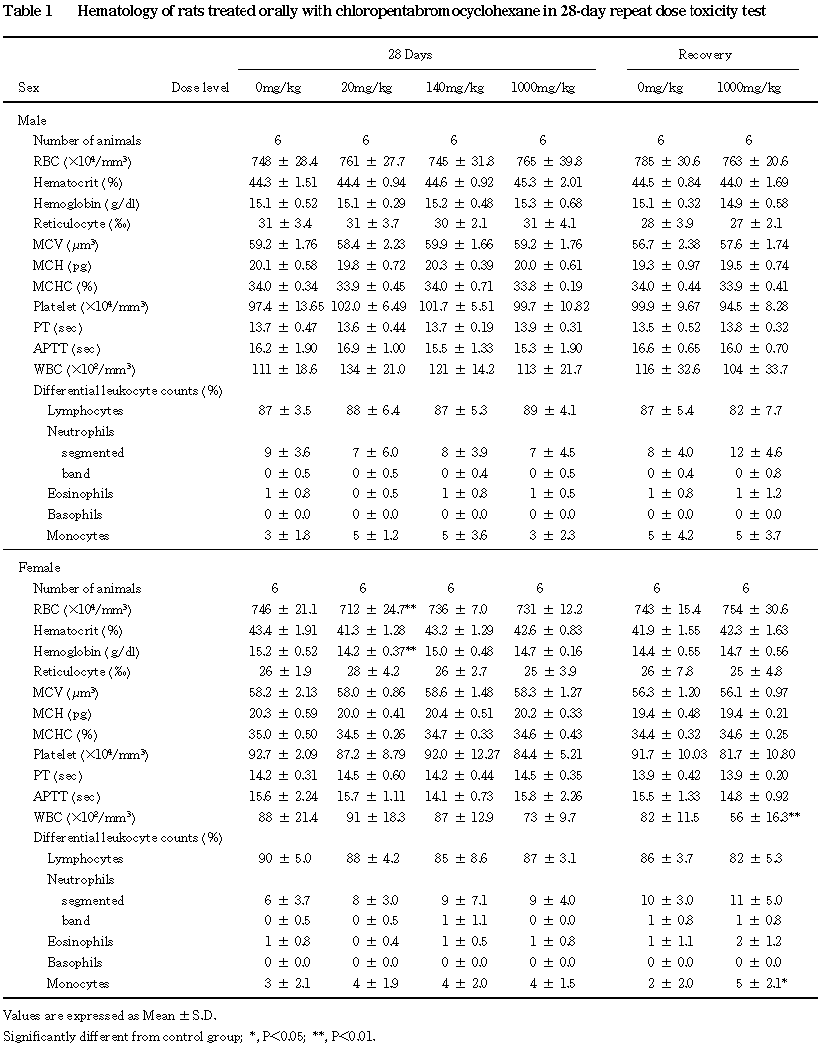
なお,投与期間終了時の検査において,赤血球数およびヘモグロビン濃度の減少が 20 mg/kg群の雌でみられたが,140および1000 mg/kg群では認められなかったことから,被験物質投与とは関連のない偶発的変化と判断した.また,回復期間終了時の検査において白血球数の減少および白血球百分率単球比の増加が1000 mg/kg群の雌で認められたが,軽微な変化であり,かつ投与期間終了時には認められていないことから,被験物質投与とは関連のない偶発的変化と判断した.

その他,投与期間終了時の検査において, 20 mg/kg群の雌で総タンパク質およびアルブミンの減少がみられたが,140および1000 mg/kg群では認められなかったことから,被験物質投与とは関連のない偶発的変化と判断した.また,回復期間終了時の検査において,無機リンの減少が1000 mg/kg群の雌で認められたが,軽微な変化であり,かつ投与期間終了時には認められていないことから,被験物質投与とは関連のない偶発的変化と判断した.
その他,投与期間終了時の検査において,脾臓の相対重量の増加が 20 mg/kg群の雄でみられたが,140および1000 mg/kg群では認められなかったことから,被験物質投与の影響ではないと判断した.また,回復期間終了時の検査において脾臓重量の増加が1000 mg/kg群の雄でみられたが,軽微な変化であり,かつ投与期間終了時には認められていないことから,被験物質投与とは関連のない偶発的変化と判断した.
被験物質投与とは関連のない偶発病変として,両側あるいは片側腎臓ののう胞,片側腎臓の腎盂拡張,腺胃粘膜のびらんおよび甲状腺の白色斑が,いずれも各 1例に認められた.
腎臓の尿細管上皮の硝子滴出現の程度が 1000 mg/kg群の雄でやや増加していた.すなわち,軽度の変化が対照,20,140および1000 mg/kg群の6,6,5および1例に,中等度の変化が1000 mg/kg群の5例に認められた.中等度の変化は軽度な変化に比べ大きな硝子滴が多数,より広い範囲の近位尿細管上皮に認められた.なお,肉眼的に腎臓の褪色がみられた140および1000 mg/kg群の雄の各1例では,硝子滴出現が認められたが,いずれも軽度な変化であった.
回復期間終了時の検査において,腎臓の尿細管上皮の硝子滴は,対照および 1000 mg/kg群の雄のほぼ全例に認められたが,いずれも軽度な変化であり両群に程度の差はなかった.
その他,対照あるいは被験物質投与群で種々の変化が認められたが,その発現状況には用量との関連はなく,被験物質投与とは無関係と考えられた.なお,剖検時に認められた片側腎臓ののう胞は組織検査では確認できなかった.また,甲状腺の白色斑は正常なリンパ組織であり,甲状腺実質に異常は認められなかった.
1000 mg/kg/day群の雄の腎臓において,尿細管上皮の硝子滴出現が多く認められた.尿細管上皮の硝子滴出現は,雄ラットでは自然発生的に発現する変化であるが,種々の薬物および化学物質投与によって増強されることも良く知られている1).硝子滴中にはα2uグロブリンが蓄積することからα2uグロブリン腎症と呼ばれ,雄に特異的に発現する変化である2).今回の試験において認められた変化は,雄のみに発現していること,近位尿細管上皮に発現していることから,これに類似した変化と考えられる.しかし,回復期間終了時の検査においては,上述した硝子滴の出現は対照群と同程度にまで軽減しており,明らかに回復していた.また,同群の雄に肝臓の相対重量の増加が認められたが,回復期間終了時には消失していた.なお,腎臓の褪色が140および1000 mg/kg/day群の雄の各1例に認められたが,この変化は上述の尿細管上皮の硝子滴とは無関係に出現しており,放血の良悪による人為的な変化と考えられ,被験物質投与の影響ではないと判断した.また,雌についてはいずれの投与群においても被験物質投与に起因した病理学的変化は認められなかった.
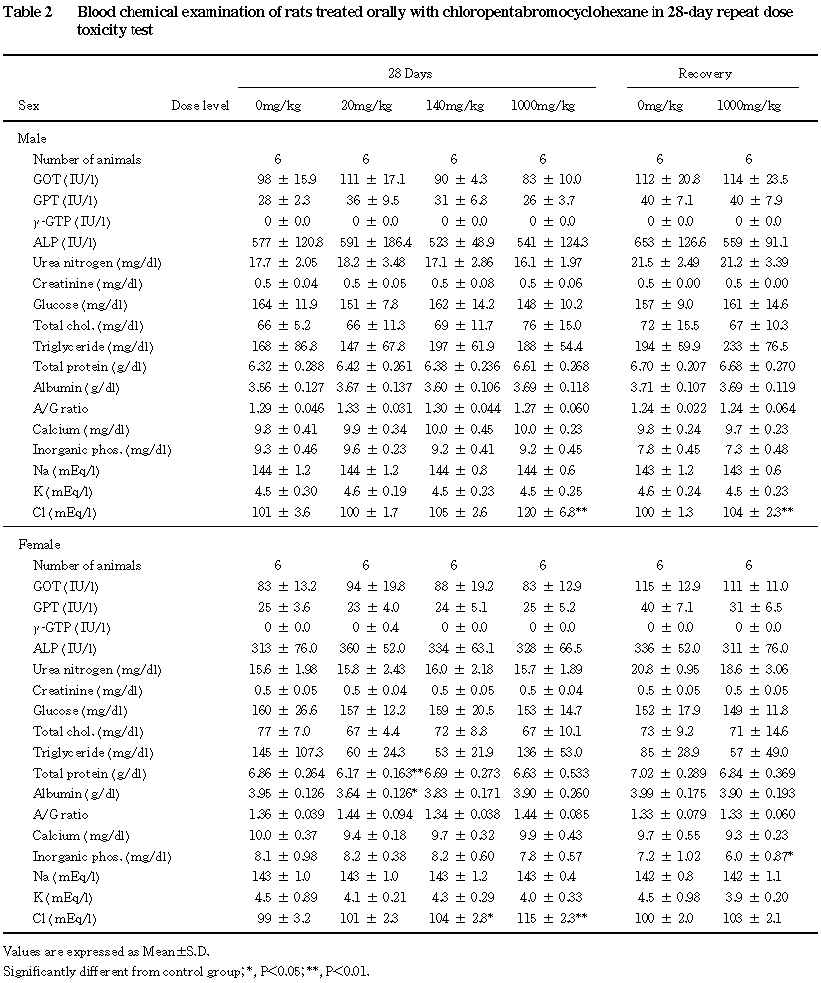
血液生化学検査においてクロールの増加が認められた.本試験ではクロールの測定にイオン選択電極法を用いたが,この方法は臭素イオン等によって影響を受ける 3)ことが知られている.血中の臭素イオン濃度をイオン交換カラムを用いたHPLC法にて測定したところ,1000 mg/kg/day群においてその増加が確認された.従って,今回認められたクロールの増加は臭素イオンが測定系に影響を及ぼしたもので,実際の血中クロールが増加したのではないと判断した.
その他,全観察期間を通して死亡は認められず,被験物質投与に起因した症状も認められなかった.また,体重,摂餌量,血液学検査および尿検査の各項目において被験物質投与に起因すると考えられる変化は認められなかった.
以上の結果から,本試験条件下におけるクロロペンタブロモシクロヘキサンの無影響量は,雄で 140 mg/kg/day,雌で1000 mg/kg/dayと考えられる.
| 1) | P. Greaves, "Histopathology of preclinical toxicity studies," Elisevier, Amsterdum, 1990, pp. 532-538. |
| 2) | J. A. Swenberg, B. Short, S. Borghoff, J. Strasser, and M. Charbonneau, Toxicol. Appl. Pharmacol., 97, 35 (1989). |
| 3) | 菅原研之,緒方隆之,後藤 剛,梅本雅夫, "第2回日本臨床化学会関東支部学術例会講演集," 日本臨床化学会関東支部,東京,1992,pp.10-14. |
| 連絡先 | |||
| 試験責任者: | 平塚 秀明 | ||
| 試験担当者: | 大保真由美,塚本友美,土谷 稔, 涌生ゆみ,豊田直人,高野克代, 鈴木美江 | ||
| (株)三菱化学安全科学研究所 鹿島研究所 | |||
| 〒314-02 茨城県鹿島郡波崎町砂山14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence | |||
| Authors: | Hideaki Hiratsuka(Study director) Mayumi Ohbo, Tomomi Tsukamoto, Minoru Tsuchitani, Yumi Wako, Naoto Toyota, Katsuyo Takano, Yoshie Suzuki | ||
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory | |||
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-02 Japan | |||
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | ||