7-アミノ-4-ヒドロキシ-2-ナフタレンスルホン酸の
ラットを用いる
28日間反復経口投与毒性試験
Twenty-eight-day Repeat Dose Oral Toxicity Test of
7-Amino-4-hydroxy-2-naphthalenesulfonic acid in Rats
要 約
スルホン酸系化合物の毒性は一般に弱く,
LD50値は1000 mg/kg以上で,多くの化合物では5000 mg/kgを上回ると報告されている1).7-アミノ-4-ヒドロキシ-2-ナフタレンスルホン酸についても,ラットでのLD50値は5000 mg/kgを上回ると言われているが,反復投与に関する報告はみあたらない1).
今回,
OECDによる既存化学物質の安全性点検に係わる毒性試験の一環として,7-アミノ-4-ヒドロキシ-2-ナフタレンスルホン酸の0(対照),250,500および1000 mg/kg/dayを1群雌雄各6匹のSprague-Dawley系(Crj:CD)ラットに28日間反復経口投与する毒性試験を実施し,以下の結果を得た.なお,対照群および1000 mg/kg群にはそれぞれ雌雄各6匹の14日間回復群も設けた.
一般状態,体重,摂餌量,尿検査,血液学検査,血液生化学検査,器官重量,剖検および病理組織学検査のいずれにおいても投与に起因した変化はみられず,本試験条件下における無影響量は雌雄ともに
1000 mg/kg/dayと考えられた.
方 法
1.被験物質および投与液の調製
7-アミノ-4-ヒドロキシ-2-ナフタレンスルホン酸(純度91.8 wt%,Lot No.0901,スガイ化学工業(株)提供)は,水およびアセトンにほとんど不溶の灰白色粉末であり,水,熱,光などにほぼ安定である.入手後の被験物質は室温,遮光下で保管し,投与終了後の分析により被験物質が試験期間中安定であったことを確認した.媒体にはアラビアゴム(和光純薬工業(株),Lot No.PTG0424)の5%水溶液を使用し,これに被験物質を2.5,5および10 w/v%濃度になるように懸濁して投与液を調製した.調製した投与液は室温,遮光下で保管した.なお,初回調製時に,投与液の濃度を測定し,設定値の±10%以内にあることを確認した.また,投与開始前に,本調製法による0.1,1および10 w/v%懸濁液が室温,遮光下で調製後11日間安定であり,かつ均一性についても問題ないことを確認した.
2.使用動物および飼育条件
5週齢のSprague-Dawley系ラット(Crj:CD,日本チャールス・リバー(株))を雌雄各45匹購入し,8日間の検疫馴化を行ったのち,雌雄各36匹を選んで6週齢で試験に使用した.投与開始時の体重は,雄が208.4〜228.6 g,雌が137.6〜165.0 gであった.動物は,温度24±2℃,湿度55±10%,照明時間7時〜19時および換気回数13回/時に設定したバリアーシステム飼育室でステンレススチール製ハンガーケージに,検疫馴化期間中は1ケージ当たり3匹ずつ,群分け後は個別に収容して,高圧蒸気滅菌処理した固型飼料(MF,オリエンタル酵母工業(株))および次亜塩素酸ナトリウムを添加(約2 ppm)した水を自由に摂取させた.
3.投与量,投与方法,試験群構成および群分け
投与量は,
2週間反復投与による予備試験(投与量:0,250,500および1000 mg/kg)の結果から設定した.すなわち,当該試験において1000 mg/kg投与でも被験物質による毒性発現がなかったことから,本試験での投与量は,化審法ガイドラインに準じて1000 mg/ kgを高用量とし,以下500および250 mg/kgの計3用量を設定した.
投与経路は経口とし,胃管を用いた強制投与を
1日1回,28日間反復して行った.投与容量は10 ml/kgとし,個体ごとに最新の体重を基に算出した.
試験群は,上記
3用量に,5%アラビアゴム水溶液を投与する対照を加えて計4群とした.1群当たりの動物数は,投与期間終了時の剖検例として各群とも雌雄各6匹,さらに,対照群および1000 mg/kg群には14日間の回復期間終了時の剖検例として雌雄各6匹を設けた.群分けは,投与開始前日の体重を基に層別連続無作為化法で行った.
4.検査項目
1)一般状態の観察,体重および摂餌量の測定
投与期間中は毎日投与前および投与後の計
2回,回復期間中は毎日午前および午後の計2回,一般状態および死亡の有無を観察した.また,体重および摂餌量を投与期間および回復期間を通して週2回の割合で測定した.
2)尿検査
投与
4週目および回復2週目に,代謝ケージにて絶食,給水下で8時から12時までの間に採取した新鮮尿を用いて,比色試験紙(プレテスト8 a,和光純薬工業(株))によりpH,蛋白質,ブドウ糖,ケトン体,ビリルビン,潜血およびウロビリノーゲンを検査した.さらに,新鮮尿を1500回転/分で5分間遠心分離し,得られた尿沈渣について鏡検した.また,新鮮尿採取後に給餌,給水下で採取した24時間蓄積尿を用いて,尿量,色調,浸透圧(氷点降下法;OSMOMETER OM801,VOGEL社)および比重(屈折率法;尿屈折計,(株)アタゴ)を測定した.
3)血液学検査
投与期間終了時および回復期間終了時に,動物を
18時間以上絶食させたのち,ペントバルビタール・ナトリウム麻酔下に開腹し,腹部大静脈から採血を行った.採取した血液の一部はEDTA-2Kで処理し,多項目自動血球計数装置(Sysmex CC-780,東亜医用電子(株))により白血球数(電気抵抗検出方式),赤血球数(電気抵抗検出方式),ヘモグロビン量(オキシヘモグロビン法),ヘマトクリット値(血球パルス波高値検出方式)および血小板数(電気抵抗検出方式)を測定し,これらを基に平均赤血球容積(MCV),平均赤血球血色素量(MCH)および平均赤血球血色素濃度(MCHC)を算出した.また,血液の一部は塗抹標本とし,May-Gr nwald-Giemsa染色を施して白血球百分比を視算した.さらに,3.8%クエン酸ナトリウム加血液を3000回転/分で15分間遠心分離し,得られた血漿を用いて全自動血液凝固測定装置(Sysmex CA-5000,東亜医用電子(株))により,プロトロンビン時間(散乱光検出方式)および活性化部分トロンボプラスチン時間(散乱光検出方式)を測定した.
nwald-Giemsa染色を施して白血球百分比を視算した.さらに,3.8%クエン酸ナトリウム加血液を3000回転/分で15分間遠心分離し,得られた血漿を用いて全自動血液凝固測定装置(Sysmex CA-5000,東亜医用電子(株))により,プロトロンビン時間(散乱光検出方式)および活性化部分トロンボプラスチン時間(散乱光検出方式)を測定した.
4)血液生化学検査
血液学検査に引き続き採取した血液を室温で約
60分間放置後,3000回転/分で10分間遠心分離し,得られた血清を用いて自動分析装置(736-10,(株)日立製作所)により,総蛋白質(ビウレット法),アルブミン(BCG法),A/G比(総蛋白質およびアルブミンより算出),総ビリルビン(アルカリアゾビリルビン法),GOT(Karmen法),GPT(Wr blewski-La Due法),γ-グルタミルトランスペプチダーゼ(L-γ-グルタミル-DBHA基質法),アルカリ性フォスファターゼ(p-ニトロフェニルリン酸基質法),総コレステロール(COD-DAOS法),トリグリセライド(GPO-DAOS法・グリセリン消去法),リン脂質(酵素法・DAOS発色法),グルコース(グルコキナーゼ・G-6-PDH法),尿素窒素(ウレアーゼ-GlDH法),クレアチニン(Jaff
blewski-La Due法),γ-グルタミルトランスペプチダーゼ(L-γ-グルタミル-DBHA基質法),アルカリ性フォスファターゼ(p-ニトロフェニルリン酸基質法),総コレステロール(COD-DAOS法),トリグリセライド(GPO-DAOS法・グリセリン消去法),リン脂質(酵素法・DAOS発色法),グルコース(グルコキナーゼ・G-6-PDH法),尿素窒素(ウレアーゼ-GlDH法),クレアチニン(Jaff 法),無機リン(モリブデン酸直接法)およびカルシウム(OCPC法)を測定した.また,電解質分析装置(PVA-αIII,(株)アナリティカル・インスツルメンツ)によりナトリウム(電極法),カリウム(電極法)およびクロール(電量滴定法)を測定した.
法),無機リン(モリブデン酸直接法)およびカルシウム(OCPC法)を測定した.また,電解質分析装置(PVA-αIII,(株)アナリティカル・インスツルメンツ)によりナトリウム(電極法),カリウム(電極法)およびクロール(電量滴定法)を測定した.
5)器官重量の測定,剖検および病理組織学検査
採血終了後に,外側腸骨動脈を切断して放血死させ,剖検した.剖検時に脳,心臓,肺
(気管支を含む),胸腺,肝臓,脾臓,腎臓,副腎,精巣および卵巣を摘出して器官重量(絶対重量)を測定するとともに,剖検日の体重を基に体重比器官重量(相対重量)を算出した.これらの器官に加え,下垂体,脊髄,眼球,甲状腺(上皮小体を含む),膵臓,胃,膀胱,大腿骨(骨髄を含む)および肉眼的異常部位を採取して10%中性緩衝ホルマリン溶液(眼球はグルタールアルデヒド溶液,精巣はブアン液で前固定)で固定した.
投与期間終了時の対照群および
1000 mg/kg群の肝臓,脾臓,心臓,腎臓,副腎および肉眼的異常部位については,常法に従ってパラフィン切片を作製し,ヘマトキシリン・エオジン(HE)染色を施して光学顕微鏡下で観察した.
5.統計処理
体重,摂餌量,尿検査
(定性反応は除く),血液学検査,血液生化学検査,器官重量および体重比器官重量について,各群ごとに平均値と標準偏差を求め,Bartlett法により分散の均一性を検定した.分散が均一な場合は一元配置型の分散分析を行い,この解析で群間に有意差が認められた場合はDunnett法により各群の一対比較検定を行った.分散が均一でない場合はKruskal-Wallis法によって順位検定を行い,この検定で群間に有意差が認められた場合はDunnett型の一対比較検定を行った.上述の分散分析あるいは Kruskal-Wallis法による順位検定で群間に有意差が認められなかった場合は,各群間の多重比較は行わなかった.なお,いずれの場合も有意水準は5%とした.
結果および考察
1.一般状態
投与
4週目に,1000 mg/kg群の雄1例で上顎切歯先端部の欠損がみられたが,偶発的変化と考えられた.このほかには一般状態に変化はなかった.
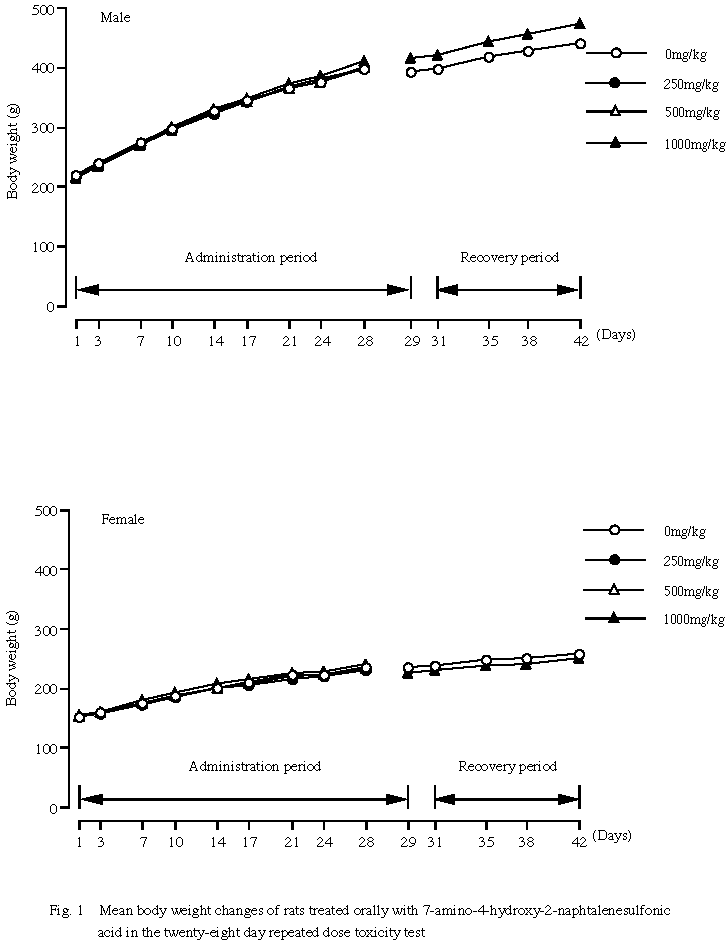
2.体重(Fig.1)および摂餌量
体重では,投与期間および回復期間を通して,対照群と各投与群との有意な差は認められなかった。
摂餌量では,投与
4週目に1000 mg/kg群の雄で一過性の摂餌量の増加がみられたが,軽微な変動であり,毒性学的意義はないものと考えられた.
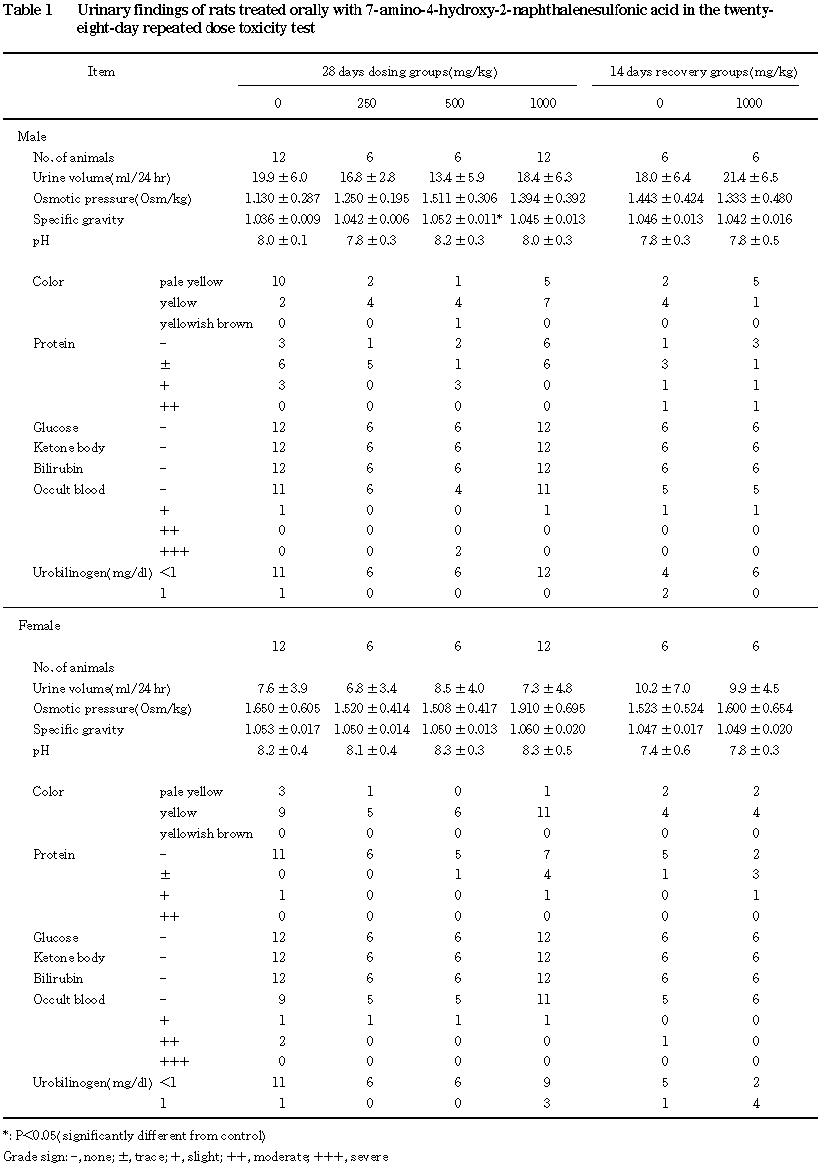
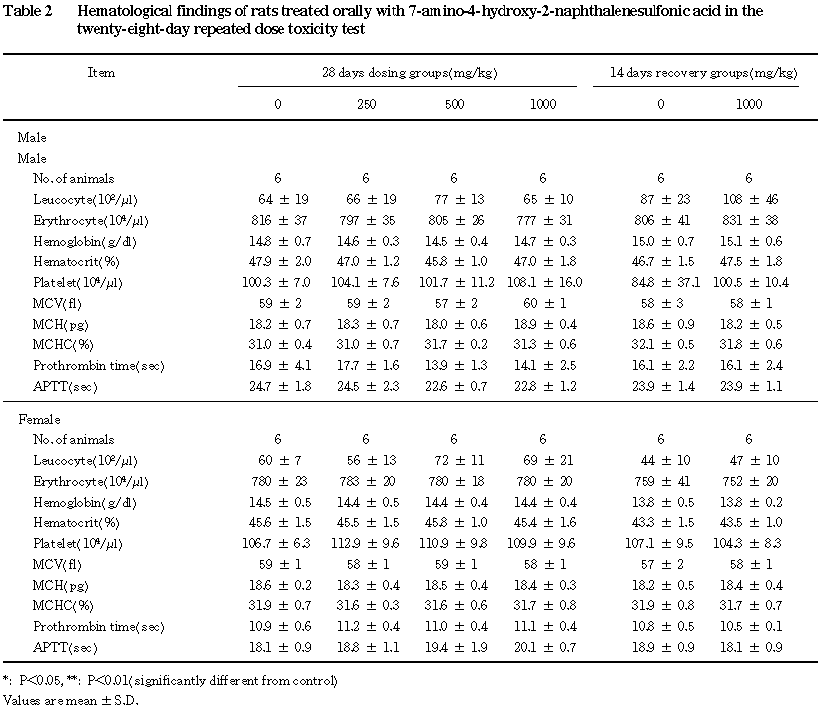
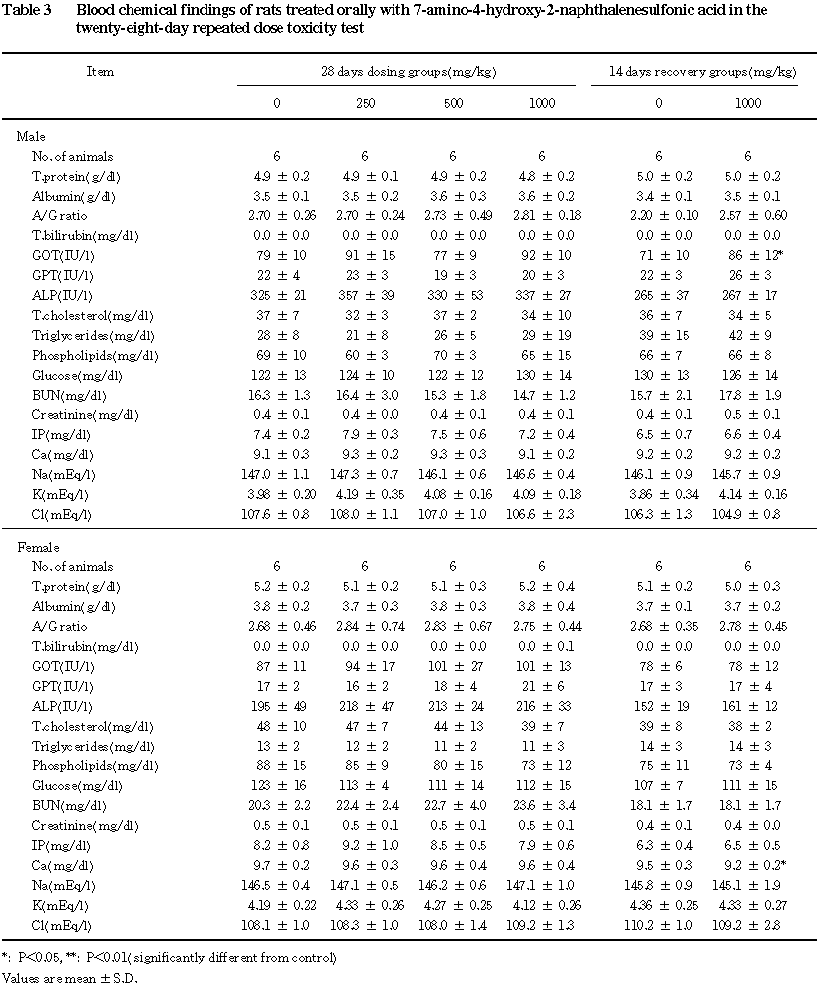
3.尿検査(Table 1),血液学検査(Table 2)および血液生化学検査(Table 3)
尿検査では,投与
4週目に500 mg/kg群の雄で尿比重の軽微な上昇がみられたのみであった.
血液学検査では,投与期間終了時および回復期間終了時ともに変化はなかった.
血液生化学検査では,投与期間終了時に変化はなく,回復期間終了時のみの軽微な変化として,
1000 mg/kg群の雄でGOTの上昇,同群の雌でカルシウムの減少が認められた.
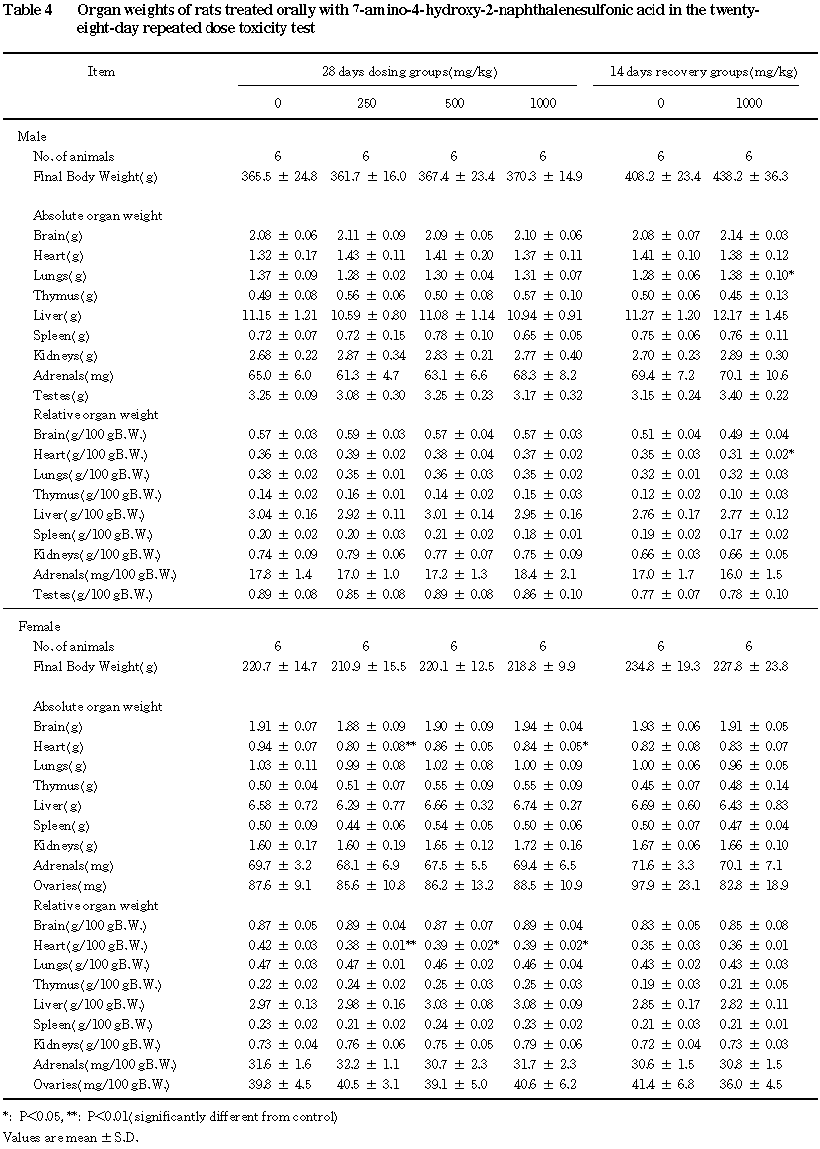
4.器官重量(Table 4)
投与期間終了時に,全投与群の雌で心臓の相対重量の減少がみられた.また,このうち
250および1000 mg/kg群では心臓の絶対重量の減少がみられ,500 mg/kg群の雌でも同様の傾向が認められた.しかし,いずれも軽微な変動であり,投与量と変化の程度に一定の傾向がないことから,投与とは関連のない偶発的な変動と考えられた.
回復期間終了時には,
1000 mg/kg群の雄で肺の絶対重量の増加および心臓の相対重量の減少がみられた.
5.剖検および病理組織学検査
投与期間終了時の剖検では,
1000 mg/kg群の雄1例で右腎臓に単発性の灰白色斑および軽度の腎盂拡張が認められた.右腎臓の同程度の腎盂拡張は250 mg/kg群の雄2例でもみられ,このうち1例には左精巣の軽度萎縮も認められた.これらの病理組織学検査では,腎臓に腎盂拡張がみられ,このうち1000 mg/kg群の雄1例には限局性の近位尿細管上皮の好塩基性化,遠位尿細管の拡張および間質へのリンパ球浸潤,並びに乳頭部の石灰沈着も認められた.また,精巣は病理組織学検査でも萎縮が確認された.これらの変化は,正常ラットでしばしば観察される変化であり,その出現頻度にも投与量との関連がなかったことから,いずれも自然発生の変化と考えられた.このほかには投与期間終了時に肉眼的および病理組織学的変化は観察されなかった.
回復期間終了時の剖検では,変化はみられなかった.
以上のことから,
7-アミノ-4-ヒドロキシ-2-ナフタレンスルホン酸投与に起因した変化はいずれの検査においてもみられず,本試験条件下での無影響量は雌雄ともに1000 mg/kg/dayと考えられた.
文献
| 1) | H. Greim, et al., Chemosphere, 28, 2203,(1994). |
| 連絡先 |
| 試験責任者: | 浜村 政夫 |
| 試験担当者: | 大塚辰雄,古川浩美,幸 邦憲,永井憲児,一鬼 勉,鍬先惠美子,津崎慎二 |
| (株)パナファーム・ラボラトリーズ 安全性研究所 |
| 〒869-04 熊本県宇土市栗崎町1285 |
| Tel 0964-23-5111 | Fax 0964-23-2282 | |
| Correspondence |
| Authors: | Masao Hamamura(Study director)
Tatsuo Otsuka,
Hiromi Furukawa,
Kuninori Yuki,
Kenji Nagai,
Tsutomu Ichiki,
Emiko Kuwasaki,
Shinji Tsusaki |
| Panapharm Laboratories Co., Ltd., Safety Assessment Laboratory |
| 1285 Kurisaki-machi, Uto-shi, Kumamoto, 869-04, Japan |
| Tel +81-964-23-5111 | Fax +81-964-23-2282 | |

 nwald-Giemsa染色を施して白血球百分比を視算した.さらに,3.8%クエン酸ナトリウム加血液を3000回転/分で15分間遠心分離し,得られた血漿を用いて全自動血液凝固測定装置(Sysmex CA-5000,東亜医用電子(株))により,プロトロンビン時間(散乱光検出方式)および活性化部分トロンボプラスチン時間(散乱光検出方式)を測定した.
nwald-Giemsa染色を施して白血球百分比を視算した.さらに,3.8%クエン酸ナトリウム加血液を3000回転/分で15分間遠心分離し,得られた血漿を用いて全自動血液凝固測定装置(Sysmex CA-5000,東亜医用電子(株))により,プロトロンビン時間(散乱光検出方式)および活性化部分トロンボプラスチン時間(散乱光検出方式)を測定した.
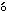 blewski-La Due法),γ-グルタミルトランスペプチダーゼ(L-γ-グルタミル-DBHA基質法),アルカリ性フォスファターゼ(p-ニトロフェニルリン酸基質法),総コレステロール(COD-DAOS法),トリグリセライド(GPO-DAOS法・グリセリン消去法),リン脂質(酵素法・DAOS発色法),グルコース(グルコキナーゼ・G-6-PDH法),尿素窒素(ウレアーゼ-GlDH法),クレアチニン(Jaff
blewski-La Due法),γ-グルタミルトランスペプチダーゼ(L-γ-グルタミル-DBHA基質法),アルカリ性フォスファターゼ(p-ニトロフェニルリン酸基質法),総コレステロール(COD-DAOS法),トリグリセライド(GPO-DAOS法・グリセリン消去法),リン脂質(酵素法・DAOS発色法),グルコース(グルコキナーゼ・G-6-PDH法),尿素窒素(ウレアーゼ-GlDH法),クレアチニン(Jaff 法),無機リン(モリブデン酸直接法)およびカルシウム(OCPC法)を測定した.また,電解質分析装置(PVA-αIII,(株)アナリティカル・インスツルメンツ)によりナトリウム(電極法),カリウム(電極法)およびクロール(電量滴定法)を測定した.
法),無機リン(モリブデン酸直接法)およびカルシウム(OCPC法)を測定した.また,電解質分析装置(PVA-αIII,(株)アナリティカル・インスツルメンツ)によりナトリウム(電極法),カリウム(電極法)およびクロール(電量滴定法)を測定した.




