フタルイミドのラットを用いる反復経口投与毒性・生殖発生毒性併合試験
Combined Repeat Dose and Reproductive/Developmental Toxicity Screening Test of
Phthalimide by Oral Administration in Rats
要約
フタルイミドの250,500および1000 mg/kgを雄ラットに対しては交配前,交配期間および交配後の計46日間,雌ラットに対しては交配前,交配および妊娠期間,ならびに哺育3日までの期間,反復経口投与し,雌雄動物への反復投与による影響,雌雄動物の生殖および新生児の発生に及ぼす影響について反復経口投与毒性・生殖発生毒性併合試験を実施した.
雌雄動物への反復投与により,雄の一般状態,体重推移,摂餌量,尿検査,血液学検査,血液生化学検査,器官重量,剖検および病理組織学検査では,フタルイミド投与による影響は認められなかった.しかし,雌の病理組織学検査では,1000 mg/kg群で1例のみであったが肝臓に小葉周辺性脂肪化,腎臓に近位尿細管上皮の脂肪変性および胸腺の萎縮が認められた.雌の一般状態,体重推移,摂餌量,器官重量および剖検ならびに上記の1例の他には病理組織学検査でフタルイミド投与による影響は認められなかった.
以上,雄でフタルイミド投与による影響は認められなかったが,雌では1000 mg/kg群で1例のみではあったが病理組織学検査で肝臓,腎臓および胸腺に影響がみられたことから,本試験におけるフタルイミドの反復経口投与による無影響量(NOEL)は,雄で1000 mg/kg/day,雌で500 mg/kg/dayと判断した.
雌雄動物の生殖能については雄での影響はみられなかったが,雌では妊娠26日まで分娩がみられなかった500 mg/kg群の1例で左右の子宮および子宮頸部の内腔拡張がみられ,着床痕5個がみられ,早期の胚死亡と考えられた.また,病理組織学検査で肝臓に小葉周辺性脂肪化,腎臓に近位尿細管上皮の脂肪変性および胸腺の萎縮が認められた1000 mg/kg群の1例で哺育期間中に体重の減少および摂餌量の低値がみられ,同例の新生児雄9例および雌8例のうち,哺育2日に雌雄各1例が死亡し,哺育3日に雄2例,哺育4日に雄1例雌3例が不明となり,生存した新生児の体重も減少していたことから,フタルイミド投与による母体の哺育能力に及ぼす影響が示唆された,その他の雌の剖検および分娩観察で,妊娠期間,黄体数,着床数,着床率,出産児数,出産確認時生存児数および出生率に,フタルイミド投与による影響は認められなかった,
新生児では500 mg/kg群の雄で体重の低値,雌で体重,体重増加量および体重増加率に低値が認められ,1000 mg/kg群でも,雄で体重の低値,雌で体重および体重増加量の低値が認められた.新生児の生存率,一般状態および剖検では,フタルイミド投与による影響は認められなかった.
以上,雄動物の生殖能に対しては1000 mg/kg群においても影響は認められなかったが,雌動物では500 mg/kg群の1例で胚の着床後死亡が認められ,新生児では500 mg/kg以上の群で新生児の体重,体重増加量あるいは体重増加率の低値が認められたことから,本試験におけるフタルイミドの雄動物の生殖に対する無影響量(NOEL)は1000 mg/kg/day,雌動物の生殖に対する無影響量(NOEL)は250 mg/kg/day,新生児の発生に対する無影響量(NOEL)は250 mg/kg/dayであると判断された.
方法
1. 被験物質
フタルイミドは,白色〜うすい黄色の結晶性粉末であり,遮光気密容器に入れ,冷蔵保存した.本試験では,三星化学工業(株)(東京)製造のロット番号7255(純度:99.9 %)を使用した.なお,試験終了後の残余被験物質を製造業者が分析し,試験期間中の被験物質の安定性が確認された.
投与には,被験物質を25,50および100 mg/mLの濃度となるように1 w/v%カルメロースナトリウム水溶液に懸濁したものを用いた。冷蔵保存で調製後7日に調製液の分析を実施し,その結果から調製液の7日間の安定性が確認されたため,調製頻度は7日間に1回以上とした.調製液は投与に用いるまで遮光気密容器に入れ,冷蔵庫内に保存した.各濃度の調製液は規定の濃度の±5 %以内であり,かつ均一であることが確認された.
2. 試験動物および飼育条件
8週齢のCrj:CD(SD)IGS系のSPFラットの雌雄を日本チャールス・リバー(株)から受け入れ,14日間の馴化飼育を行い,順調な発育を示した動物を試験に用いた.雌については,9日間の性周期検査を併せて行い,性周期に異常の認められない動物を用いた.
動物は,温度22〜24℃,湿度45〜61 %,換気回数10〜15回/時および照明時間12時間(午前8時から午後8時まで点灯)に制御されたバリアシステムの飼育室で,ブラケット式金属製金網床ケージを用いて飼育した.雌は,妊娠17日から金網床のかわりに実験動物用床敷(ホワイトフレーク,日本チャールス・リバー(株))を敷いたステンレス製受皿を使用した.ケージ当たりの収容匹数は,群分け前は3匹以内,群分け後は1匹,交配中は雌雄各1匹,妊娠期間中は1母動物,哺育期間中は1腹とした.飼料はγ線照射固型飼料(CRF-1,オリエンタル酵母工業(株))を金属製給餌器を用いて,飲料水は水道水(札幌市)を自動給水装置あるいは給水器を用いて,それぞれ自由に摂取させた.
3. 投与量の設定および群分け
試験群は,フタルイミドの用量設定試験の結果を参考に設定した.用量設定試験では,5,70および1000 mg/kgを14日間投与した雌雄各5例のラットを交配させ,雄で計19日間,雌で妊娠19日まで投与し,妊娠20日に雌の子宮内観察および胎児の外表検査を行った.その結果,一般状態,体重推移および剖検でフタルイミド投与による影響は認められず,雄の尿検査,血液学検査および血液生化学検査,雌雄の生殖能検査,雌の妊娠20日の子宮内観察ならびに胎児の外表検査にもフタルイミド投与による影響は認められなかった.したがって,本試験では,高用量を限界試験で最高用量とされる1000 mg/kgとし,以下,公比2で500および250 mg/kgを投与する群と,媒体である1 w/v%カルメロースナトリウム水溶液のみを投与する対照群を設定し,計4群とした.1群の動物数は雌雄とも12匹とし,投与前々日の体重にもとづいて層化無作為抽出法により群分けを行った.
4. 投与方法
投与は経口投与とし,胃ゾンデを用いて強制的に胃内に行った.
投与期間は,雄については交配前14日間および交配期間を含む46日間,雌については交配前14日間および交尾成立までの交配期間,さらに交尾成立例は妊娠期間および哺育3日までの期間とした.
投与容量は,体重1 kg当たり10 mLとして投与日に最も近い日に測定した体重に基づいて算出し,体重測定当日の投与容量はその日の体重に基づいて算出した.投与は10週齢から開始し,投与開始時の平均体重(体重範囲)は雄で371.7 g(350〜402 g),雌で231.5 g(195〜257 g)であった.
5. 観察,測定および検査項目
(1) 一般状態観察
雌雄全例について,試験期間中1日1回以上の頻度で,視診および触診により行動,外観を観察した.
(2) 体重測定
投与1日(投与前),投与2,5,7,10および14日,その後は雄については7日毎(投与終了日を含む)および剖検日に,雌については妊娠0,1,3,5,7,10,14,17,および20日,哺育0,1および4日に,また交配期間中(雄と同居中)は相手雄の測定日と同じ日に電子天秤を用いて体重を測定した.また,雄については投与1から46日の,雌については投与1から14日,妊娠0から20日および哺育0から4日の体重増加量および体重増加率を算出した.
(3) 摂餌量測定
摂餌量は,雄については交配期間,最終投与日および剖検日を除き,雌については妊娠0日および哺育0日を除き体重測定日と同じ日に,電子天秤を用いて測定した.測定前日に適当量の飼料をケージ毎にセットし,翌日(測定日)に残量を測定して1匹当たりの1日分の摂餌量を算出した.
(4) 尿検査
投与期間の最終週(投与43〜44日)に雄の各群6例について,ラット用代謝ケージ(KN-646 B-1型,(株)夏目製作所)に収容して非絶食下で採尿を行った.約3時間の蓄尿の一部を用いて,pH,蛋白,糖,ケトン体,ウロビリノーゲン,ビリルビン,潜血反応(以上,マルチスティックス,バイエル・三共)および色調(肉眼観察)ならびに沈渣(鏡検)を検査し,21時間蓄尿を用いて尿量(容量)および比重(屈折計,アタゴ)を測定した.また,採尿中の飲水量測定も併せて実施した.
(5) 血液学検査
投与46日の翌日の剖検時に約16〜24時間絶食した雄の全例について,エーテル麻酔下で腹部大動脈から採血した.EDTA・2Kで抗凝固処理した血液を用いて,赤血球数,平均赤血球容積,血小板数,白血球数(以上,電気抵抗法),ヘモグロビン量(シアンメトヘモグロビン法)(以上,コールターカウンターT660型,コールター),ヘマトクリット値(赤血球数,平均赤血球容積より算出),平均赤血球ヘモグロビン量(赤血球数,ヘモグロビン量より算出),平均赤血球ヘモグロビン濃度(ヘマトクリット値,ヘモグロビン量より算出)ならびに白血球型別百分率(May-Gr nwald-Giemsa染色)を測定した.また,クエン酸ナトリウムで抗凝固処理した後,3000 rpmで10分間遠心し,得られた血漿を用いてプロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血球凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
nwald-Giemsa染色)を測定した.また,クエン酸ナトリウムで抗凝固処理した後,3000 rpmで10分間遠心し,得られた血漿を用いてプロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血球凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
(6) 血液生化学検査
投与46日の翌日の剖検時に約16〜24時間絶食した雄の全例について,血液学検査のための採血後,腹部大動脈から採血した.ヘパリンで抗凝固処理した後,3000 rpmで10分間遠心分離し,得られた血漿を用いてGOT(IFCC法),乳酸脱水素酵素(Wr blewski & La Due法),グルコース(ヘキソキナーゼ法)を測定し,また,3000 rpmで10分間遠心し,得られた血清を用いてGPT(IFCC法),アルカリホスファターゼ(Bessey-Lowry法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),コリンエステラーゼ(ヨウ化ブチリルチオコリン基質法),総コレステロール(酵素法),リン脂質(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff
blewski & La Due法),グルコース(ヘキソキナーゼ法)を測定し,また,3000 rpmで10分間遠心し,得られた血清を用いてGPT(IFCC法),アルカリホスファターゼ(Bessey-Lowry法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),コリンエステラーゼ(ヨウ化ブチリルチオコリン基質法),総コレステロール(酵素法),リン脂質(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff 法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)およびアルブミン(BCG法)(以上,自動分析装置7150形,日立製作所),ナトリウムおよびカリウム(以上,炎光光度法;コーニング480型炎光光度計),クロール(電量滴定法;クロライドカウンターCL-6M,平沼産業),A/G比および蛋白分画(以上,セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)およびアルブミン(BCG法)(以上,自動分析装置7150形,日立製作所),ナトリウムおよびカリウム(以上,炎光光度法;コーニング480型炎光光度計),クロール(電量滴定法;クロライドカウンターCL-6M,平沼産業),A/G比および蛋白分画(以上,セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
(7) 剖検および器官重量測定
雄については投与46日の翌日にエーテル麻酔下で採血後放血致死させ,全身の器官および組織を肉眼的に観察した.雌は哺育3日まで生存児のみられた例は哺育4日に,妊娠25日まで分娩の認められない例は妊娠26日に,エーテル麻酔下で放血致死させ,全身の器官・組織を肉眼的に観察し,子宮の着床痕および卵巣の黄体数を数えた.さらに,雌雄の全例について,脳,肺,心臓,肝臓,腎臓,脾臓,副腎,下垂体,胸腺,甲状腺,精巣,精巣上体および卵巣の重量を電子天秤を用いて測定するとともに,器官体重重量比を算出した.
(8) 病理組織学検査
雌雄の全例について,肝臓,腎臓,脾臓,心臓,肺,脳,下垂体,胸腺,副腎,甲状腺,胃(前胃・腺胃・幽門部),十二指腸,空腸,回腸,盲腸,結腸,直腸,前立腺および卵巣を10 %中性緩衝ホルマリン液で,精巣および精巣上体をブアン液で固定後,パラフィン切片を作製し,ヘマトキシリン・エオジン染色標本特殊染色(oil red O染色,PAS染色,グリメリウス染色,エラスチカ・ワン・ギーソン染色)標本を作製して病理組織学検査を行った.
(9) 生殖能検査
雌全例について,投与開始日の10日前から交尾までの連日,Giemsa染色による膣垢塗抹標本を作製し,光学顕微鏡下で性周期段階(発情前期,発情期前期,発情期後期,発情後期および発情休止期)の判定を行い,性周期の異常の有無を検索した.投与14日の雌雄について,同試験群内で夕方から1対1(無作為組合わせ)で14日間を限度として同居させ,雌の膣垢中に精子が確認された日を妊娠0日とした.妊娠の成立は剖検時に雌の子宮に着床痕が確認された場合とし,交尾率[(交尾雌動物数/同居雌動物数)×100]および受胎率[(受胎動物数/交尾雌動物数)×100]を算出した.
(10) 分娩および哺育行動観察
交尾した雌全例について,妊娠21日から分娩終了日まで,分娩状態,哺育行動,総出産児数,生存児数および死亡児数,出産児の性別および外表を観察した.また,妊娠期間[妊娠0日から哺育0日(分娩終了日)までの日数],出産率[(生児出産雌数/妊娠雌数)×100],分娩率[(総出産児数/着床痕数)×100],出生率[(出産確認時生存児数/総出産児数)×100],哺育4日時哺育率[(哺育4日時に哺育児の認められる雌動物数/正常に分娩した雌動物数)×100]および性比[雄生児数/雌生児数]を算出し,剖検時の計測結果から着床率[(着床痕数/黄体数)×100]を算出した.
(11) 新生児の一般状態観察および生存率
全例について,哺育0日から哺育4日まで1日1回生存および死亡を確認し,一般状態および外表について観察した.なお,哺育日数は分娩終了日を哺育0日として起算した.
観察結果から新生児の4日の生存率[(哺育4日生存児数/出産確認時生存児数)×100]を1腹を単位として算出し,喰殺を受け死亡あるいは不明例となった新生児は死亡例として扱った.
(12) 新生児の体重測定
生存例全例について,哺育0,1および4日に電子天秤を用いて測定し,体重値は1腹毎に雌雄別に1匹あたりの平均値で示した.得られた測定値から体重増加量(哺育4日体重-哺育0日体重)および体重増加率[(体重増加量/哺育0日の体重)×100]を算出した.
(13) 新生児の剖検
死亡例は発見後直ちに剖検し,その他の例については哺育4日に体外表(口腔内を含む)を観察し,二酸化炭素吸入法を用いて安楽致死させ,全身の器官・組織を肉眼的に観察した.死亡例および異常所見部位の認められた例については,whole bodyを10 %中性緩衝ホルマリン液で固定し,保存した.
6. 統計解析
性周期,交尾率,受胎率,出産率および哺育率,ならびに病理組織学検査結果のうち1段階の陽性グレードがみられた所見については,多試料χ^2-検定を行い,有意な場合2試料c2-検定を行った.また,これらの検定に不適合の場合はFisherの直接確率検定法を用いた.その他の項目および病理組織学検査の結果のうち2段階以上の陽性グレードがみられた所見についてはBartlettの等分散性の検定後,一元配置分散分析法あるいはKruskal-Wallis法により解析し,有意な場合,Dunnettの検定法あるいはMann-WhitneyのU-検定法により,対照群とフタルイミド投与各群との比較を行った.
対照群との検定に際しては,有意水準を5 %とした.
結果
1. 反復投与毒性
(1) 一般状態観察
雄では,脱毛および痂皮が250 mg/kg群の1例で投与37日から剖検日まで認められたが,他のフタルイミド投与群ではみられない偶発的なものであった.
雌では,妊娠前投与期間,妊娠期間および哺育期間中のいずれの期間にも,異常は認められなかった.
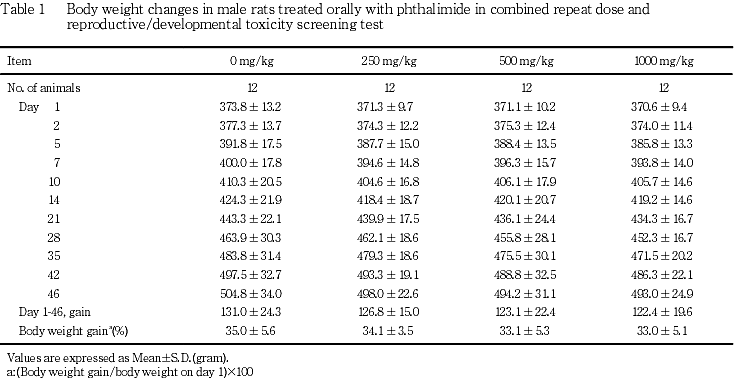
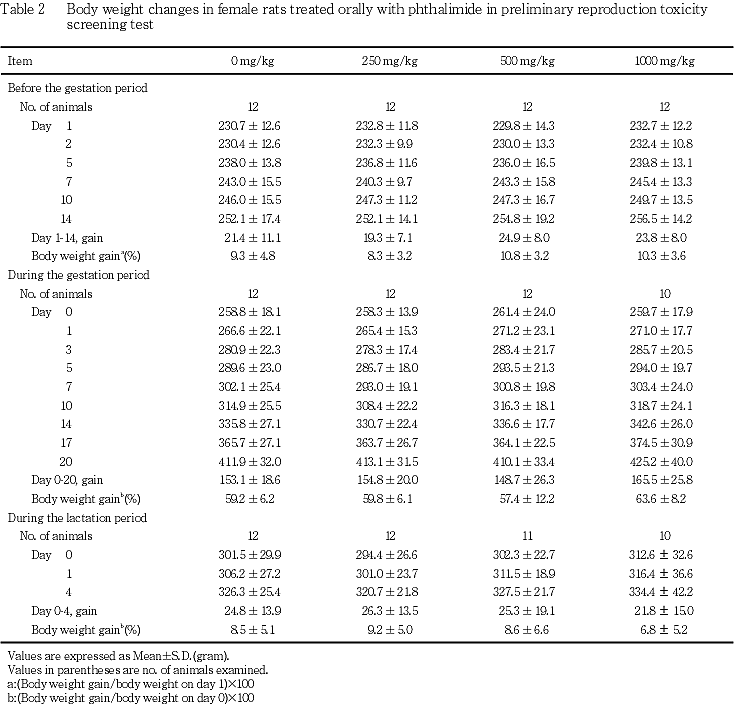
(2) 体重推移(Table 1, 2)
雄の投与期間ならびに雌の妊娠前投与期間,妊娠期間および哺育期間のいずれの期間にも,フタルイミド投与各群とも対照群と比較して有意差は認められなかった.
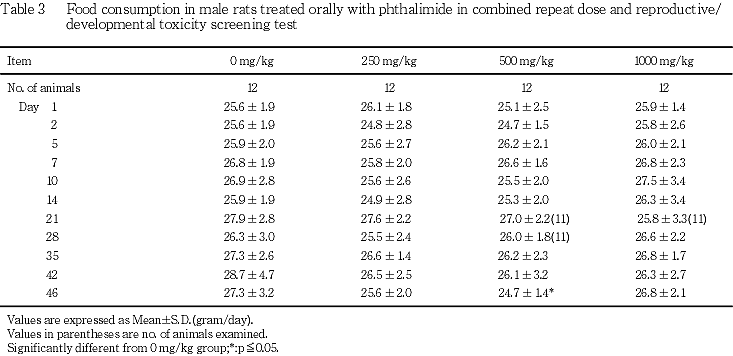
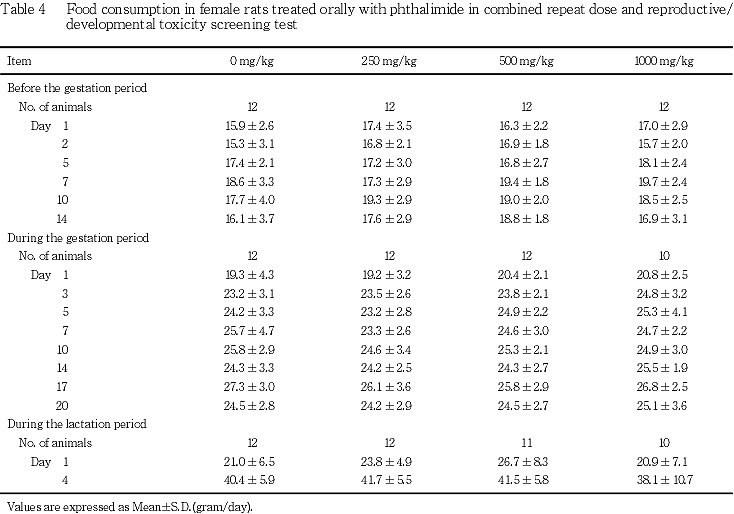
(3) 摂餌量(Table 3, 4)
雄では,摂餌量の低値が500 mg/kg群で投与46日に認められたが,用量相関性のない一過性の変化であった.
雌では,妊娠前投与期間,妊娠期間および哺育期間のいずれの期間にも,フタルイミド投与各群とも対照群と比較して有意差は認められなかった.
(4) 尿検査
雄の500および1000 mg/kg群でpHの低下(範囲:500および1000 mg/kg群とも6.0〜8.0,対照群;8.0〜8.5)がみられ,対照群と比較して有意差が認められた.
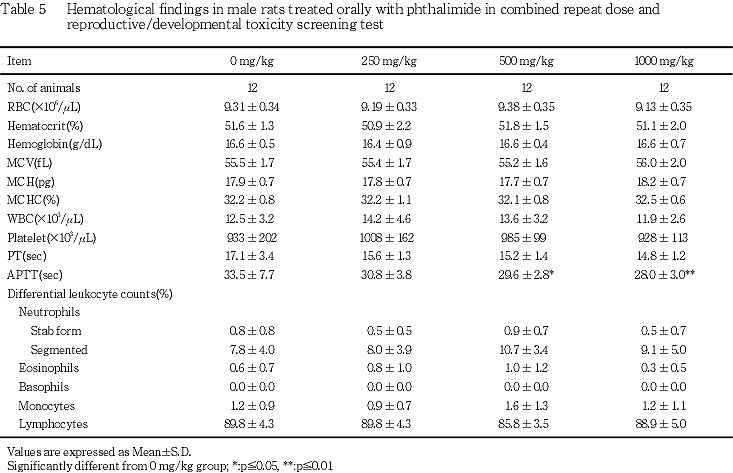
(5) 血液学検査(Table 5)
活性化部分トロンボプラスチン時間の短縮が雄の500 および1000 mg/kg群でみられ,対照群と比較して有意差が認められた.
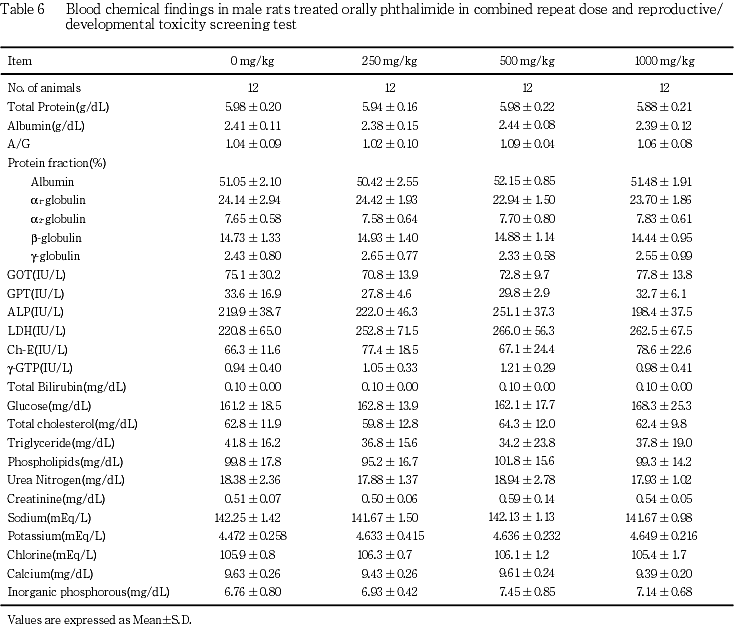
(6) 血液生化学検査(Table 6)
いずれの検査項目にも,雄のフタルイミド投与各群とも対照群と比較して有意差は認められなかった.
(7) 剖検
雄では,250 mg/kg群で盲腸粘膜の隆起および脾臓の褐色腫瘤が各1例,また,外表所見として脱毛および痂皮が1例に認められたのみであり,フタルイミド投与による所見は認められなかった.なお,対照群の1例で脾臓の腫大,縦隔リンパ節および腎リンパ節の腫大,ならびに後腹膜のリンパ節の一部暗赤色化および腫大が認められた。
雌では,分娩哺育を行った1000 mg/kg群の1例で右副腎が肝臓における異所性副腎として認められた.また,妊娠26日まで分娩がみられなかった500 mg/kg群の1例で,左右の子宮および子宮頸部の内腔拡張,ならびに膣の内腔拡張が認められた.
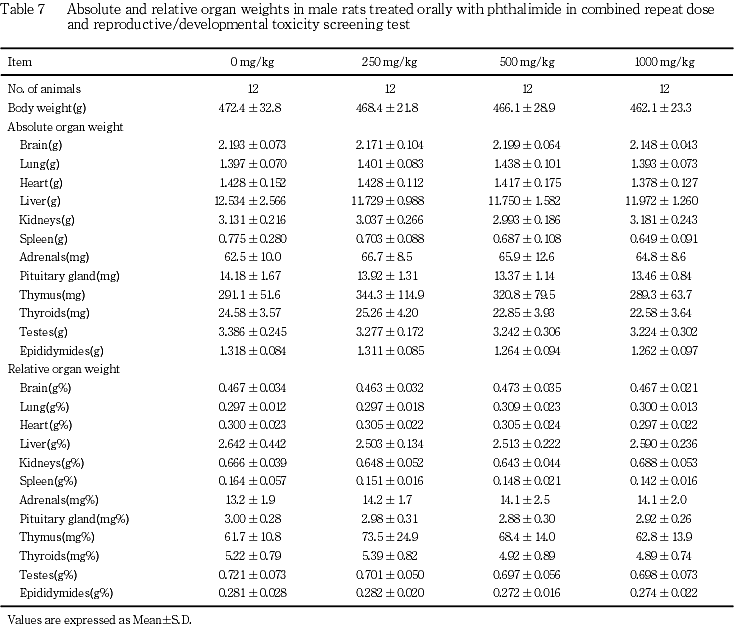
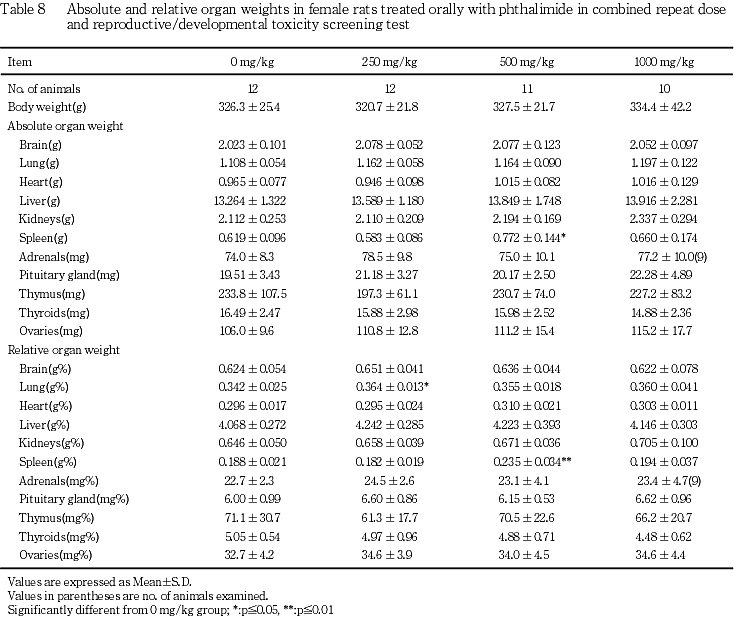
(8) 器官重量(Table 7, 8)
雄では,フタルイミド投与各群とも対照群と比較して有意差は認められなかった.
雌では,肺の体重重量比の高値が250 mg/kg群で,脾臓の重量および体重重量比の高値が500 mg/kg群で認められたが,1000 mg/kg群では対照群と比較して有意差は認められなかった.
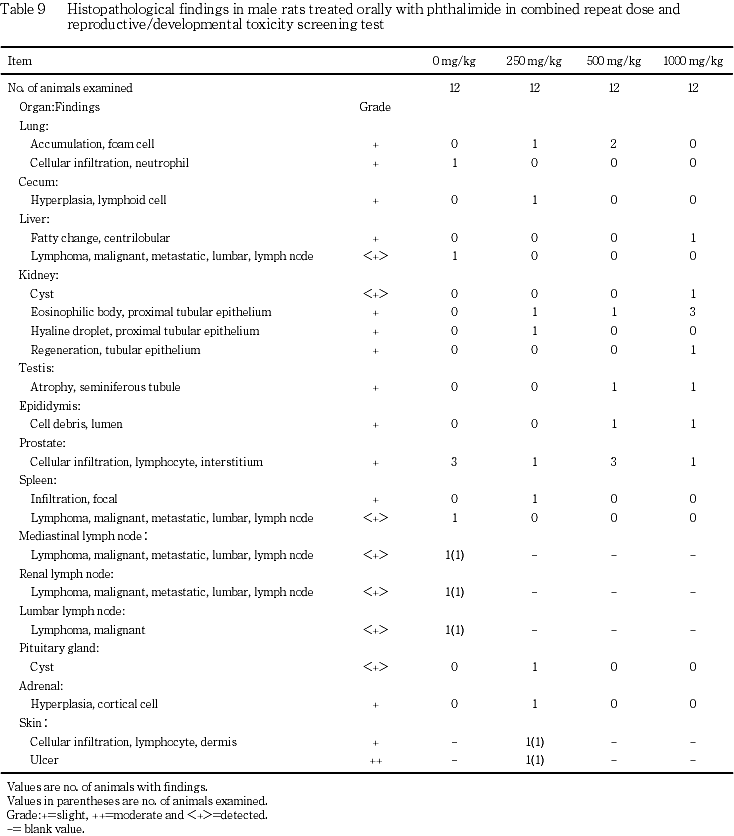
(9) 病理組織学検査(Table 9, 10)
雄では,肺で泡沫細胞の集簇が250および500 mg/kg群で各々1および2例に,肝臓で小葉中心性脂肪化が1000 mg/kg群で1例に,腎臓で嚢胞が1000 mg/kg群で1例に,近位尿細管上皮の好酸性小体が250,500および1000 mg/kg群で1〜3例に,近位尿細管上皮の硝子滴が250 mg/kg群で1例に,尿細管上皮の再生が1000 mg/kg群で1例に,精巣で精細管の萎縮が500および1000 mg/kg群で各1例に,精巣上体で管腔内細胞残屑が500および1000 mg/kg群で各1例に,前立腺で間質のリンパ球浸潤が対照群およびフタルイミド投与各群で1〜3例に認められた.以上の変化はいずれもその出現に対照群と比較して有意差は認められなかった.その他,肺に好中球浸潤,脾臓に限局性炎症,下垂体に嚢胞,副腎に皮質細胞の過形成,盲腸にリンパ球様細胞の過形成が散見されたのみであった.なお,対照群では剖検で脾臓の腫大,縦隔リンパ節および腎リンパ節の腫大,ならびに後腹膜のリンパ節の一部暗赤色化および腫大が認められた例で,後腹膜のリンパ節に悪性リンパ腫が認められ,肝臓,脾臓,縦隔リンパ節および腎リンパ節に転移が認められた.
雌では,肺で泡沫細胞の集簇が250および500 mg/kg群で各々3および1例に,肝臓で小葉周辺性脂肪化および限局性壊死が1000 mg/kg群で各1例に,腎臓で近位尿細管上皮の脂肪変性(Oil red O染色陽性)が1000 mg/kg群で1例に,胸腺で萎縮が対照群および1000 mg/kg群で各1例に認められた.以上の変化はいずれもその出現に対照群と比較して有意差は認められなかった.その他,対照群で腎臓に嚢胞,皮髄境界部の鉱質沈着が認められた.

2. 生殖毒性および次世代の発生毒性
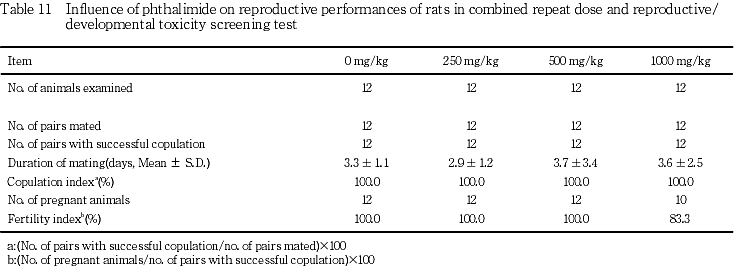
(1) 生殖能検査(Table 11)
雌の性周期検査では,交配中の投与期間に発情休止期の連続が500および1000 mg/kg群で各1例に,不規則発情が500 mg/kg群の1例に認められた.これら全例で交尾が成立したが,1000 mg/kg群の2組に不妊がみられ,そのうち1組の雌は発情休止期が連続した例であった.この1000 mg/kg群の不妊例ならびに交配相手雄の剖検および病理組織学検査では卵巣あるいは精巣および精巣上体に異常は認められなかった.また,対照群と比較して,交尾までの日数,交尾率および受胎率にフタルイミド投与各群とも有意差は認められなかった.
(2) 分娩および哺育行動観察(Table 12)
分娩例ではフタルイミド投与各群とも哺育状態に異常は認められなかった.
妊娠期間,哺育率,妊娠黄体数,着床数,着床率,出産児数,出産率,出産確認時生存児数および出生率に,フタルイミド投与各群とも対照群と比較して有意差は認められなかった.なお,分娩率の高値が1000 mg/kg群で認められたが,これは同群の出産児数が対照群と比較して多いことによるものであった.
500 mg/kg群の1例で妊娠26日までに分娩がみられず,この例の剖検で左右の子宮,子宮頸部および膣の内腔拡張が認められ,着床痕5個が認められたが,生存胎児は認められなかった.
分娩終了時の死亡児が250 mg/kg群で雌雄各1例,500および1000 mg/kg群で雌各1例に認められたが,いずれの死亡児についても剖検で異常は認められなかった.

(3) 新生児の生存率(Table 12)
フタルイミド投与各群とも対照群と比較して,新生児の4日の生存率に有意差は認められなかった.
(4) 新生児の一般状態観察
死亡あるいは不明例が対照群の雌2例,250 mg/kg群の雄1例,500 mg/kg群の雄1および雌4例,1000 mg/kg群の雄4および雌6例に認められた.このうち,1000 mg/kg群の雄4および雌4例の死亡および不明例は同腹の出生児であり,この母動物では新生児雄9例および雌8例のうち,哺育2日に雌雄各1例が死亡し,哺育3日に雄2例,哺育4日に雄1例雌3例が不明となり,生存した新生児にも体重の減少がみられた.
その他の生存例では外傷によると考えられる尾先端部の欠損が対照群および1000 mg/kg群で雄各1例に,腹部あるいは頸部の外傷が1000 mg/kg群で雌雄各1例に認められたのみであった.
(5) 新生児の体重推移(Table 12)
対照群と比較して500 mg/kg群の雄で哺育4日体重の低値,雌で哺育4日体重,体重増加量および体重増加率に低値が認められた.1000 mg/kg群でも,雄で哺育4日体重の低値,雌で哺育4日体重および体重増加量の低値が認められた.
(6) 新生児の剖検
一般状態観察でみられた対照群および1000 mg/kg群の雄各1例の尾先端部の欠損,ならびに1000 mg/kg群の雌雄各1例の腹部あるいは頸部の外傷が認められたが,その他の死亡例および哺育4日に屠殺した新生児の剖検では,いずれの動物においても異常は認められなかった.
考察
フタルイミドの250,500および1000 mg/kgを雄ラットに対しては交配前,交配期間および交配後の計46日間,雌ラットに対しては交配前,交配および妊娠期間ならびに哺育3日までの期間,反復経口投与し,雌雄動物への反復投与による影響,雌雄動物の生殖および新生児の発生に及ぼす影響について反復投与毒性・生殖発生毒性併合試験を実施した.
1. 反復投与毒性
雌雄の一般状態,体重推移,摂餌量,剖検,器官重量および病理組織学検査,ならびに雄の血液生化学検査にフタルイミド投与による影響は認められなかった.雄の尿検査でpHの低下が500 および1000 mg/kg群で認められた.しかし,この変化は生理的に変動(範囲pH 6〜8)しやすいことが報告されていること1),また,蛋白および潜血などの尿定性試験項目に変化がないこと,さらに血液生化学検査および泌尿器系の病理組織学検査にも異常はみられないことから,毒性学的意義はないものと考えられた.
雄の血液学検査では,活性化部分トロンボプラスチン時間の短縮が500 mg/kg群および1000 mg/kg群で認められた.しかし,この変化は比較的軽度の短縮であり,血小板数に変化はみられず,血液生化学検査および病理組織学検査において肝臓の機能亢進あるいは低下を示唆する変化はみられなかった.また,剖検においても出血を窺わせる変化はみられていないことから,その毒性学的意義はないものと考えられた.
病理組織学検査では,雄で腎臓に近位尿細管上皮の好酸性小体が250,500および1000 mg/kg群で1〜3例に認められたが,その出現に対照群と比較して有意差は認められず,フタルイミド投与による影響とは考えられなかった.また,肺の泡沫細胞の集簇ならびに前立腺のリンパ球浸潤の発生例数には用量依存的な増加はみられず,その他の所見も1例のみの変化であり,フタルイミド投与との関連はないものと考えられた.なお,対照群の1例では,剖検で脾臓,縦隔リンパ節および腎リンパ節の腫大ならびに後腹膜のリンパ節の一部暗赤色化および腫大が認められ,病理組織学検査では後腹膜のリンパ節において異型リンパ球が浸潤性に増殖し,組織構造の破壊が顕著であったことから,後腹膜のリンパ節原発の悪性リンパ腫と考えられた.
雌の病理組織学検査では,1000 mg/kg群で1例のみではあったが,肝臓に小葉周辺性脂肪化,腎臓に近位尿細管上皮の脂肪変性および胸腺の萎縮が認められた.同例は哺育期間中に体重の減少および摂餌量の低値がみられ,フタルイミド投与による影響が考えられた.
以上,雄では各検査項目においてフタルイミド投与による影響は認められず,雌では1例のみではあったが哺育期間の体重および摂餌量ならびに病理組織学検査でフタルイミド投与による影響が認められたことから,本試験におけるフタルイミドの反復経口投与による無影響量(NOEL)は,雄で1000 mg/kg/day,雌で500 mg/kg/dayと判断された.
2. 生殖発生毒性
生殖能検査では雌雄の交尾率,雌の性周期および受胎率,また,生殖器(精巣,精巣上体および卵巣)および内分泌器官(下垂体,副腎)の剖検,重量および病理組織学検査においてフタルイミド投与による影響は認められなかった.一方,1000 mg/kg群で認められた2例の不妊の生殖器の病理組織学検査でも,異常はなく,フタルイミド投与による影響は認められなかった.
母動物の剖検,妊娠期間,黄体数,着床数,着床率,出産率,分娩率,出産児数および出産確認時生存児数および出生率にフタルイミド投与による影響は認められなかった.しかし,1000 mg/kg群の1例で新生児雄9例および雌8例のうち,哺育2日に雌雄各1例が死亡し,哺育3日に雄2例,哺育4日に雄1例雌3例が不明となり,生存した新生児の体重も減少していた.この母動物では哺育期間中に体重の減少および摂餌量の低値も認められており,病理組織学検査では肝臓に小葉周辺性脂肪化,腎臓に近位尿細管上皮の脂肪変性および胸腺の萎縮が認められた.したがって,1例のみの出現ではあるが,フタルイミド投与により母体の哺育能力に影響を及ぼした可能性が考えられた.
また,妊娠26日まで分娩がみられなかった500 mg/kg群の1例では,剖検で左右の子宮および子宮頸部の内腔拡張がみられた.同例では肉眼による観察で着床痕5個がみられ,いずれも早期の胚死亡と考えられ,フタルイミド投与との関連が窺われた.
一方,新生児では,一般状態および新生児生存率にフタルイミド投与による影響は認められなかったが,新生児の体重推移では500および1000 mg/kg群の雌雄で哺育4日に体重の低値が認められ,また,500 mg/kg群の雌では体重増加量および体重増加率の低値が,1000 mg/kg群の雌でも体重増加量の低値が認められた.本試験に先立って実施した用量設定試験では雌動物の交配前14日間および妊娠19日までフタルイミドを投与したところ,1000 mg/kg群では胎児の体重に影響はみられず,生存性および外表検査にも異常は認められなかった.本試験においても,フタルイミド投与各群とも分娩時の新生児体重には変化はみられなかった.したがって,フタルイミド投与による母動物の哺育能力の低下あるいは乳汁移行により,500および1000 mg/kg群の新生児の体重に影響を及ぼしたと考えられたが,前述の1000 mg/kg群の1例を含め,本試験条件下ではその機序を明らかにすることはできなかった.
以上のことから,雄では生殖に対する影響は認められなかったが,母動物では500 mg/kg群の1例で胚の着床後死亡が認められ,新生児では500 mg/kg以上の群で新生児の体重,体重増加量あるいは体重増加率の低値が認められたことから,本試験におけるフタルイミドの反復経口投与による親動物の生殖に対する無影響量(NOEL)は雄で1000 mg/kg/day,雌で250 mg/kg/day,新生児の発生に対する無影響量(NOEL)は250 mg/kg/dayと判断された.
文献
| 1) | 谷本義文,"実験動物の血液・尿生化学,"ソフトサイエンス社,東京,1988,p. 123. |
| 連絡先 |
| 試験責任者: | 吉村浩幸 |
| 試験担当者: | 吉田文子,皆川俊英,平田真理子,古川正敏,山本美代子 |
| (株)化合物安全性研究所 |
| 〒004-0839 北海道札幌市清田区真栄363番24号 |
| Tel 011-885-5031 | Fax 011-885-5313 | |
| Correspondence |
| Authors: | Hiroyuki Yoshimura (Study director)
Ayako Yoshida, Toshihide Minagawa, Mariko Hirata, Masatoshi Furukawa, Miyoko Yamamoto |
| Safety Research Institute for Chemical Compounds Co., Ltd. |
| 363-24 Shin-ei, Kiyota-ku, Sapporo, Hokkaido, 004-0839, Japan |
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | |

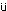 nwald-Giemsa染色)を測定した.また,クエン酸ナトリウムで抗凝固処理した後,3000 rpmで10分間遠心し,得られた血漿を用いてプロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血球凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
nwald-Giemsa染色)を測定した.また,クエン酸ナトリウムで抗凝固処理した後,3000 rpmで10分間遠心し,得られた血漿を用いてプロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血球凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
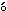 blewski & La Due法),グルコース(ヘキソキナーゼ法)を測定し,また,3000 rpmで10分間遠心し,得られた血清を用いてGPT(IFCC法),アルカリホスファターゼ(Bessey-Lowry法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),コリンエステラーゼ(ヨウ化ブチリルチオコリン基質法),総コレステロール(酵素法),リン脂質(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff
blewski & La Due法),グルコース(ヘキソキナーゼ法)を測定し,また,3000 rpmで10分間遠心し,得られた血清を用いてGPT(IFCC法),アルカリホスファターゼ(Bessey-Lowry法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),コリンエステラーゼ(ヨウ化ブチリルチオコリン基質法),総コレステロール(酵素法),リン脂質(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff 法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)およびアルブミン(BCG法)(以上,自動分析装置7150形,日立製作所),ナトリウムおよびカリウム(以上,炎光光度法;コーニング480型炎光光度計),クロール(電量滴定法;クロライドカウンターCL-6M,平沼産業),A/G比および蛋白分画(以上,セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)およびアルブミン(BCG法)(以上,自動分析装置7150形,日立製作所),ナトリウムおよびカリウム(以上,炎光光度法;コーニング480型炎光光度計),クロール(電量滴定法;クロライドカウンターCL-6M,平沼産業),A/G比および蛋白分画(以上,セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.











