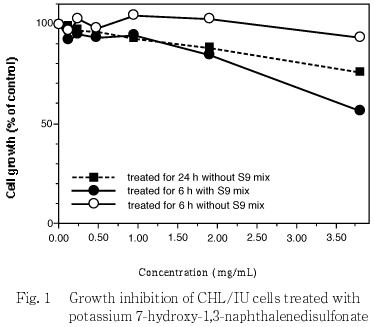
連続処理(24時間),短時間処理(6時間)ともに3.8 mg/mL(10 mmol/L)の濃度においても50 %を越える細胞増殖抑制は認められなかったことから,すべての試験において3.8 mg/mLを最高処理濃度とし,連続処理およびS9 mixの非存在下での短時間処理では公比2で3濃度を,S9 mixの存在下では公比2で4濃度を設定した.連続処理では,24時間および48時間処理後,短時間処理ではS9 mix存在下および非存在下で6時間処理し,新鮮培地で更に18時間培養後,標本を作製し,検鏡することにより染色体異常誘発性を検討した.染色体分析が可能な最高処理濃度は,3.8 mg/mL(10 mmol/L)であったことから,この濃度を高濃度群として3濃度群を観察対象とした.
CHL/IU細胞を24時間および48時間連続処理したいずれの処理群においても,染色体の構造異常や倍数性細胞の誘発作用は認められなかった.短時間処理では,S9 mix存在下および非存在下で6時間処理したいずれの処理群においても,染色体の構造異常や倍数性細胞の誘発作用は認められなかった.
以上の結果より,7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウムは,上記の試験条件下で染色体異常を誘発しないと結論した.
 )培養液を用いた.
)培養液を用いた.
 )は,淡灰白色粉末で,水に対して50 mg/mL以上で溶解し,DMSOおよびアセトンでは50 mg/mLで不溶の水溶性で,分子量380.47,純度89.2 wt%(不純物として水分約5 %,無機塩約2 %および微量の異性体を含む)の物質である.
)は,淡灰白色粉末で,水に対して50 mg/mL以上で溶解し,DMSOおよびアセトンでは50 mg/mLで不溶の水溶性で,分子量380.47,純度89.2 wt%(不純物として水分約5 %,無機塩約2 %および微量の異性体を含む)の物質である.
 大塚製薬工場)を用いた.原体を溶媒に懸濁して原液を調製し,ついで原液を溶媒で順次希釈して所定の濃度の被験物質調製液を作製した.被験物質調製液は,すべての試験において培養液の10 vol%になるように加えた.
大塚製薬工場)を用いた.原体を溶媒に懸濁して原液を調製し,ついで原液を溶媒で順次希釈して所定の濃度の被験物質調製液を作製した.被験物質調製液は,すべての試験において培養液の10 vol%になるように加えた.
 )を用いて各群の増殖度を計測し,被験物質処理群の溶媒対照群に対する細胞増殖の比をもって指標とした.
)を用いて各群の増殖度を計測し,被験物質処理群の溶媒対照群に対する細胞増殖の比をもって指標とした.その結果,連続処理,短時間処理ともに,処理したすべての濃度範囲で50 %を越える細胞増殖抑制作用は認められなかった(Fig. 1).

 )およびシクロホスファミド(CPA,Sigma Chemical Co.)は,注射用蒸留水(
)およびシクロホスファミド(CPA,Sigma Chemical Co.)は,注射用蒸留水( 大塚製薬工場)に溶解して調製した.それぞれ染色体異常を誘発することが知られている濃度を適用した.
大塚製薬工場)に溶解して調製した.それぞれ染色体異常を誘発することが知られている濃度を適用した.染色体異常試験においては1濃度あたり4枚のディッシュを用い,そのうちの2枚は染色体標本を作製し,別の2枚については単層培養細胞密度計により細胞増殖率を測定した.
作製したスライド標本のうち,1つのディッシュから得られた異なるスライドを,4名の観察者がそれぞれ処理条件が分からないようにコード化した状態で分析した.染色体の分析は,日本環境変異原学会・哺乳動物試験研究会(MMS)1)による分類法に基づいて行い,染色体型あるいは染色分体型のギャップ,切断,交換などの構造異常の有無と倍数性細胞(polyploid)の有無について観察した.また,構造異常については1群200個,倍数性細胞については1群800個の分裂中期細胞を分析した.
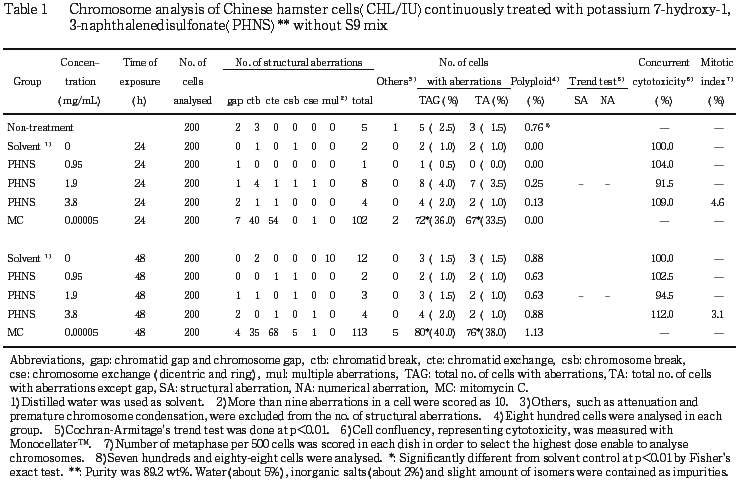
染色体異常を有する細胞の出現頻度について,溶媒対照群と被験物質処理群および陽性対照群間でフィッシャーの直接確率法2)により,有意差検定を実施した(p<0.01).また,用量依存性に関してコクラン・アーミテッジの傾向性検定3)(p<0.01)を行った.最終的な判定は,統計学的および生物学的な評価に基づいて行った.
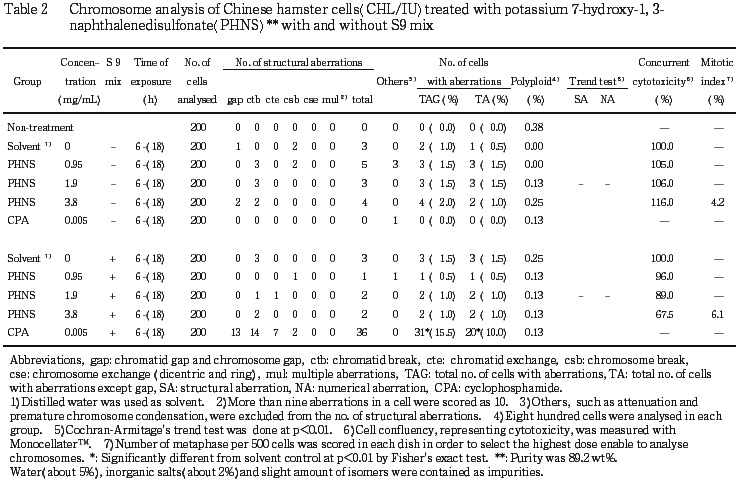
短時間処理による染色体分析の結果をTable 2に示した.7-ヒドロキシ-1, 3-ナフタレンジスルホン酸カリウムを加えてS9 mix存在下および非存在下で6時間処理したいずれの処理群においても,染色体の構造異常および倍数性細胞の誘発作用は認められなかった.
従って,7-ヒドロキシ-1, 3-ナフタレンジスルホン酸カリウムは,上記の試験条件下で,試験管内のCHL/IU細胞に染色体異常を誘発しないと結論した.
| 1) | 日本環境変異原学会・哺乳動物試験分科会編,"化学物質による染色体異常アトラス," 朝倉書店,東京,1988. |
| 2) | 吉村 功編,"毒性・薬効データの統計解析,事例研究によるアプローチ," サイエンティスト社,東京,1987. |
| 3) | 吉村 功,大橋靖夫編,"毒性試験講座14,毒性試験データの統計解析," 地人書館,東京,1992,pp. 218-223. |
| 連絡先 | |||
| 試験責任者: | 田中憲穂 | ||
| 試験担当者: | 日下部博一,佐々木澄志,若栗 忍, 中川ゆづき,渡辺美香,橋本恵子 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Noriho Tanaka(Study director) Hirokazu Kusakabe, Kiyoshi Sasaki, Shinobu Wakuri, Yuzuki Nakagawa, Mika Watanabe, Keiko Hashimoto | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||