7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウムのラットを用いる
28日間反復経口投与毒性試験
Twenty-eight-day Repeat Dose Oral Toxicity Test
of Potassium 7-hydroxy-1,3-naphthalenedisulfonate in Rats
要約
7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウムの0(1 %カルメロースナトリウム水溶液),100,300および1000 mg/kgを1群あたり雌雄各7あるいは14匹のCrj:CD(SD)ラットに28日間反復経口投与して毒性を検討し,さらに0および1000 mg/kg群の雌雄各7匹を用いて14日間の回復性も併せて検討した.その結果,以下の成績を得た.
一般状態,体重,摂餌量,尿検査,剖検および病理組織学検査では,7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウム投与と関連した変化は認められなかった.血液学検査では,ヘマトクリット値,ヘモグロビン量および赤血球数の高値あるいは高値傾向ならびに網赤血球率の低値が雌の1000 mg/kg群で認められた.血液生化学検査では,総コレステロールの低値が雌の300および1000 mg/kg群で認められた.器官重量では,脾臓の絶対重量および相対重量の低値が雄の1000 mg/kg群で認められた.
以上のことから,本試験における7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウムの無影響量(NOEL)は雄で300 mg/kg/day,雌で100 mg/kg/dayであると考えられた.
方法
1. 被験物質および投与液の調製
7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウム(純度:89.2 %,Lot No.:5501,スガイ化学工業(株),和歌山)は灰色がかった白色固体である.入手後の被験物質は密封容器に入れ,冷暗所に保存し,残余被験物質を製造業者が分析し,投与期間中の安定性を確認した.溶媒は1 %カルメロースナトリウム水溶液(日本薬局方カルメロースナトリウム,丸石製薬(株),および日本薬局方精製水,ヤクハン製薬(株))を用い,これに被験物質を所定の濃度となるように懸濁した.被験物質の調製は用時調製とした.また,これらの調製液について濃度を分析し,設定値の± 10 %以内であることを確認した.
2. 試験動物および飼育条件
日本チャールス・リバー(株)より受け入れた4週齢のSprague-Dawley系ラット(Crj:CD(SD)IGS)の雌雄を7日間の検疫・馴化を行った後,雌雄各42匹を選択して5週齢で試験に供した.投与日の体重範囲は雄が149〜168 g,雌が126〜149 gであった.動物は,温度22〜24 ℃,湿度41〜56 %,換気回数10〜15回/時間および照明時間12時間(8:00から20:00まで点灯)に制御されたバリアシステムの飼育室で,ブラケット式金属製金網床ケージに群分け前は5匹以内,群分け後は個別で飼育した.飼料は固型飼料(CRF-1,オリエンタル酵母工業(株))を金属製給餌器を用いて,飲料水は札幌市水道水を自動給水装置あるいは給水器を用いて,自由に摂取させた.
3. 投与量および投与方法
投与量設定試験では1群あたり雌雄各5例のラットに100,300および1000 mg/kgの7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウムを14日間反復経口投与した結果,雄の1000 mg/kg群で体重,摂餌量および腎臓の絶対重量の高値傾向,雌の300および1000 mg/kg群でアルカリフォスファターゼ活性の高値傾向がみられた.
以上のことから,高用量群には1000 mg/kgを設定し,以下公比約3で除して,中用量群には300 mg/kgを,低用量群には100 mg/kgを,さらに,媒体のみを投与する対照群も加え,雌雄各4群を設定した.1群の動物数は雌雄とも7匹とし,対照群および1000 mg/kg群には2群を割り付け,投与前々日の体重に基づいて層化無作為抽出法により群分けを行った.
各個体の投与液量は投与日に最も近い測定日の体重に基づいて5 mL/kgの容量でラット用胃ゾンデを用いて,1日1回連続28日間,強制的に胃内に投与した.
4. 検査項目
1) 一般状態観察
投与期間中および回復期間中に,全例について1日1回以上の頻度で観察した.
2) 体重測定および摂餌量測定
体重は全例について,投与1日(投与前),投与2,5,7,10,14,21および28日(投与終了日),回復1日,2,5,7および14日ならびに剖検日に測定し,投与1日から28日,回復1日から14日の体重増加量および体重増加率を算出した.摂餌量は剖検日を除いて体重と同じ日に測定した.
3) 尿検査
投与4週および回復2週に全例を代謝ケージに収容して非絶食下で採尿を行い,同時に採尿中の飲水量(重量)も測定した.約3時間の蓄尿についてpH,蛋白,糖,ケトン体,ウロビリノーゲン,ビリルビンおよび潜血反応(以上,マルティスティックス,バイエル・三共),色調(肉眼観察)ならびに沈渣(鏡検)を検査し,21時間蓄尿について尿量(容量),比重(屈折計,アタゴ),ナトリウムおよびカリウム(以上,炎光光度法,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),カルシウム(OCPC法)ならびに無機リン(Fiske-SubbaRow法)(以上,自動分析装置7150形,日立製作所)を測定した.
4) 血液学検査
生存例全例について約16時間絶食した後,エーテル麻酔下で大腿静脈より採血し,EDTA・2Kで処理した血液を用いて,赤血球数,平均赤血球容積,血小板数,白血球数(以上,電気抵抗法),ヘモグロビン量(シアンメトヘモグロビン法)(以上,コールターカウンターT660型,コールター),ヘマトクリット値(赤血球数,平均赤血球容積より算出),平均赤血球ヘモグロビン量(赤血球数,ヘモグロビン量より算出),平均赤血球ヘモグロビン濃度(ヘマトクリット値,ヘモグロビン量より算出),網赤血球率(Brecher法)および白血球百分比(May-Gr nwald-Giemsa染色)を測定し,大腿静脈から採取した無処理血液を用いて凝固時間(流体粘度変化による空気圧測定法,マイクロコアグロメーター,グライナー)を測定した.さらに,腹部大動脈より採取した血液をクエン酸ナトリウムで処理した後,3000回転/分で10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
nwald-Giemsa染色)を測定し,大腿静脈から採取した無処理血液を用いて凝固時間(流体粘度変化による空気圧測定法,マイクロコアグロメーター,グライナー)を測定した.さらに,腹部大動脈より採取した血液をクエン酸ナトリウムで処理した後,3000回転/分で10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
5) 血液生化学検査
生存例全例について約16時間絶食した後,エーテル麻酔下で,腹部大動脈より採取した血液を3000回転/分で10分間遠心分離して得られた血清を用いてGOT(IFCC法),GPT(IFCC法),アルカリフォスファターゼ(Bessey-Lawry法),乳酸脱水素酵素(Wr blewski & La Due法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),グルコース(ヘキソキナーゼ法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff
blewski & La Due法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),グルコース(ヘキソキナーゼ法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff 法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)およびアルブミン(BCG法)(以上,自動分析装置7150形,日立製作所),ナトリウムおよびカリウム(以上,炎光光度法,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),A/G比(総蛋白,アルブミンより算出)ならびに蛋白分画(セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)およびアルブミン(BCG法)(以上,自動分析装置7150形,日立製作所),ナトリウムおよびカリウム(以上,炎光光度法,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),A/G比(総蛋白,アルブミンより算出)ならびに蛋白分画(セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
6) 剖検および器官重量測定
生存例については投与28日および回復14日の翌日に,衰弱のため屠殺した例については屠殺時に,体外表を観察し,エーテル麻酔下で採血後放血致死させ剖検した.また,脳,下垂体,胸腺,甲状腺(上皮小体含む),肺,心臓,肝臓,腎臓,脾臓,副腎,精巣および卵巣の重量を測定するとともに,絶対重量を剖検当日の体重で除し100を乗じて相対重量を算出した.
7) 病理組織学検査
全例について肝臓,腎臓,脾臓,心臓,肺,脳(大脳・小脳),下垂体,副腎,甲状腺,上皮小体,胸腺,腸間膜リンパ節,膵臓,舌,下顎リンパ節,顎下腺,舌下腺,耳下腺,乳腺,皮膚,胸骨および大腿骨(骨髄を含む),脊髄(頸部),骨格筋(外側広筋),胸部大動脈,喉頭,気管,気管支,食道,胃(前胃・腺胃),十二指腸,空腸,回腸,盲腸,結腸,直腸,膀胱,精嚢(凝固腺を含む),前立腺,卵巣,子宮,膣および坐骨神経を10 %中性緩衝ホルマリン液で,精巣および精巣上体をブアン液で,眼球およびハーダー腺をデビッドソン液で固定した.これらの摘出器官・組織を常法にしたがってパラフィン包埋後薄切し,ヘマトキシリン・エオジン染色を作製し,鏡検した.
5. 統計解析
体重,体重増加量および体重増加率,摂餌量,尿検査の定量的項目,血液学検査,血液生化学検査,器官の絶対重量および相対重量の結果についてBartlettの検定法を行い,等分散性を解析した.等分散の場合は一元配置分散分析法により解析し,不等分散の場合はKruskal-Wallisの検定法で解析した.Kruskal-Wallis法の解析の結果,有意差が認められた場合には,Mann-WhitneyのU-検定法で解析した.
尿比重および尿検査の定性的項目の結果については,Kruskal-Wallisの検定法で解析し,有意差が認められた場合は,Mann-WhitneyのU-検定法を用いて解析した.
これら対照群と被験物質投与群との間の検定においては,いずれも有意水準を5 %とした.
結果
1. 一般状態
投与期間には,雌雄ともに異常は認められなかった.
回復期間には,雄の対照群の1例で回復13日に衰弱が認められたため,屠殺し,剖検を行ったところ,鼻部に骨折が認められ,採尿に使用した代謝ケージ内での事故による可能性が考えられた.雌では異常は認められなかった.
2. 体重
雌雄ともに対照群との間に差は認められなかった.
3. 摂餌量
投与期間には,雄では対照群との間に差は認められなかった.雌では,1000 mg/kg群で投与2日に摂餌量の高値が認められたが,一過性の変化であり,7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウム投与との関連はないものと考えられた.
回復期間には,雌雄ともに対照群との間に差は認められなかった.
4. 尿検査
投与期間最終週には,雄の300,1000 mg/kg群ならびに雌の1000 mg/kg群でカリウム排泄量の高値が認められた.また,雄の1000 mg/kg群でナトリウム排泄量の低値が認められた.
回復期間最終週には,雌の1000 mg/kg群でカルシウム排泄量の高値および飲水量の高値が認められた.しかし,投与期間終了時に同様な変化が認められていないこと,回復期間終了時の血液生化学検査および病理組織学検査で特記すべき変化は認められなかったことから,偶発的な変化と考えられた.
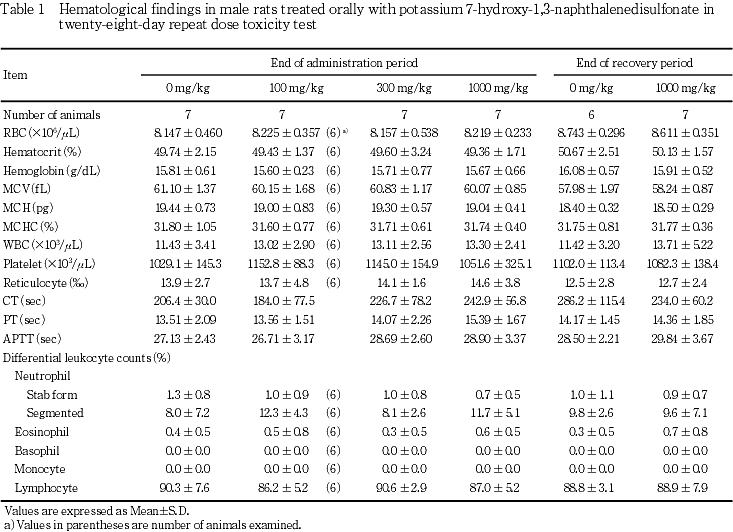
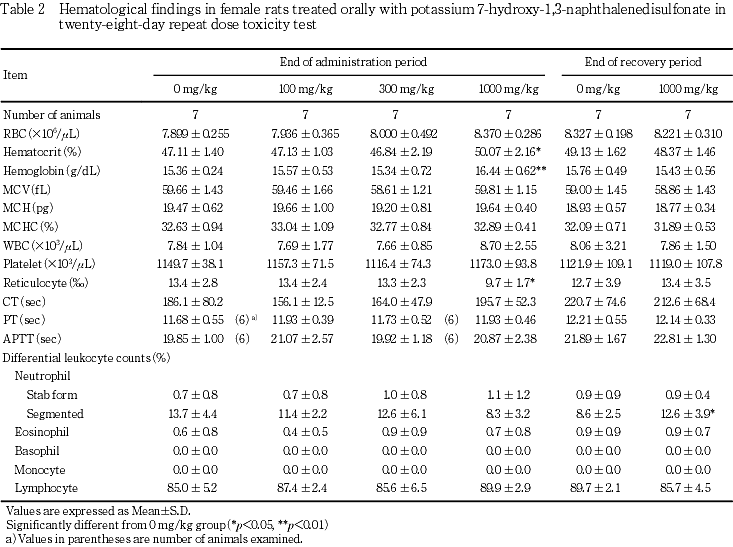
5. 血液学検査(Table 1, 2)
投与期間終了時には,雄では,対照群との間に差は認められなかった.雌では,1000 mg/kg群でヘマトクリット値およびヘモグロビン量の高値,赤血球数の高値傾向ならびに網赤血球率の低値が認められた.
回復期間終了時には,雄では対照群との間に差は認められなかった.雌では,1000 mg/kg群に分葉核好中球率の高値が認められた.しかし,変動幅が小さく,炎症性変化などが認められなかったことから,偶発的な変化と考えられた.
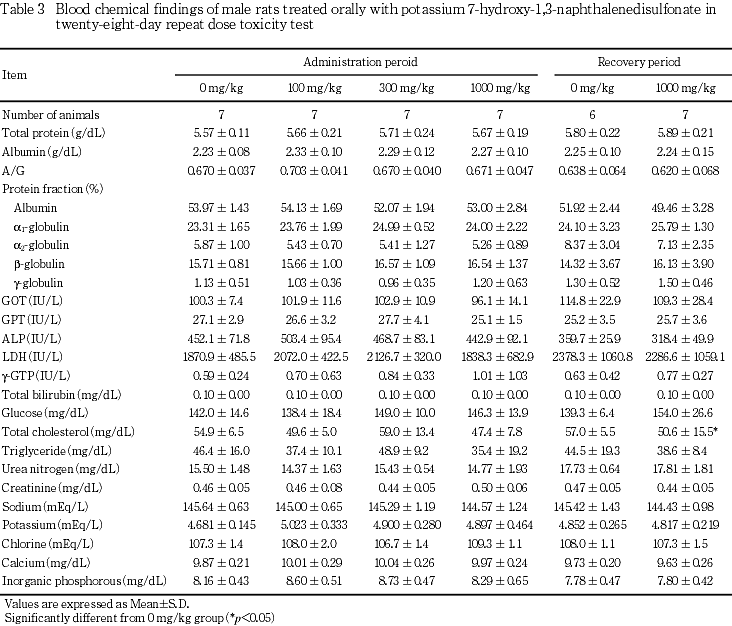
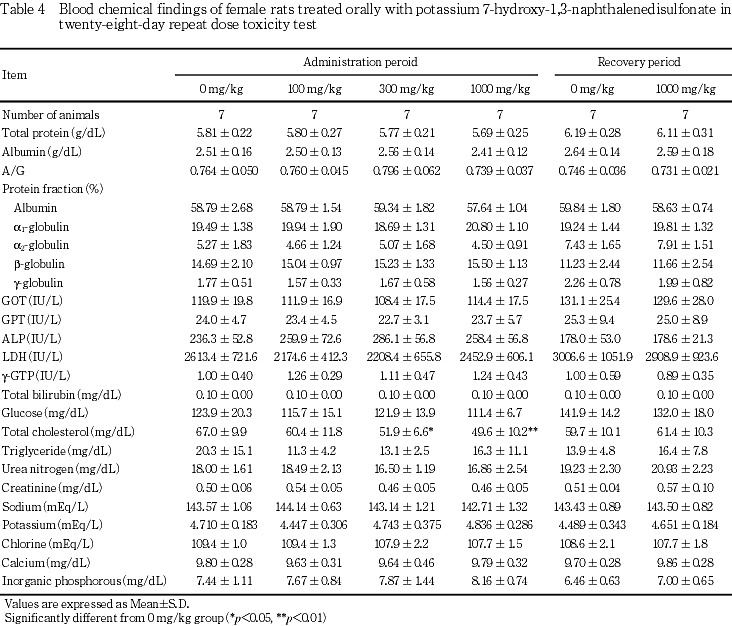
6. 血液生化学検査(Table 3, 4)
投与期間終了時には,雌の300および1000 mg/kg群で総コレステロールの低値が認められた.
回復期間終了時には,雄の 1000 mg/kg群で総コレステロールの低値が認められたが,投与期間終了時にこの変化は認められず,7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウム投与との関連は明らかではなかった.雌では,対照群との間に差は認められなかった.
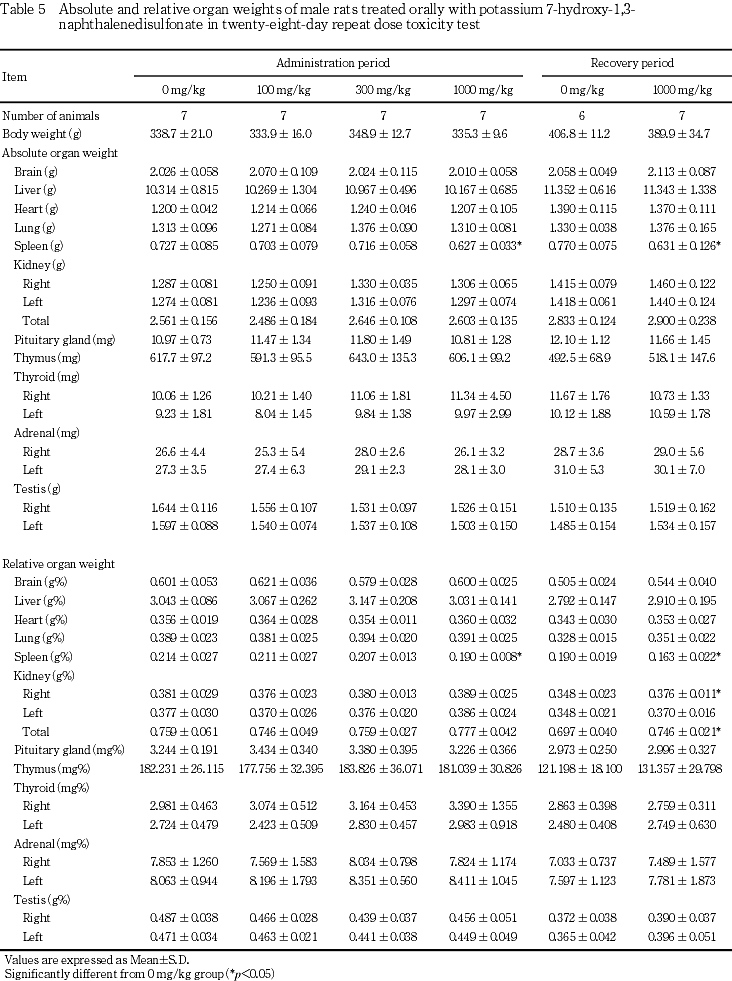
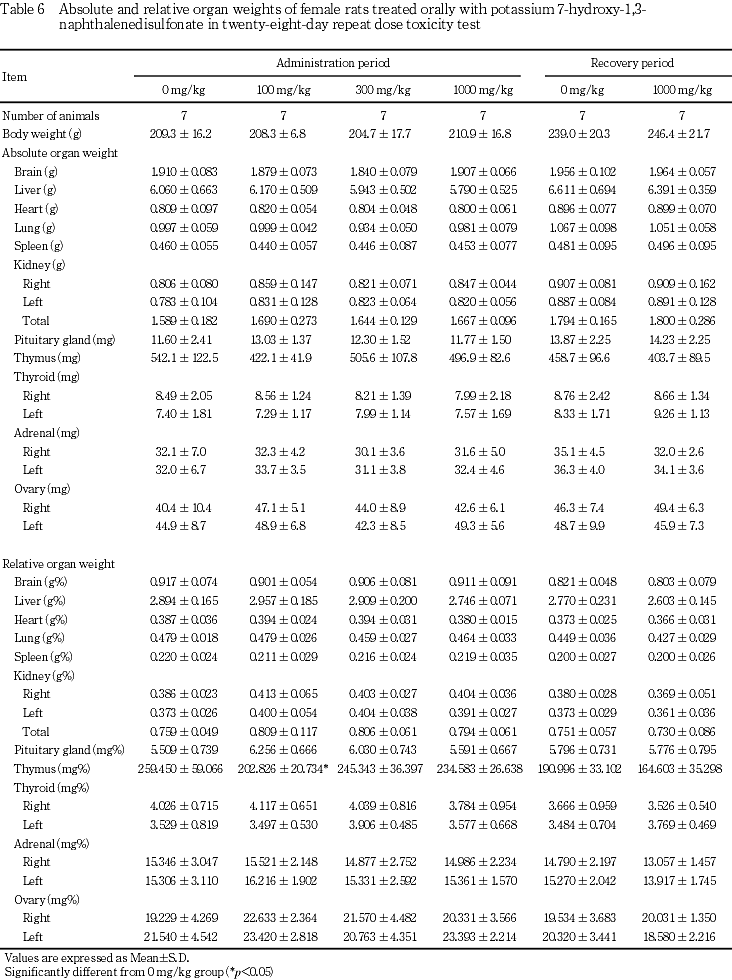
7. 器官重量(Table 5,6)
投与期間終了時には雄の1000 mg/kg群で脾臓の絶対重量および相対重量の低値が認められた.雌では,100 mg/kg群で胸腺の相対重量の低値が認められたが,300および1000 mg/kg群では認められなかった.
回復期間終了時には雄の1000 mg/kg群で脾臓の絶対重量および相対重量の低値が認められた.また,腎臓の相対重量の高値も認められたが,投与期間終了時にこの変化は認められず,7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウムの影響とは考えなかった.雌では対照群との間に差は認められなかった.
8. 剖検
投与期間終了時および回復期間終了時には,雌雄ともに7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウム投与と関連する所見は認められなかった.
9. 病理組織学検査
雌雄ともに7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウム投与と関連する所見は認められなかった.
考察
7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウムの0(1 %カルメロースナトリウム水溶液),100,300および1000 mg/kgを1群あたり雌雄各7あるいは14匹のCrj:CD(SD)ラットに28日間反復経口投与して毒性を検討し,さらに0および1000 mg/kg群の雌雄各7匹を用いて14日間の回復性も併せて検討した.
一般状態,体重,摂餌量,剖検および病理組織学検査では,7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウム投与による変化は認められなかった.
尿検査では,投与4週にカリウム排泄量の高値が雄の300および1000 mg/kg群ならびに雌の1000 mg/kg群で認められた.カリウム排泄量の高値は経口投与された7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウム中のカリウムが尿中に排泄されたことに起因した変化であると推察され,毒性的な変化とは考えられなかった.また,血中カリウム濃度に変化は認められなかったことから,カリウムの排泄は速やかであったと考えられた.雄の1000 mg/kg群では投与4週にナトリウム排泄量の低値も認められ,カリウム排泄量の増加に対するナトリウムの再吸収亢進の可能性も考えられた.しかし,カリウム排泄量の高値がみられた雄の300 mg/kg群および雌の1000 mg/kg群ではそのような傾向がみられず,ナトリウム排泄量の変化は生理的な変動範囲内であり,その他の腎機能パラメータあるいは腎臓の病理組織学検査では7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウム投与によると考えられる変化は認められなかったことから毒性的な変化とは考えられなかった.
血液学検査では,投与期間終了時に雌の1000 mg/kg群でヘマトクリット値,ヘモグロビン量および赤血球の高値あるいは高値傾向ならびに網赤血球率の低値が認められ,7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウム投与の影響と考えられた.しかし,造血器系の病理組織学検査では異常は認められず,その機序は明らかにならなかった.血液生化学検査では,投与期間終了時に雌の300および1000 mg/kg群で総コレステロールの低値が認められ,7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウム投与の影響と考えられた.しかし,肝臓等の病理組織学検査では異常は認められず,その機序は明らかにならなかった.なお,回復期間終了時の血液学検査および血液生化学検査ではこれらの変化は認められず,いずれも可逆的な変化と考えられた.
器官重量では,雄の1000 mg/kg群で投与期間終了時および回復期間終了時に脾臓の絶対重量および相対重量の低値が認められたが,その機序は明らかにならなかった.
以上のことから,本試験における7-ヒドロキシ-1,3-ナフタレンジスルホン酸カリウムの無影響量(NOEL)は,雄で300 mg/kg/day,雌で100 mg/kg/dayであると考えられた.
| 連絡先 |
| 試験責任者: | 吉村浩幸 |
| 試験担当者: | 茂野 均,長谷淳一,古川正敏,河村公太郎,武田みよ子 |
| (株)化合物安全性研究所 |
| 〒004-0839 札幌市清田区真栄363番24 |
| Tel 011-885-5031 | Fax 011-885-5313 | |
| Correspondence |
| Authors: | Hiroyuki Yoshimura(Study director)
Hitoshi Shigeno, Junichi Nagaya, Masatoshi Furukawa, Kotaro Kawamura, Miyoko Takeda |
| Safety Research Institute for Chemical Compounds Co., Ltd. |
| 363-24 Shin-ei, Kiyota-ku, Sapporo, Hokkaido, 004-0839, Japan |
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | |

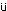 nwald-Giemsa染色)を測定し,大腿静脈から採取した無処理血液を用いて凝固時間(流体粘度変化による空気圧測定法,マイクロコアグロメーター,グライナー)を測定した.さらに,腹部大動脈より採取した血液をクエン酸ナトリウムで処理した後,3000回転/分で10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
nwald-Giemsa染色)を測定し,大腿静脈から採取した無処理血液を用いて凝固時間(流体粘度変化による空気圧測定法,マイクロコアグロメーター,グライナー)を測定した.さらに,腹部大動脈より採取した血液をクエン酸ナトリウムで処理した後,3000回転/分で10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
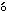 blewski & La Due法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),グルコース(ヘキソキナーゼ法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff
blewski & La Due法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),グルコース(ヘキソキナーゼ法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff 法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)およびアルブミン(BCG法)(以上,自動分析装置7150形,日立製作所),ナトリウムおよびカリウム(以上,炎光光度法,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),A/G比(総蛋白,アルブミンより算出)ならびに蛋白分画(セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)およびアルブミン(BCG法)(以上,自動分析装置7150形,日立製作所),ナトリウムおよびカリウム(以上,炎光光度法,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),A/G比(総蛋白,アルブミンより算出)ならびに蛋白分画(セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.





