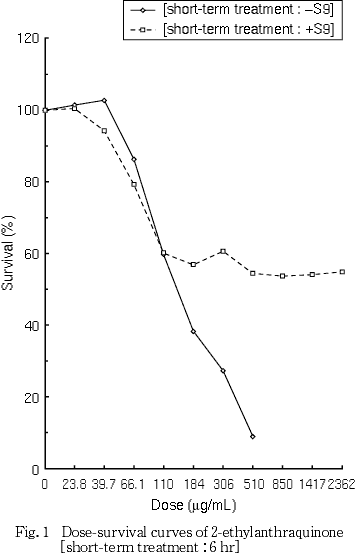
細胞増殖抑制試験結果をもとに,短時間処理法-S9処理では640 μg/mLを最高処理濃度とし,20.0〜640 μg/mLの6用量を,+S9処理では2362 μg/mL(10 mM相当)を最高処理濃度とし,148〜2362 μg/mLの5用量を設定した.S9 mix存在下および非存在下で6時間処理(18時間の回復時間)後,標本を作製し,検鏡することにより染色体異常誘発性を検討した.-S9処理では40.0〜640 μg/mLの5用量,+S9処理では10 mM相当の濃度を含む591〜2362 μg/mLの3用量について顕微鏡観察を実施した.
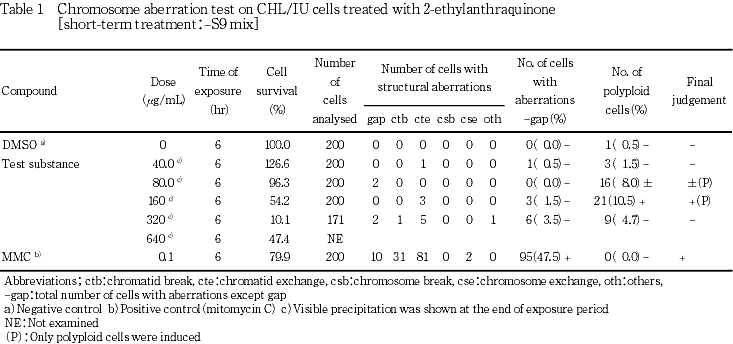
その結果,S9 mix非存在下では倍数性細胞の出現頻度が試験用量に依存して増加する傾向を示し,陽性反応と判断した.S9 mix存在下では,染色体構造異常の僅かな誘発がみられ疑陽性結果(±)が得られた.従って,析出の認められない用量を含む9.38〜600 μg/mLの7用量を用いた確認試験を実施した.顕微鏡観察については37.5〜600 μg/mLの5用量について実施した.その結果,染色体構造異常の僅かな誘発(疑陽性:±)が認められた.
以上の結果より,本試験条件下では2-エチルアントラキノンは,染色体異常を誘発する(陽性)と結論した.
| 成 分 | S9 mix 1 mL中の量 |
| S9 | 0.3 mL |
| MgCl2 | 5 μmol |
| KCl | 33 μmol |
| G-6-P | 5 μmol |
| NADP | 4 μmol |
| HEPES緩衝液(pH 7. 2) | 4 μmol |
| 精製水 | 残 量 |
細胞を10 vol%中性緩衝ホルマリン液(和光純薬工業(株))で固定した後,0.1 w/v%クリスタル・バイオレット(関東化学(株))水溶液で10分間染色した.色素溶出液(30 vol%エタノール,1 vol%酢酸水溶液)を適量加え,5分間程度放置して色素を溶出した後,580 nmでの吸光度を測定した.各用量群について溶媒対照群での吸光度に対する比,すなわち細胞生存率を算出し,さらにプロビット法を用いて50 %細胞増殖抑制濃度を算出した.
その結果,細胞増殖を50 %抑制する濃度は,短時間処理法-S9処理で161 μg/mLと算出された.一方,+S9処理の場合,弱い細胞増殖抑制作用は認められたが,最高用量である2362 μg/mL(10 mM相当)においても50 %以上の抑制を示すことはなかった(Fig. 1).
なお,被験物質暴露終了時,-S9処理の23.8 μg/mL以上および+S9処理の66.1 μg/mL以上で白色膜状の-S9処理の306 μg/mL以上および+S9処理の184 μg/mL以上の用量では白色粉末状の,さらに+S9処理の306 μg/mL以上では白色塊状の析出がみられた.本被験物質は高用量群においては懸濁液での処理であったことから両処理法の510 μg/mL以上では培養液中に被験物質が残存していた.

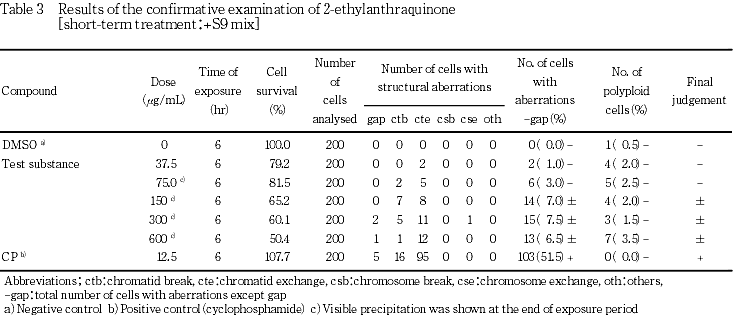
+S9処理において染色体構造異常の出現に関し疑陽性と判定されたことから,600 μg/mLを最高処理濃度とした確認試験を実施し,公比2で減じた計7用量を設定した.
なお,陽性対照として,-S9処理でマイトマイシンC(MMC:協和醗酵工業(株))を0.1 μg/mL,+S9処理でシクロホスファミド(CP:塩野義製薬(株))を12.5 μg/mLの用量で試験した.
すべての標本をコード化した後,マスキング法で観察した.
各試験群の構造異常を有する細胞あるいは倍数性細胞の出現頻度を,石館ら3)の基準に従って判定した.染色体異常を有する細胞の出現頻度が5 %未満を陰性(-),5 %以上10 %未満を疑陽性(±),10 %以上を陽性(+)とした.最終的には再現性あるいは用量に依存性が認められた場合に陽性と判定した.
なお,統計学的手法を用いた検定は実施しなかった.
また,分裂中期像の20 %にいずれかの異常を誘発するのに必要な被験物質濃度であるD20値を最小二乗法により算出した.
本被験物質処理群の+S9処理で染色体構造異常の出現頻度が疑陽性と判定されたことから確認試験を実施した.その結果,陽性判定基準の10 %を超えることはなかったが,染色体構造異常の誘発に再現性が認められた(Table 3).倍数性細胞の誘発傾向および強い細胞増殖抑制作用は観察されなかった.一方,陽性対照では染色体構造異常の顕著な誘発が認められた.
変異原性の強さに関する相対的比較値であるD20値は0.290(mg/mL)と算出され,既知変異原性物質に比較して2-エチルアントラキノンの変異原性は弱いことを示していた.なお,被験物質暴露終了時,短時間処理法-S9処理および+S9処理ではすべての用量で,確認試験では75.0 μg/mL以上の用量で白色膜状等の析出物が認められた.また,高用量では懸濁液での処理であったことから白色粉末状の被験物質が残存していた.
以上の試験結果から,本試験条件下において2-エチルアントラキノンのチャイニーズハムスター培養細胞に対する染色体異常誘発性に関し,陽性と判定した.
なお,本被験物質の変異原性に関する報告はなかったが,類縁体であるanthraquinoneについてはAmes試験で陽性4),2-aminoanthraquinoneは染色体異常試験で陽性4),1,4-diaminoanthraquinoneはAmes試験および染色体異常試験で陽性4),1-aminoanthraquinoneはAmes試験で陽性5),染色体異常試験で陰性5)との報告があった.

| 1) | A. Matsuoka, M. Hayashi and M. Ishidate Jr., Mutat. Res., 66, 277(1979). |
| 2) | 日本環境変異原学会・哺乳動物試験分科会編,“化学物質による染色体異常アトラス,”朝倉書店,東京,1988, pp. 31-35. |
| 3) | 石館基監修,“<改訂>染色体異常試験データ集,”エル・アイ・シー,東京,1987, pp. 19-24. |
| 4) | 労働省労働基準局安全衛生部化学物質調査課監修,“労働安全衛生法有害性調査制度に基づく既存化学物質変異原性試験データ集,”日本化学物質安全・情報センター,東京,1996. |
| 5) | 渋谷徹,化学物質毒性試験報告,3, 103-109(1996). |
| 連絡先 | |||
| 試験責任者: | 中嶋 圓 | ||
| 試験担当者: | 植田ゆみ子,北澤倫世,益森勝志,熊平智司,梶原玲子,加藤木かな江,鈴木ゆみ子,永井美穂 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田郡福田町塩新田582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | ||||
| Authors: | Madoka Nakajima(Study Director) Yumiko Ueta, Michiyo Kitazawa, Shoji Masumori, Satoshi Kumadaira, Reiko Kajihara, Kanae Katogi, Yumiko Suzuki, Miho Nagai | |||
| Biosafety Research Center, Foods, Drugs and Pesticides(An-pyo Center) | ||||
| 582-2 Shioshinden, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan | ||||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |||