アセナフテンのラットを用いる28日間反復経口投与毒性試験
Twenty-eight-day Repeat Dose Oral Toxicity Test of Acenaphthene in Rats
要約
アセナフテンを12,60,および300 mg/kgの用量でCrj:CD(SD)系雌雄ラットに28日間強制経口投与し,その毒性を検討した.対照群,60および300 mg/kg群については,別に14日間の回復群を設けた.
被験物質に起因する一般状態の変化はみられず,体重への影響もみられなかった.
摂餌量では,投与開始初期に一時的な減少が300 mg/kg群の雄でみられ,血液化学的検査では,総コレステロールの増加が300 mg/kg群の雌雄に,リン脂質の増加が60 mg/kg群の雌および300 mg/kg群の雌雄に,総ビリルビンの増加が300 mg/kg群の雄にみられた.尿検査および血液学検査では被験物質投与の影響は認められなかった.
病理学的検査では, 肝臓で重量の増加が300 mg/kg群の雌雄にみられ,組織学的には小葉中心性の肝細胞の肥大がみられた.また,腎臓の尿細管上皮における好酸性小体の出現頻度の増加が60および300 mg/kg群の雄にみられた.
回復群では,上記の変化はいずれも消失し,いずれも可逆性のものと考えられた.
以上の結果から,本試験条件下におけるアセナフテンの無影響量は雌雄ともに12mg/kg/dayと考えられた.
方法
1.被験物質および被験液の調製
被験物質アセナフテンは,分子量154.22,融点94℃,沸点279℃の淡黄色結晶で,水に不溶,エタノールおよびメタノールにやや溶けやすく,クロロホルム,トルエンおよびベンゼンに溶けやすい.本試験にはロット番号709S4016(関東化学(株)製),純度99.9%のものを用いた.なお,投与終了後の残余被験物質について分析を行った結果,使用期間中は安定であったことが確認された.
投与容量が5 ml/kg体重となるよう,0.5%メチルセルロース水溶液に懸濁して0.24,1.2および6%(w/v)懸濁液を調製した.0.2〜20%(w/v)懸濁液は,室温で1日間および冷蔵(約4℃)・遮光(褐色ガラス瓶)で8日間まで安定であったことから,被験液は最大1週間分を一括して調製し,1日分ずつ褐色ガラス瓶に分注して冷蔵庫(約4℃)に保存した.また,投与開始前および投与終了週の2回,投与に使用する各濃度液について当施設で測定した結果,いずれも濃度は適正でかつ均一であった.
2.使用動物および飼育条件
5週齢のCrj:CD(SD)系SPF雌雄ラットを日本チャールス・リバー(株)から購入し,当所で約1週間検疫・馴化飼育した後,体重増加が順調で一般状態に異常を認めなかった雌雄各42匹を選び,6週齡で試験に供した.投与開始日の体重範囲は,雄で180〜200 g(平均値:190.2 g),雌で138〜168 g(平均値:153.4 g)であった.
動物は,群分け当日の体重に基づいて層別化し,各群平均体重がほぼ均等となるよう,コンピュータを用いて各群に割り付けた.
動物は,温度23±3℃,相対湿度50±20%,換気回数1時間当たり10〜15回,照明1日12時間の飼育室で,金属製網ケージに1匹ずつ収容し,固型飼料(放射線滅菌CRF-1,オリエンタル酵母工業(株))および飲料水(水道水)を自由に摂取させ飼育した.
3.投与量,群構成および動物数
2週間投与による予備試験(投与量:100,300および1000 mg/kg)の結果,1000 mg/kg群では一過性の体重増加抑制および摂餌量の低下,ヘモグロビン量およびヘマトクリット値の低下,総コレステロールおよび総ビリルビンの増加ならびに肝臓および腎臓重量の増加などがみられた.また,300 mg/kg群では総コレステロールの増加および肝臓重量の増加などが,さらに100 mg/kg群では雌のみで総コレステロールの増加および肝臓重量の増加がみられた.これらの成績から,本試験では300,60および12 mg/kgの3用量を設定し,これに対照群を加えて計4群を使用した.さらに,対照群,60および300 mg/kg群では回復群を設けた.動物数はいずれの群も雌雄各6匹とした.
被験液の投与容量は5 ml/kg体重とし,金属製胃ゾンデを用いて1日1回28日間強制経口投与した.対照群には溶媒(0.5%メチルセルロース水溶液)を同様に投与した.投与液量は最新の体重を基準に算出した.回復期間は14日間とした.
4.検査項目
1)一般状態の観察
投与期間中は毎日2回以上,回復期間中は毎日1回観察した.
2)体重
投与期間および回復期間を通じ,週2回の頻度で体重を測定した.
3)摂餌量測定
投与期間および回復期間を通じ,週2回の頻度で摂餌量を測定した.
4)血液学検査
投与期間および回復期間終了の翌日の剖検時に検査を行った.前日から一夜(約16時間)絶食させた動物をエーテル麻酔下で開腹し,腹大動脈から抗凝固剤(EDTA-2K)を加えた採血ビンに血液を採取し,赤血球数(電気抵抗変化検出法),ヘモグロビン量(シアンメトヘモグロビン法),ヘマトクリット値(平均赤血球容積および赤血球数から算出),平均赤血球容積(電気抵抗変化検出法),平均赤血球血色素量(ヘモグロビン量および赤血球数から算出),平均赤血球血色素濃度(ヘモグロビン量およびヘマトクリット値から算出),血小板数(電気抵抗変化検出法),白血球数(電気抵抗変化検出法)(以上コールター全自動8項目血球アナライザーT890,(株)日科機),網赤血球率(Brecher法)および白血球百分率(May-Giemsa鏡検法)を測定した.また,3.8%クエン酸ナトリウムを加えた容器に採取した血液を遠心分離(3000 rpm,10分間)し,得られた血漿を用いてプロトロンビン時間および活性化部分トロンボプラスチン時間(以上クロット法,血液凝固自動測定装置,ACL-100,Instrumentation Laboratory)を測定した.
5)血液生化学検査
血液学検査のための採血と同時に腹大動脈から採血し,遠心分離(3000 rpm,10分間)により得られた血清を用いてAlP(Bessey-Lowry法),総コレステロール(CEH-COD-POD法),トリグリセライド(GK-GPO-POD法),リン脂質(PLD-ChOD-POD法),総ビリルビン(アゾビリルビン法),血糖(Hexokinase-G6PD法),尿素窒素(Urease-GLDH法),クレアチニン(Jaff 法),ナトリウム,カリウムおよび塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総蛋白質(Biuret法),アルブミン(BCG法)およびA/G比(総蛋白質およびアルブミンから算出)を測定した.また,ヘパリンを加えた容器に採血し,遠心分離(3000 rpm,10分間)により得られた血漿を用いてGOT,GPT,LDH(UV-rate法),γ-GTP(γ-グルタミル-3-カルボキシ-4-ニトロアニリド法)およびChE(DTNB法)(以上いずれも自動分析装置Monarch,Instrumentation Laboratory)を測定した.
法),ナトリウム,カリウムおよび塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総蛋白質(Biuret法),アルブミン(BCG法)およびA/G比(総蛋白質およびアルブミンから算出)を測定した.また,ヘパリンを加えた容器に採血し,遠心分離(3000 rpm,10分間)により得られた血漿を用いてGOT,GPT,LDH(UV-rate法),γ-GTP(γ-グルタミル-3-カルボキシ-4-ニトロアニリド法)およびChE(DTNB法)(以上いずれも自動分析装置Monarch,Instrumentation Laboratory)を測定した.
6)尿検査
投与期間終了時剖検動物は投与第4週(検査当日の投与後)に,回復群の動物は回復第2週に検査を行った.検査動物を代謝ケージに個別に収容し,絶食・自由摂水下で4時間尿を,次いで自由摂食・自由摂水下でその後の20時間尿を採取した.採取した最初の4時間尿を用いてpH,蛋白質,ケトン体,ブドウ糖,潜血,ビリルビン,ウロビリノーゲン(以上URIFLET7A試験紙,(株)京都第一科学),色調(肉眼観察)および沈渣(鏡検)を検査した.また,その後に得られた20時間尿を用いて比重(屈折法,アタゴ屈折計,(株)アタゴ)を測定し,4時間尿量および20時間尿量から1日の尿量を算出した.さらに,代謝ケージに収容した状態で,前日からの1日の摂水量を給水瓶を用いて測定した.
7)剖検および器官重量
上記血液学検査および血液生化学検査のための採血後に放血致死させ,外表異常の有無を観察した後,頭部,胸部および腹部を含む全身の器官・組織について肉眼的に異常の有無を観察した.続いて,以下に示す器官を摘出後,器官重量(絶対重量)を測定した.また,絶食後の体重および絶対重量から体重100 g当たりの相対重量を算出した.
脳,胸腺,甲状腺(上皮小体を含む),心臓,肺(気管支を含む),肝臓,脾臓,腎臓,副腎,精巣,卵巣
8)病理組織学検査
全動物について以下に示す全器官・組織を採取し,リン酸緩衝10%ホルマリン液(但し,眼球は3%グルタルアルデヒド・2.5%ホルマリン液)で固定したのちパラフィンに包埋した.投与期間終了時剖検動物では,このうち対照群と高用量群は包埋した全ての器官・組織について,また,中および低用量群は被験物質投与による変化が疑われた肝臓,腎臓および胃についてそれぞれ切片とし,ヘマトキシリン・エオジン(H.E.)染色を施して鏡検した.回復群では,被験物質投与による変化が疑われた上記の肝臓,腎臓および胃について,まず対照群と高用量群の動物を検査した.その結果,被験物質による影響がみとめられなかったため,中用量群については鏡検しなかった.また,肉眼的異常部位については用量に関係なく鏡検した.
脳,脊髄,坐骨神経,心臓,気管,肺(気管支を含む),胃,十二指腸,空腸,回腸,盲腸,結腸,直腸,肝臓,膵臓,下垂体,甲状腺(上皮小体を含む),副腎,胸腺,脾臓,腸間膜リンパ節,頸部リンパ節,腎臓,膀胱,精巣,精巣上体,前立腺,卵巣,子宮,腟,眼球,骨及び骨髄(胸骨・大腿骨),肉眼的異常部位
5.統計解析
各検査項目のうち,数値化した成績についてまずBartlett法により各群の分散の均一性の検定を行った.その結果,分散が均一の場合には一元配置法による分散分析を行い,群間に有意差が認められたならば,Dunnett法を用いて対照群と各投与群との平均値の差の検定を行った.分散が均一でない場合には,Kruskal-Wallisの順位検定を行い,有意であればDunnett型の方法(Steel法)を用いて対照群と各投与群との平均順位の差の検定を行った.検定はいずれも両側で,有意水準は5および1%とした1).また,病理組織学的検査の成績については,Mann-WhitenyのU検定を行った.検定は片側で,有意水準は5および1%とした.
結果
1.一般状態
死亡はみられず,いずれの動物にも異常はみられなかった.
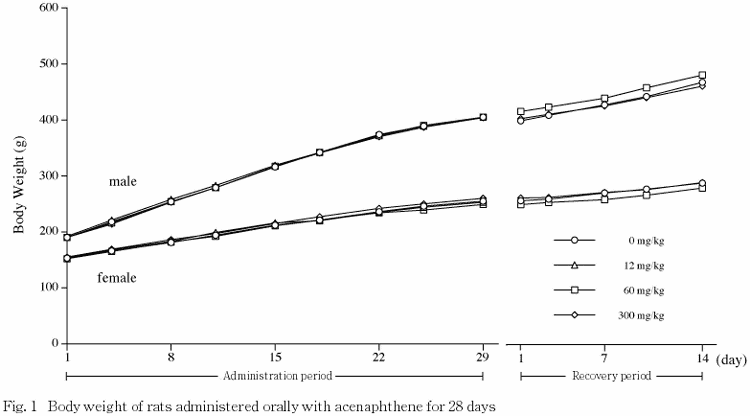
2.体重(Fig.1)
1)投与期間
雌雄ともに,各投与群の体重は対照群と同様に推移した.
2)回復期間
雌雄ともに,各投与群の体重は対照群と同様に推移した.
3.摂餌量
1)投与期間
雄では,300 mg/kg群で投与4日に対照群を有意に下回った.しかし,その後は対照群と同様に推移した.雌では,対照群と同様に推移した.
2)回復期間
雌雄ともに,各投与群の摂餌量は対照群と同様に推移した.
4.血液学検査(Table 1)
1)投与期間終了時検査
雌雄ともに,被験物質投与による変化はみられなかった.なお,プロトロンビン時間の有意な延長が60 mg/kg群の雄にみられたが,用量 に関連した変化ではなかった.
2)回復期間終了時検査
雄では,300 mg/kg群で白血球数の有意な増加がみられた.雌では,被験物質投与による変化はみられなかった.

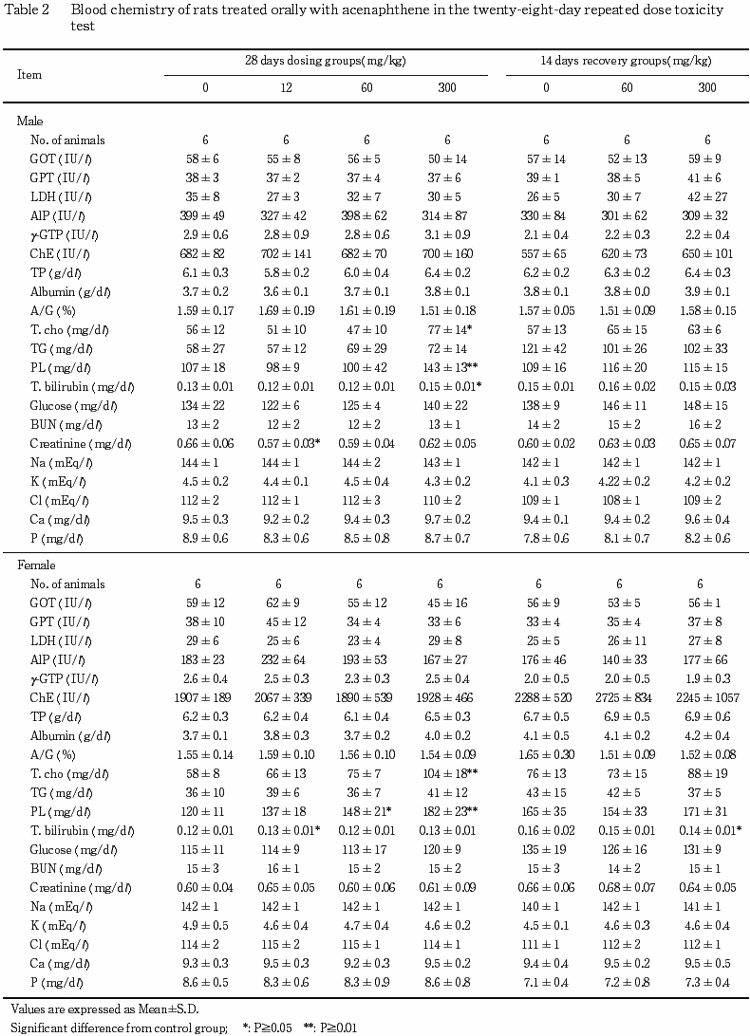
5.血液生化学検査(Table 2)
1)投与期間終了時検査
雄では,300 mg/kg群で総コレステロール,リン脂質および総ビリルビンの有意な増加がみられた.なお,12 mg/kg群でクレアチニンの有意な減少がみられたが,用量に関連した変化ではなかった.雌では,300 mg/kg群で総コレステロールおよびリン脂質の有意な増加がみられ,リン脂質の増加は60 mg/kg群でもみられた.なお,12 mg/kg群で総ビリルビンの有意な増加がみられたが,用量に関連した変化ではなかった.
2)回復期間終了時検査
雄では,被験物質投与による変化はみられなかった.
雌では,300 mg/kg群で総ビリルビンの有意な減少がみられた.
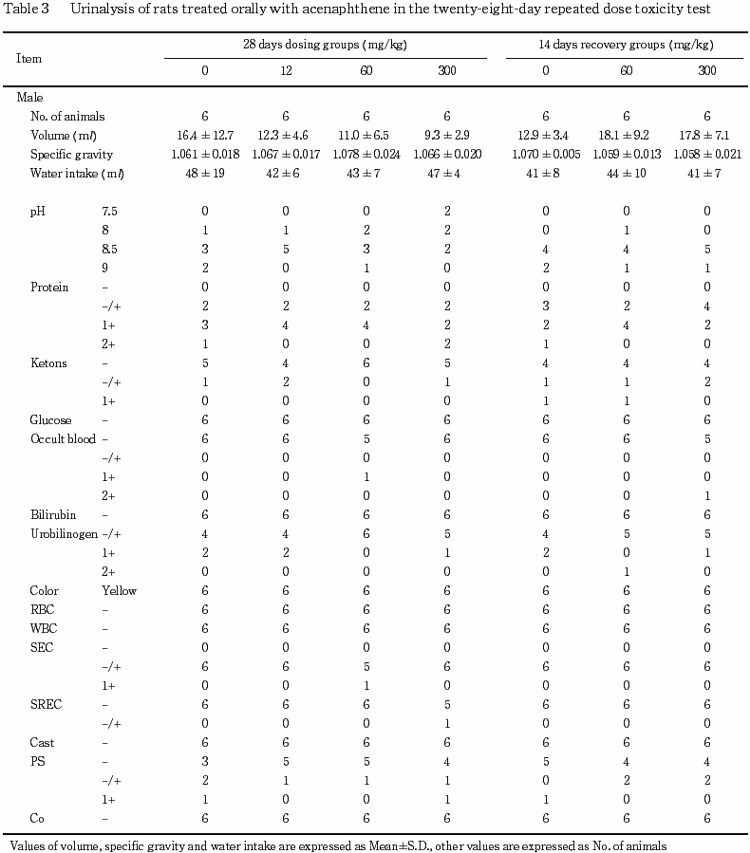
6)尿検査(Table 3)
1)投与第4週検査
雌雄ともに,被験物質投与による変化はみられなかった.
2)回復第2週検査
雄では,被験物質投与による変化はみられなかった.
雌では,300 mg/kg群において摂水量の有意な増加,尿比重の有意な低下および尿量の増加傾向がみられた.

7.器官重量(Table 4)
1)投与期間終了時剖検例
肝臓で,絶対および相対重量の有意な増加が300 mg/kg群の雌雄にみられた.
他に,心臓の相対重量の有意な減少が12 mg/kg群の雌にみられたが,用量に関連した変化ではなかった.
2)回復期間終了時剖検例
雌雄ともに,被験物質投与による変化はみられなかった.

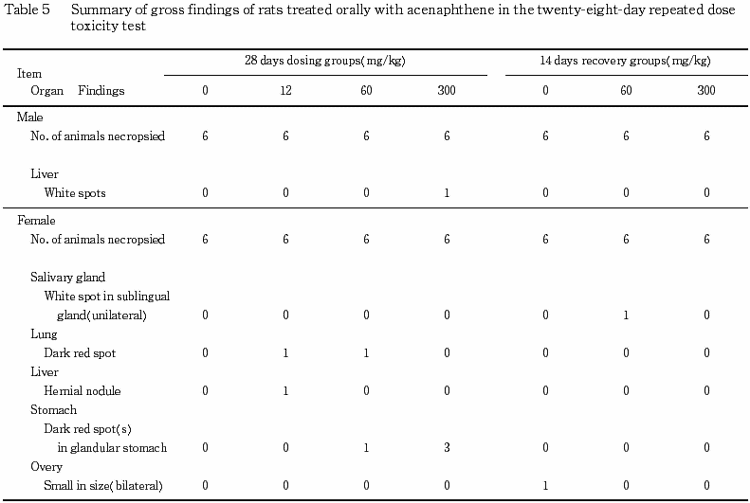
8.剖検所見(Table 5)
1)投与期間終了時剖検例
肝臓の白色点が300 mg/kg群の雄1例に,腺胃の暗赤色点が60 mg/kg群の雌1例と300 mg/kg群の雌3例にみられた.
他に,肺の暗赤色点が12および60 mg/kg群の雌各1例,肝臓のヘルニア結節が12 mg/kg群の雌1例にみられた.
2)回復期間終了時剖検例
被験物質投与によると考えられる変化はみられなかった.
なお,唾液腺(舌下腺)の白色点(片側性)が60 mg/kg群の雌1例に,卵巣の小型化(両側性)が対照群の雌1例にみられた.
9.病理組織学的検査(Table 6)
1)投与期間終了時剖検例
被験物質投与によると考えられる変化が肝臓および腎臓にみられた.
肝臓:小葉中心性の肝細胞のごく軽度または軽度な肥大が300 mg/kg投与群の雌雄全例にみられた.
腎臓:尿細管上皮のごく軽度または軽度な好酸性小体が,対照群の雄2例,12 mg/kg群の雄3例,60 mg/kg群の雄5例および300 mg/kg群の雄6例全例にみられ,60 mg/kg以上の投与群の雄において出現頻度の有意な増加が認められた.
上記以外の所見は出現状況とその病理学的性状からいずれも偶発所見と判断した.
2)回復期間終了時剖検例
被験物質投与によると考えられる変化は,いずれの組織・器官にも認められなかった.

考察
試験期間を通じて死亡はみられず,また,一般状態および体重推移にも被験物質投与による変化は認められなかった.
摂餌量では,300 mg/kg群の雄で投与開始4日に減少を示したが,その後は対照群と同様に推移した.
尿および血液学検査では,投与期間中の検査において被験物質投与によると考えられる変化はみられなかった.
血液生化学検査では,300 mg/kg群の雌雄で総コレステロールとリン脂質の増加,60 mg/kg群の雌でリン脂質の増加がみられ,被験物質の脂質代謝に対する影響が示唆された.また300 mg/kg群の雄で総ビリルビンの増加がみられ,後述の病理学的検査とともに被験物質の肝臓に対する影響が示唆された.
病理学的検査では,肝臓および腎臓に変化がみられた.肝臓では,300 mg/kg群の雌雄で重量が増加,組織学的には小葉中心性の肝細胞の肥大が認められ,血液生化学検査における総コレステロールおよびリン脂質の増加との関連性は明らかでないものの被験物質の肝臓に対する影響が示唆された.
腎臓では,尿細管上皮における好酸性小体の出現頻度の増加が60および300 mg/kg群の雄にみられた.しかし,この変化は雄ラットにしばしば生理的変化としてみられるものであり,本試験でみられた変化が尿細管への障害を伴わないごく軽度なものであることから毒性学的意義は乏しいと推察される.
回復群においては,上記の変化はいずれも消失し,全て可逆性の変化と考えられた.なお,尿検査において,300 mg/kg群の雌に摂水量および尿量の増加と尿比重の低下がみられたが,投与第4週の検査において被験物質投与の影響が認められず,背景資料と比較しても生理的変動の範囲内と考えられることから毒性学的意義はないと判断した.また,血液学検査では,300 mg/kg群の雄に白血球数の増加がみられたが,投与期間終了時の検査において変化がみられず,剖検および病理組織学的検査においても白血球数の増加を示唆するような変化が認められないこと,さらに,背景資料と比較すると正常な生理的変動の範囲内と考えられることから,毒性学的意義はないと判断した.
以上の如く,アセナフテンをラットに28日間反復投与した結果,主な変化が300 mg/kg群の雌雄の肝臓にみられ,本被験物質の主な標的器官は肝臓と考えられた.さらに,血液生化学検査において肝臓の脂質代謝への影響を示唆する変化が60 mg/kg以上の投与群の雌および300 mg/kg群の雄にみられ,また,60 mg/kg以上の投与群の雄では腎臓に被験物質投与による影響を示唆する変化が認められた.一方,12 mg/kg群では変化は認められなかった.これらの結果から,本試験におけるアセナフテンの無影響量は雌雄ともに12 mg/kg/dayと推定された.
文献
| 1) | S. C. Gad and C. S. Weil, "Principles and Methods of Toxicology," 2, ed. by A. Wallace Hayes, Raven Press Ltd., New York, 1989, pp. 435-483. |
| 連絡先 |
| 試験責任者 | 榎並倫宣 |
| 試験担当者 | 柳沢哲夫,畠山和久,田村一利,沼田弘明,勝亦倶慶 |
| (株)ボゾリサーチセンター御殿場研究所 |
| 〒412静岡県御殿場市かまど1284 |
| Tel.0550-82-2000 | Fax.0550-82-2379 | |
| Correspondence |
| Authors: | Tomonori Enami(Study director)
Tetsuo Yanagisawa,
Kazuhisa Hatayama,
Kazutoshi Tamura,Hiroaki Numata,
Toyohisa Katsumata |
| Gotemba Laboratory,Bozo Research Center Inc. |
| 1284, Kamado, Gotemba-shi, Shizuoka, 412, Japan |
| Tel.+81-550-82-2000 | Fax.+81-550-82-2379 | |

 法),ナトリウム,カリウムおよび塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総蛋白質(Biuret法),アルブミン(BCG法)およびA/G比(総蛋白質およびアルブミンから算出)を測定した.また,ヘパリンを加えた容器に採血し,遠心分離(3000 rpm,10分間)により得られた血漿を用いてGOT,GPT,LDH(UV-rate法),γ-GTP(γ-グルタミル-3-カルボキシ-4-ニトロアニリド法)およびChE(DTNB法)(以上いずれも自動分析装置Monarch,Instrumentation Laboratory)を測定した.
法),ナトリウム,カリウムおよび塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総蛋白質(Biuret法),アルブミン(BCG法)およびA/G比(総蛋白質およびアルブミンから算出)を測定した.また,ヘパリンを加えた容器に採血し,遠心分離(3000 rpm,10分間)により得られた血漿を用いてGOT,GPT,LDH(UV-rate法),γ-GTP(γ-グルタミル-3-カルボキシ-4-ニトロアニリド法)およびChE(DTNB法)(以上いずれも自動分析装置Monarch,Instrumentation Laboratory)を測定した.







