
以上のように,2-アミノ-1-ナフタレンスルホン酸は1000 mg/kgで雌雄 (P) の一般状態(流涎)および雄 (P) の肝臓重量に影響がみられた.したがって,当試験条件下における一般毒性学的な無影響量は200 mg/kgと推察された.また,生殖発生毒性学的な無影響量は,雌雄の生殖および児動物の発生に関していずれも1000 mg/kgと推察された.
投与検体液は,被験物質を 0.5% CMC 水溶液に懸濁して調製した.投与開始前および投与期間終了前の2回,試験施設内でHPLC法により各投与検体液中の被験物質濃度を測定した.その結果,被験物質濃度はいずれも適正範囲内の値を示した.0.5% CMC水溶液中の1.6, 20および200 mg/ml濃度の被験物質は,調製後冷蔵・遮光下で7日間,さらに室温・遮光下で4時間の保存条件で安定であることが確認された.そこで,投与検体液の調製は1週間に1回以上とし,1日分毎に分割して冷蔵・遮光下で保存し,用時室温に戻して投与に用いた.
動物は,室温20〜24℃,湿度40〜70%,明暗各12時間,換気回数12回/時に設定した飼育室で飼育した.検疫・馴化期間中はステンレス製懸垂式ケージを用いて1ケージあたり5匹までの群飼育とし,群分け後はステンレス製5連ケージを用いて個別飼育した.ただし,交配はステンレス製懸垂式ケージ内で行った.また,母動物は妊娠18日に床敷(サンフレーク,日本チャールス・リバー(株))を入れたプラスチック製ケージに個別に移し,自然分娩および哺育させた.床敷の分析成績は,当試験施設で定めた基準値の範囲内であった.
飼料は,固型飼料(CRF-1,オリエンタル酵母工業(株))を給餌器に入れ,自由に摂取させた.飲料水は,水道水を給水瓶を用いて自由に摂取させた.飼料および飲料水の分析の結果,いずれも検査成績は当試験施設で定めた基準値の範囲内であった.
群構成は,以下の如くとした.1群の動物数は,雌雄各12匹とした.
投与量設定の理由:雄ラットを用いた投与量設定のための2週間経口投与による予備試験(投与段階:0, 30, 100, 300および1000 mg/kg,1群5 匹)の結果,1000 mg/kg群でも死亡発現はなく,一般状態,体重推移および剖検に異常はみられなかった.
そこで,当試験では1000 mg/kgを最高用量として,以下公比5により200, 40 および8 mg/kg群を設定した.対照として,同一液量の媒体投与群を設けた.

投与期間は,雄では交配前14日間およびその後35日間の合計49日間とし,雌では交配前14日間,交配期間中(最長8日間),妊娠期間および哺育4日の剖検の前日(41〜48日間)までとした.投与は1日1回で連日とした.
投与期間中は毎日投与前・後の2回観察した.
(2) 体 重:
1週間に2回および剖検日に測定した.
(3) 摂 餌 量:
交配開始前14日間および交配期間終了後に,1週間に2回連続2日間量を測定して1日量に換算した.なお,剖検前日の夕刻からは絶食とした.
(4) 血液学検査:
最終投与の翌日に,ペントバルビタールナトリウムの腹腔内投与による麻酔下で腹大動脈から血液を採取し,以下の検査を実施した.
プロトロンビン時間 (PT),活性化部分トロンボプラスチン時間 (APTT) およびフィブリノーゲン濃度は,3.13%クエン酸ナトリウムで処理した血漿について,散乱光検出方式により血液凝固分析装置(コアグマスターII,三共(株))を用いて測定した.
赤血球数 (RBC),ヘモグロビン量,ヘマトクリット値,血小板数および白血球数 (WBC) は,EDTA-2KコーティングしたSysmexサンプルカップに採取した血液について,多項目自動血球計数装置(Sysmex E-2000,東亜医用電子(株))を用いて測定した.さらに,平均赤血球容積 (MCV),平均赤血球血色素量 (MCH) および平均赤血球血色素濃度 (MCHC) を算出した.
白血球百分率は,EDTA-2K処理した血液をスライドグラスに塗抹し,May-Giemsa染色標本を作製して顕微鏡下で白血球100個を分類計数した.
網状赤血球数は,EDTA-2K処理した血液をBrecher法により超生体染色してスライドグラスに塗抹後,Giemsa染色した標本を作製して顕微鏡下で赤血球1000個中の数を数えた.
(5) 血液生化学検査:
血液学検査用の血液と同時期に腹大動脈から採取した血液から分離して得た血清について,以下の検査を実施した.
GOTおよびGPTはHenry変法,γ-GTPはγ-G-P-NA基質法,総蛋白 (TP) はBiuret法,尿素窒素 (BUN) はUrease・GlDH法,クレアチニンはJaff ,総ビリルビン (T-Bil) はAzobilirubin法,ブドウ糖はGlucose dehydrogenase法,無機リン (IP) はMolybdenum blue法,Caはo-CPC法により,いずれも自動分析装置(AU 500,オリンパス光学工業(株))を用いて測定した.
,総ビリルビン (T-Bil) はAzobilirubin法,ブドウ糖はGlucose dehydrogenase法,無機リン (IP) はMolybdenum blue法,Caはo-CPC法により,いずれも自動分析装置(AU 500,オリンパス光学工業(株))を用いて測定した.
NaおよびKはイオン選択電極法により,Clは電量滴定法により,いずれも全自動電解質分析装置(EA04,(株) A&T)を用いて測定した.
アルブミン量は,総蛋白量および蛋白分画値(自動電気泳動装置AES 600,オリンパス光学工業(株))から算出した.
(6) 剖検:
上記の (4) および (5) の項で採血した動物をさらに放血致死させた後に,器官・組織の肉眼的観察を行った.肝臓,腎臓,胸腺,精巣および精巣上体を摘出後に重量を測定し,さらに副腎,脳,心臓ならびに脾臓を摘出した.その後,精巣および精巣上体はブアン液に,その他の器官・組織は10%中性緩衝ホルマリン液に固定した.
(7) 病理組織学的検査:
固定した全例の各器官および組織について,常法に従ってパラフィン包埋標本を作製した.対照群および1000 mg/kg群についてはH-E染色組織標本を作製し,病理組織学的検査を行った.
投与期間中は毎日投与前・後の2回観察した.
(2) 性周期:
投与開始日から交尾確認日まで毎日1回観察した.なお,発情期が連続2日間にわたって観察される場合は1回と数えた.
(3) 体重:
交配開始前14日間および交配期間中は毎週2回,妊娠期間中は妊娠0, 7, 14および21日に,哺育期間は哺育0および4日にそれぞれ測定した.
(4) 摂餌量:
交配開始前14日間は,1週間に2回連続2日間量を測定して1日量に換算した.また,妊娠期間中は妊娠0, 7, 14および19日からの連続2日間量を,哺育期間中は哺育0〜4日の累積量を測定し,それぞれ1日量に換算した.
(5) 分娩状態の観察:
自然分娩させ,分娩状態の異常の有無および分娩終了の確認を妊娠21日から妊娠25日の午前10時まで毎日行った.午前10時までに分娩が終了していた場合,その日を哺育0日とした.
(6) 哺育状態の観察および剖検:
哺育4日まで毎日観察し,哺育4日にエーテル麻酔下で腹大動脈より放血致死させた後に剖検して,着床痕数および黄体数を数えた.肝臓,腎臓,胸腺および卵巣を摘出後に重量を測定し,副腎,脳,心臓ならびに脾臓とともに10%中性緩衝ホルマリン液に固定した.
(7) 全新生児が死亡した母動物の処置:
全新生児が死亡した母動物[死産児のみの場合(8 mg/kg群の1例)を含む]は,発見後速やかにエーテル麻酔下で腹大動脈より放血致死させた後に剖検し,着床痕数および黄体数を数えた.肝臓,腎臓,胸腺および卵巣を摘出後に重量を測定し,副腎,脳,心臓ならびに脾臓とともに10%中性緩衝ホルマリン液に固定した.
(8) 病理組織学的検査:
固定した全例の各器官および組織について,常法に従ってパラフィン包埋標本を作製した.対照群および1000 mg/kg群については H-E 染色組織標本を作製し,病理組織学的検査を行った.
交尾確認は毎朝ほぼ一定時刻に行った.腟垢内に精子または腟栓を確認した雌を交尾動物とし,その日を妊娠0日として起算した.
(2) 新生児について,一般状態および死亡の有無を生存期間中毎日1回観察した.
(3) 体重:
哺育0(出生日)および4日に測定した.
(4) 剖検:
哺育4日の観察終了後にエーテル麻酔下で腹大動脈から放血致死させた後,剖検した.
検定では,Bartlett法による等分散性の検定を行い,等分散の場合には一元配置法による分散分析を行い,有意ならば対照群との群間比較はDunnett法(例数が等しい場合)またはScheff 法(例数が等しくない場合)により行った.一方,等分散と認められなかった場合は,順位を利用した一元配置法による分析(Kruskal-Wallisの検定)を行い,有意ならば対照群との群間比較は順位を利用したDunnett法またはScheff
法(例数が等しくない場合)により行った.一方,等分散と認められなかった場合は,順位を利用した一元配置法による分析(Kruskal-Wallisの検定)を行い,有意ならば対照群との群間比較は順位を利用したDunnett法またはScheff 法を用いて行った.
法を用いて行った.
対照群および200 mg/kg以下の投与群では,異常症状はみられなかった.
1000 mg/kg群では,投与開始7日以降には最終投与日まで1〜12例で投与後に流涎がみられた.当症状は投与後2〜3分からみられたが,投与後約10分には消失した.その他には,異常症状は観察されなかった.
2) 体 重
各投与群とも対照群とほぼ同様の体重推移を示し,いずれの測定日にも有意差は認められなかった.
3) 摂餌量
1000 mg/kg群で投与6日に有意な高値が認められた以外には,対照群との間に有意差は認められなかった.
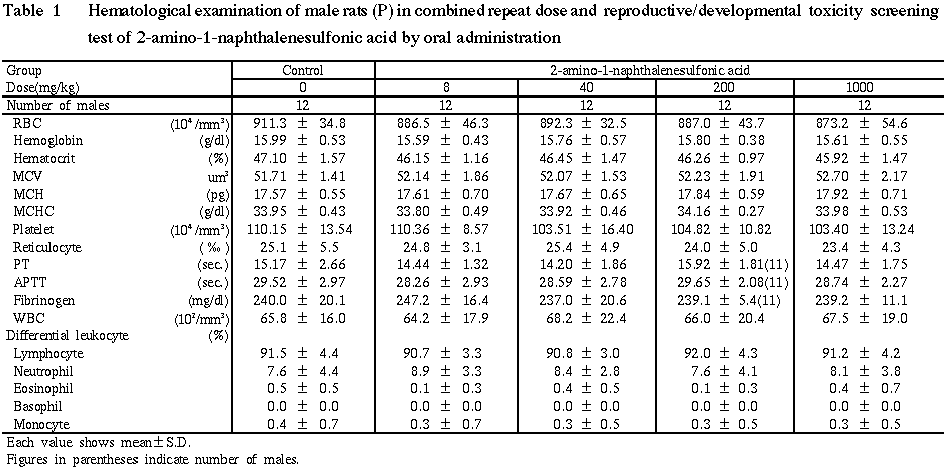
4) 血液学検査 (Table 1)
各投与群のいずれの測定項目とも対照群とほぼ同程度であり,有意差は認められなかった.
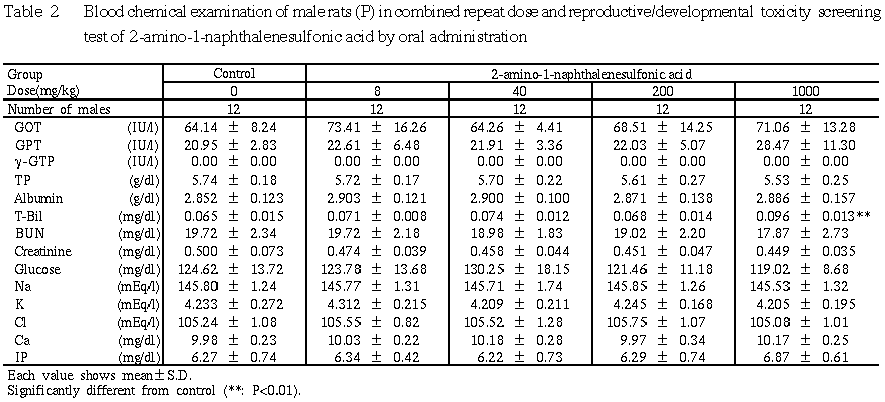
5) 血液化学検査 (Table 2)
1000 mg/kg群では,対照群に比して総ビリルビンが有意な高値を示した.その他の検査項目は各投与群とも対照群とほぼ同程度であり,有意差は認められなかった.
6) 剖検所見
対照群および各投与群のいずれの例とも,剖検で著変はみられなかった.
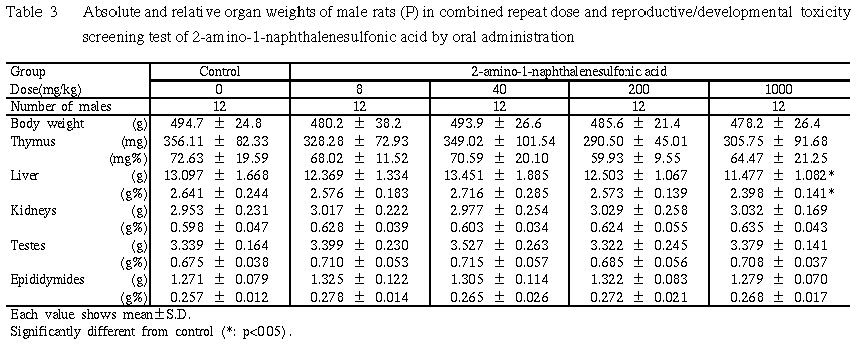
7) 器官重量 (Table 3)
1000 mg/kg群では,対照群に比して肝臓絶対重量および相対重量がともに有意な低値を示した.200 mg/kg以下の投与群では,いずれの器官重量とも対照群との間に有意差は認められなかった.
8) 病理組織学的検査
| 肝臓: | ごく軽度の壊死巣が対照群および1000 mg/kg群の各1例に,ごく軽度〜軽度の肉芽腫が対照群および1000 mg/kg群の6〜8例に,ごく軽度〜軽度の細胞集簇が対照群および1000 mg/kg群の3〜5例にみられた. |
| 心臓: | ごく軽度〜軽度の細胞浸潤が対照群および1000 mg/kg群の1〜4例にみられた. |
| 腎臓: | ごく軽度の尿細管の好塩基性化が対照群および1000 mg/kg群の1〜2例に,ごく軽度の細胞浸潤が対照群および1000 mg/kg群の1〜2例にみられた. その他の検査部位(胸腺,脾臓,精巣,精巣上体,副腎および脳)では,いずれも著変はみられなかった. |
対照群および200 mg/kg以下の投与群では,異常症状は観察されなかった.
1000 mg/kg群では,交配開始前の投与7日以降には0〜6例で,妊娠期間中には3〜 12例で,哺育期間中には全例で投与後に流涎がみられた.当症状は投与後2〜3分からみられたが,投与後約10分には消失した.
2) 体 重
交配開始前および交配期間中,妊娠期間中ならびに哺育期間中を通じて,各投与群の体重は対照群とほぼ同程度であり,有意差は認められなかった.
3) 摂餌量
交配開始前および交配期間中,妊娠期間中ならびに哺育期間中を通じて,各投与群の摂餌量は対照群とほぼ同程度であり,有意差は認められなかった.
4) 剖検所見
対照群および各投与群のいずれの例とも,剖検で著変はみられなかった.
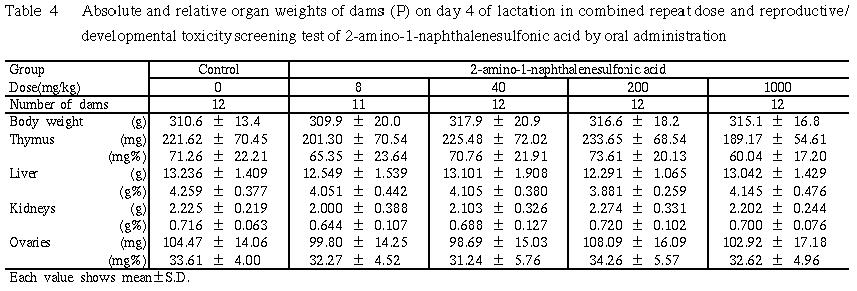
5) 器官重量 (Table 4)
各投与群とも,いずれの器官重量ともに対照群との間に有意差は認められなかった.
6) 病理組織学的検査
| 肝臓: | ごく軽度の壊死巣が対照群の2例にみられた. |
| 心臓: | ごく軽度の細胞浸潤が1000 mg/kg群の1例にみられた. |
| 腎臓: | 尿細管内にごく軽度のCa沈着が1000 mg/kg群の1例にみられた. |
| 脾臓: | ごく軽度〜軽度の髄外造血が対照群および1000 mg/kg群の11〜12例にみられた. |
その他の検査部位(胸腺,卵巣,副腎および脳)では,いずれも著変はみられなかった.
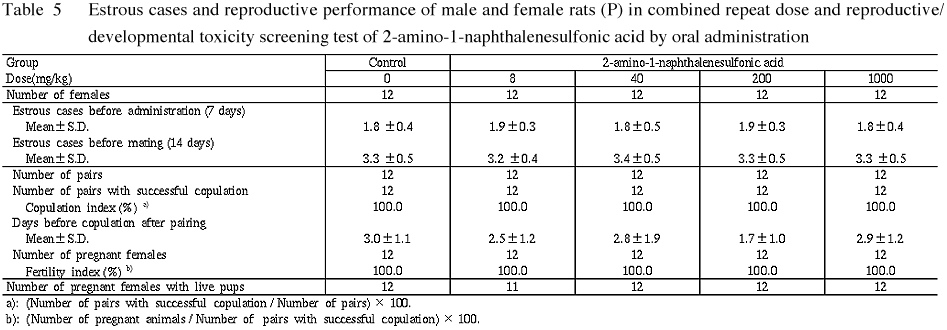
検疫・馴化期間中の7日間および交配開始前の投与期間中(14日間)の発情回数は,各投与群とも対照群とほぼ同程度であり,有意差は認められなかった.
2) 交尾率,受胎雌数および受胎率
各群の動物とも,同居開始後8日までに全例で交尾が確認された.交尾確認までの日数は,各投与群とも対照群とほぼ同程度であった.交尾率は,対照群および各投与群とも100%であった.受胎雌数は対照群および各投与群とも12例ずつであり,受胎率は対照群および各投与群とも100%であった.一方,8 mg/kg群の1例では死産児のみで新生児は得られなかった.したがって,新生児を分娩した母動物数は対照群,40, 200および1000 mg/kg 群では12例ずつであったが,8 mg/kg群では11例であった.
3) 妊娠期間および分娩状態
各投与群の妊娠期間は対照群とほぼ同程度であり,有意差は認められなかった.また,いずれの動物とも分娩状態に異常はみられなかった.
4) 黄体数,着床痕数および着床率
黄体数,着床痕数および着床率は各投与群とも対照群とほぼ同程度であり,有意差は認められなかった.
5) 出産率
対照群,40, 200および1000 mg/kg群の出産率は100%であった.一方,8 mg/kg群の1例では新生児が得られなかったため出産率は91.7%であったが,対照群との間に有意差は認められなかった.
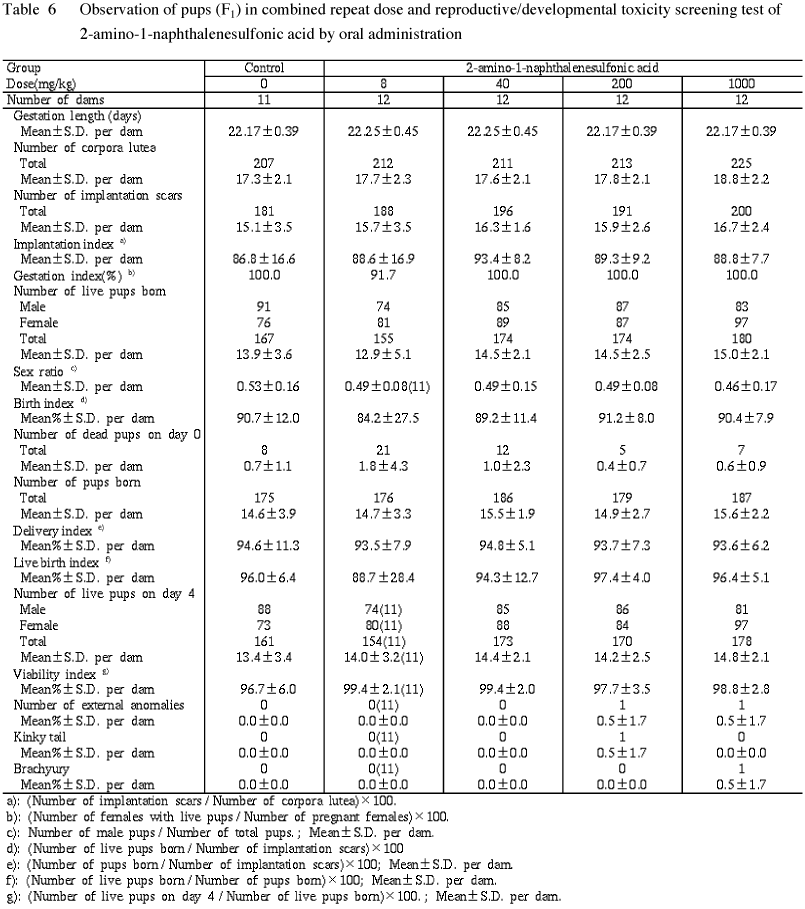
総出産児数および分娩率は各投与群とも対照群とほぼ同程度であり,有意差は認められなかった.
2) 出生率および性比
哺育0日の新生児数,総死産児数,出生率および性比には,各投与群で投与用量に関連した変動はみられず,いずれも対照群との間に有意差は認められなかった.
3) 新生児の一般状態,哺育4日の生存率および外表異常の観察
新生児の一般状態では,いずれの群とも異常症状は観察されなかった.
哺育期間中に,対照群および各投与群で1〜7例の死亡例がみられた.しかしながら,哺育4日の生存児数および哺育4日の生存率には各投与群で投与用量に関連した変動はみられず,いずれも対照群との間に有意差は認められなかった.
新生児の外表異常の観察では,200 mg/kg群の1例で曲尾が,1000 mg/kg群の1例で短尾がみられた.その他には,著変はみられなかった.
4) 新生児の体重
各投与群の新生児の体重は,哺育0日および4日とも雌雄ともに対照群とほぼ同程度であり,有意差は認められなかった.
5) 新生児の剖検所見
前述の曲尾および短尾以外には,剖検で著変はみられなかった.
雄 (P) 動物に対しては,一般状態の観察で1000 mg/kg群では投与期間の初期から少数例〜全例で投与後2〜3分に流涎がみられたが,約10分後には消失した.当症状は投与の継続により発現例数は増加したものの,持続時間の延長はみられなかった.摂餌量では,1000 mg/kg群で一過性の高値が認められたが,体重に影響を及ぼす程のものではなく,偶発所見と考えられた.器官重量では1000 mg/kg群で肝臓の絶対重量および相対重量の有意な低値が認められ,血液化学検査では総ビリルビンが有意な高値を示したことから,当器官への影響がうかがわれた.しかしながら,総ビリルビンの変動幅はごくわずかであり,さらにほぼ同週齢ラットの当社の背景値にみられる程度の数値であった.また,その他の肝機能に関連すると思われる検査値に変動はみられず,病理組織学的検査でも当群に特異的な組織変化はみられなかった.したがって,総ビリルビンの変動は毒性学的な意義の無いものと思われた.剖検では著変はみられず,さらに体重および血液学検査でも各投与群とも対照群との間に有意差は認められなかった.
雌 (P) 動物に対しては,一般状態観察では雄の場合と同様で1000 mg/kg群では投与期間の初期から少数例〜全例で投与後に流涎がみられたが,約10分後には消失した.体重,摂餌量,剖検および病理組織学的検査では被験物質投与に起因すると思われる変化はみられなかった.
以上のように,1000 mg/kg群の雌雄で投与後に流涎がみられること,さらに雄では肝臓重量の低値が認められることから,当試験条件下における2-アミノ-1-ナフタレンスルホン酸の一般毒性学的な無影響量は200 mg/kgと推察された.
親動物 (P) の生殖発生に対しては,交尾率,受胎率,発情回数および受胎雌数には,各投与群とも被験物質投与の影響はみられなかった.また,各投与群とも妊娠期間,分娩状態,黄体数,着床痕数,着床率および出産率にも影響はみられなかった.
新生児 (F1) に対しては,各投与群で総出産児数,分娩率,死産児数,哺育0日の新生児数,出生率,性比に投与用量に関連した変動は認められなかった.また,一般状態および剖検で異常はみられず,哺育4日の生存児数および生存率にも投与用量に関連した変動は認められなかった.体重にも影響は認められなかった.外表観察では200 mg/kg群および1000 mg/kg群の各1例で曲尾と短尾がみられたが,発現頻度は低く,被験物質投与との関連性の無い自然発生的変化と考えられた.
したがって,2-アミノ-1-ナフタレンスルホン酸の生殖発生毒性学的な無影響量は,雌雄の生殖および児動物の発生に関して,いずれも1000 mg/kgと推察された.
以上により,当試験条件下における一般毒性学的な無影響量は200 mg/kgと推察された.また,生殖発生毒性学的な無影響量は,雌雄の生殖および児動物の発生に関していずれも1000 mg/kgと推察された.
| 連絡先 | |||
| 試験責任者: | 和田 浩 | ||
| 試験担当者: | 小林吉一,藤村高志,長瀬孝彦, 岡田雅昭,牧野浩平,山本明義 | ||
| (株)日本バイオリサーチセンター 羽島研究所 | |||
| 〒 501-62 岐阜県羽島市福寿町間島 6-104 | |||
| Tel 058-392-6222 | Fax 058-391-3171 | ||
| Correspondence | |||
| Authors: | Hiroshi Wada(Study director) Yoshikazu Kobayashi, Takashi Fujimura, Takahiko Nagase, Masaaki Okada, Kouhei Makino and Akiyoshi Yamamoto | ||
| Nihon Bioresearch Inc. Hashima Laboratory | |||
| 6-104, Majima, Fukuju-cho, Hashima, Gifu, 501-62 Japan | |||
| Tel +81-58-392-6222 | Fax +81-58-391-3171 | ||