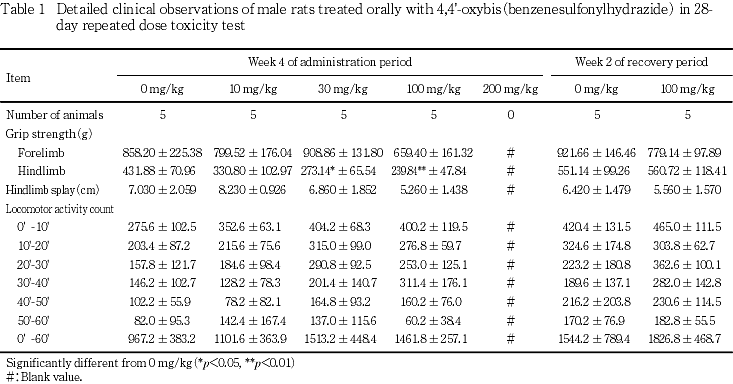
一般状態,行動機能観察および機能検査で,30および100 mg/kgでは握力の低下,200 mg/kgでは麻痺性歩行や下痢がみられ,さらに体重や摂餌量の減少を伴う全身状態の悪化による死亡例も認められた.また,死亡例と同様の経過が認められたため,生存例についても全例安楽死させ回復群は設定しなかった.
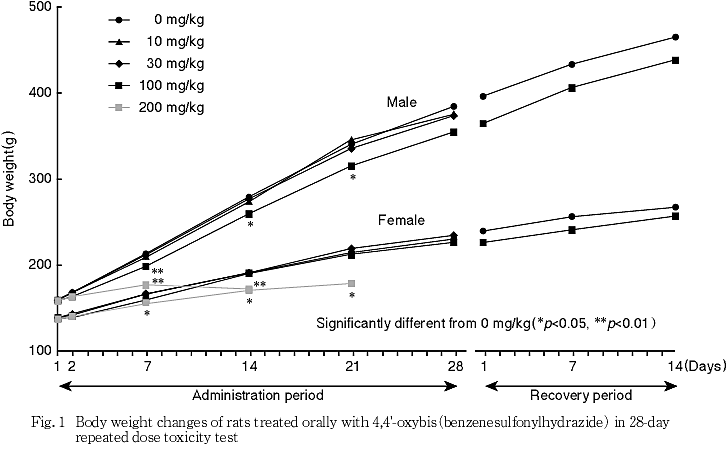
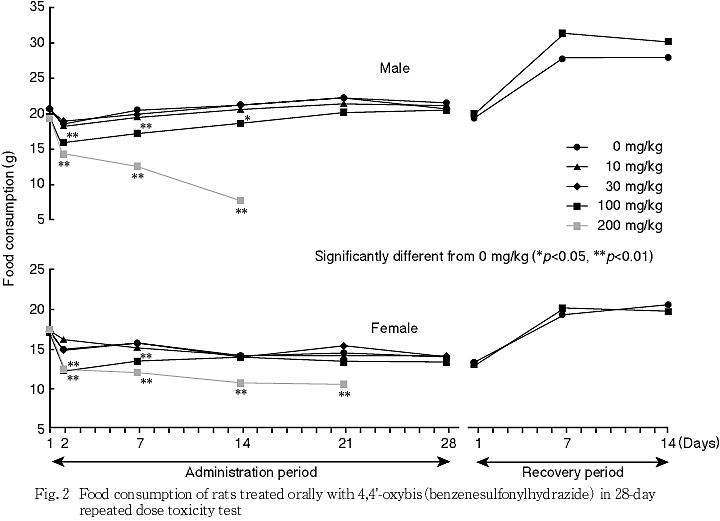
体重および摂餌量では,100 mg/kg以上で低値が認められた.
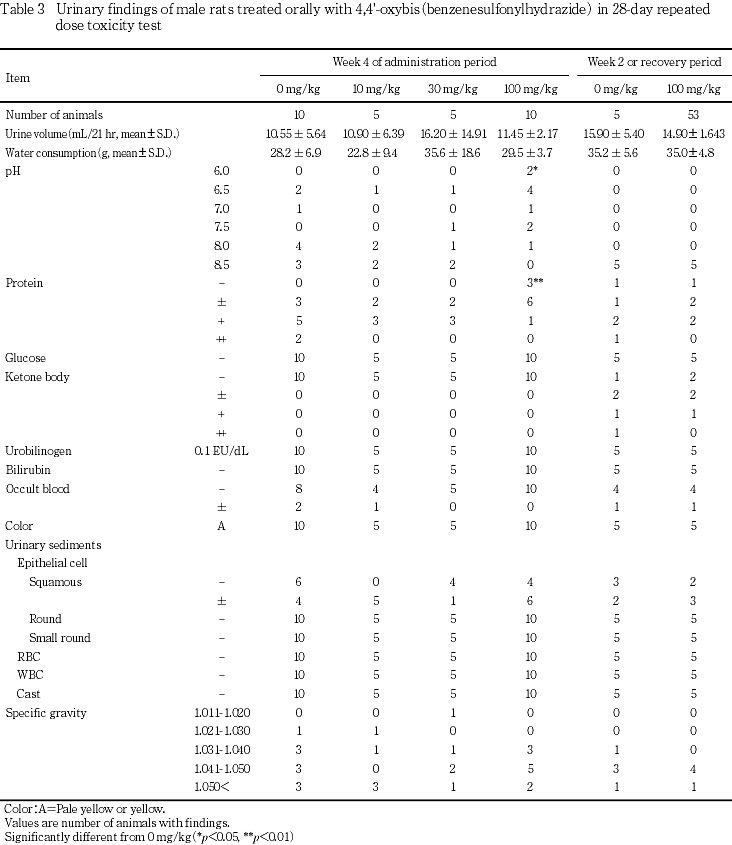
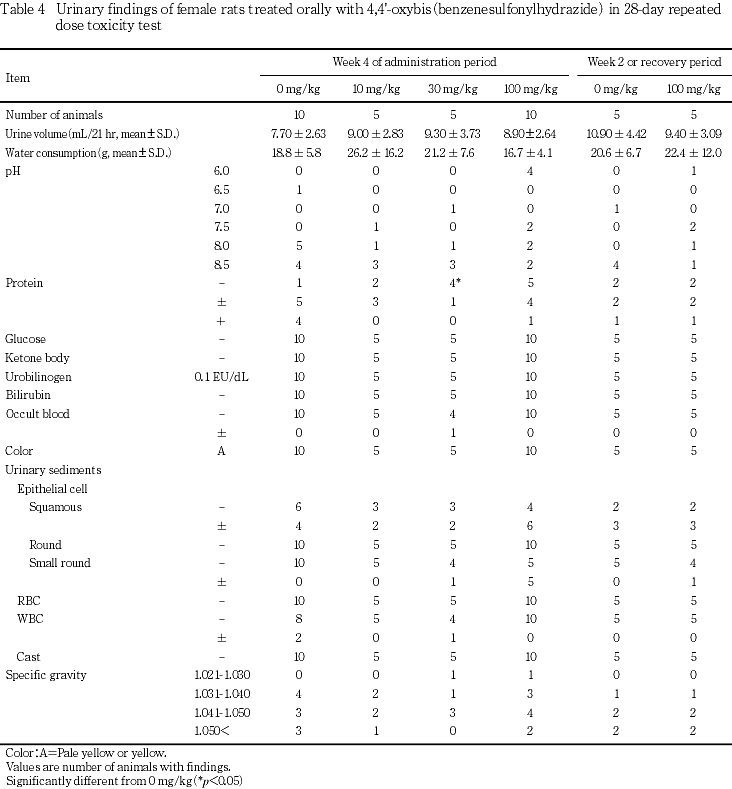
尿検査では,30 mg/kg以上で蛋白排泄量の低下,100 mg/kgでpHの低下が認められた.
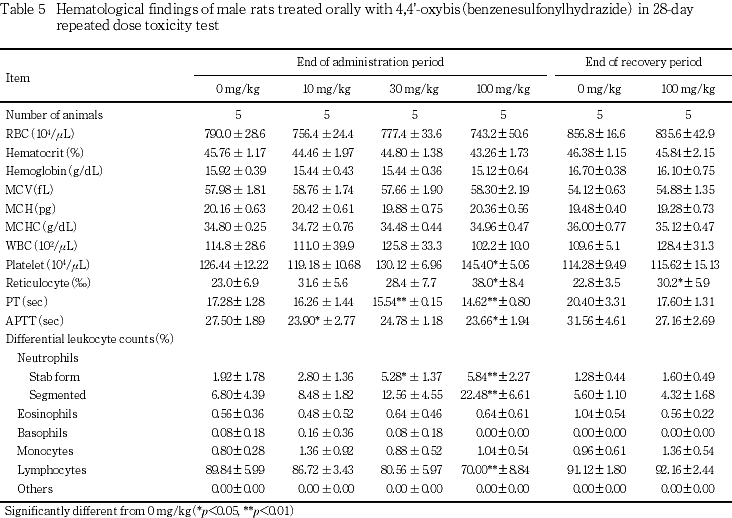
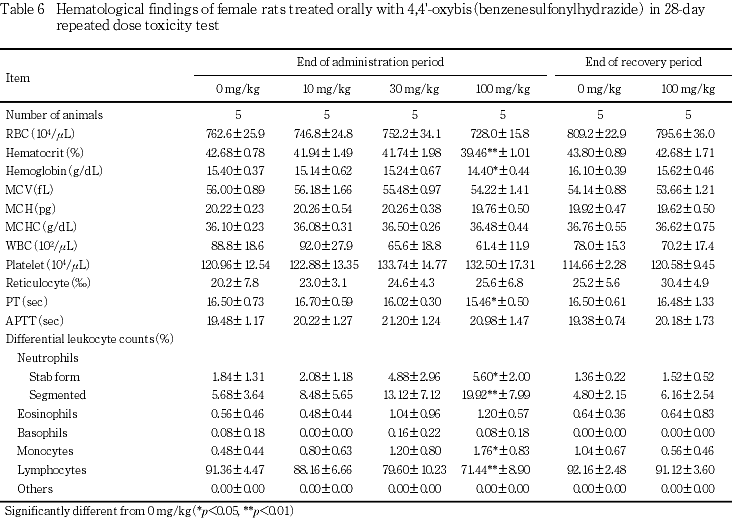
血液学検査では,30 mg/kg以上でプロトロンビン時間の短縮および桿状核球の高値,100 mg/kgでヘマトクリット値およびヘモグロビン量の低値,網赤血球数および分葉核球の高値,リンパ球の低値等が認められた.
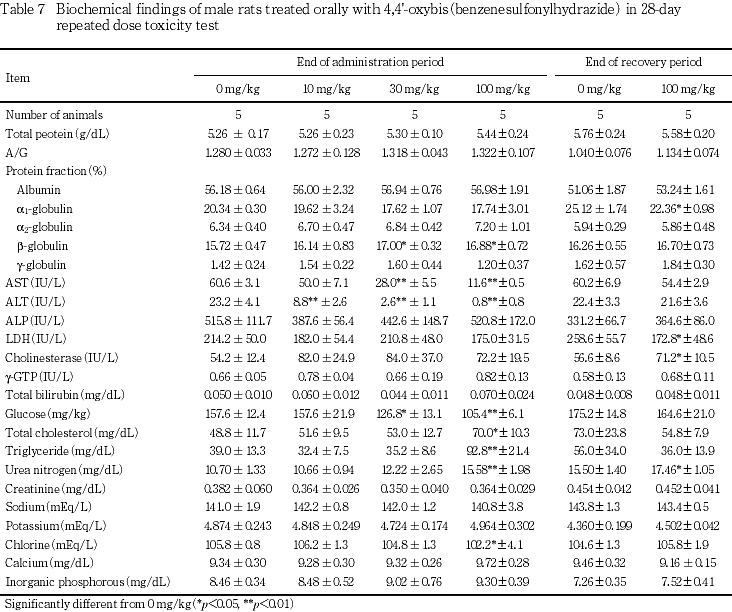
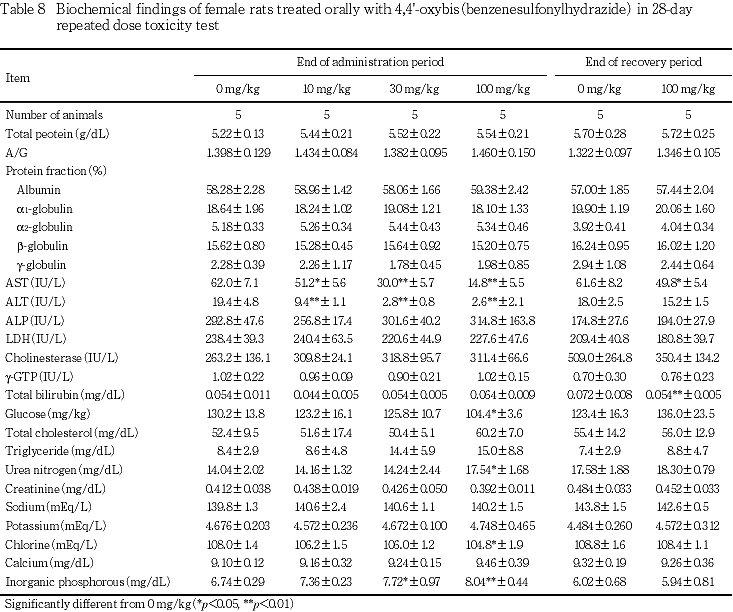
血液生化学検査では,30 mg/kg以上でβ-グロブリン分画比の高値,無機リンの高値およびグルコースの低値,100 mg/kgで総コレステロールの高値,トリグリセリドの高値,尿素窒素の高値およびクロールの低値等が認められた.
剖検所見では,200 mg/kgの死亡例あるいは安楽死例で脾臓および胸腺の萎縮が認められた.
器官重量では,30 mg/kg以上で副腎重量の増加傾向および腎臓重量の増加,100 mg/kgで肝臓重量の増加が認められた.
病理組織学検査では,200 mg/kgの死亡例・安楽死例で腎臓の近位尿細管上皮の脂肪変性,坐骨神経の神経線維の変性,脾臓の白脾髄の萎縮およびうっ血,胸腺の萎縮,大腿骨骨髄の造血低下およびうっ血,腓腹筋の筋線維の萎縮,さらに全身の諸器官・組織に分泌顆粒の減少や萎縮性の変化が認められた.生存例では,30 mg/kg以上で肝臓の小葉周辺性脂肪化,雌で脾臓の白脾髄の萎縮,100 mg/kgで肝臓の小肉芽腫の発現頻度の増加,腎臓の近位尿細管上皮の脂肪変性,坐骨神経の神経線維の変性,脾臓の髄外造血とうっ血,腓腹筋の筋線維の萎縮が認められた.
なお,投与期間中にみられたいずれの変化も,14日間の休薬により軽減または回復性が認められた.
以上のように,4,4'-オキシビス(ベンゼンスルホニルヒドラジド)投与による影響として,30 mg/kg以上で後肢の握力低下および麻痺性歩行や末梢神経線維の変性等の神経毒性,腎臓重量の増加や近位尿細管上皮の脂肪変性等の腎毒性,ならびにプロトロンビン時間の短縮等の凝固系の変化が認められた.さらに,100 mg/kg以上では貧血傾向,体重と摂餌量の低値,総コレステロールの高値および肝臓重量の高値や小葉中心性肝細胞肥大等の肝毒性等が認められ,200 mg/kgでは麻痺性歩行や下痢,体重減少,さらに全身状態の悪化による死亡例が認められ,生存例についても全例を安楽死させた.
したがって,本試験条件下における4,4'-オキシビス(ベンゼンスルホニルヒドラジド)の無影響量(NOEL)は,雌雄ともに10 mg/kg/dayと推察された.
あらかじめ被験物質の調製液中での均一性および安定性の分析を行い,均一かつ室温保存13日間安定であることを確認した後,被験物質を乳鉢で細砕後,投与量ごとに精秤して対照物質(トウモロコシ油)に懸濁し,スターラーで分散させた.調製液は調製後速やかに遮光気密容器に入れ室温で保存し,11日以内に投与に用いた.投与液の各濃度をHPLCで分析し,規定の範囲内にあることを確認した.
動物は温度21〜23℃,湿度49〜66 %,換気回数10〜15回/時間,照明時間8〜20時でブラケット式金属製金網床ケージに,群分け前は1あるいは3匹,群分け後は1匹収容した.飼料はγ線照射固型飼料CRF-1(オリエンタル酵母工業)を金属製給餌器により,飲料水は札幌市水道水を自動給水装置により,それぞれ自由摂取させた.
300 mg/kgでも1000 mg/kgと同様の経過がみられたため投与6日に安楽死とした.これらの例では,雌雄ともに白血球数の低値傾向,ASTおよびALTの低値ならびに尿素窒素等の高値傾向が認められた.
100 mg/kgでは,体重増加抑制傾向,尿量の低値傾向,尿比重の高値傾向および尿pHの低値傾向,白血球数の低値傾向,肝臓および甲状腺重量の高値傾向がみられたが,麻痺性歩行は発現しなかった.
以上のことから,28日間反復経口投与毒性試験では,200 mg/kgを最高用量に設定し,その半量である100 mg/kg,以下公比約3で除し,30および10 mg/kgを設定した.なお,対照群,100および200 mg/kgの3用量について14日間休薬による回復群を設定したが,200 mg/kgについては投与期間中に死亡例が多数みられ,生存例についても一般状態が悪化したため全例を安楽死させた後剖検した.
1日1回,28日間,9:00から12:30の間に胃ゾンデを用いて強制的に胃内に10 mL/kgの投与容量で経口投与した.なお,各個体の投与液量は投与日に最も近い測定日の体重に基づいて算出した.
 nwald- Giemsa染色)を測定した.また,3.8 %クエン酸ナトリウムで処理し,3500回転/分10分間の遠心分離により得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10 A,バクスター)を測定した.
nwald- Giemsa染色)を測定した.また,3.8 %クエン酸ナトリウムで処理し,3500回転/分10分間の遠心分離により得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10 A,バクスター)を測定した.
 blewski-La Due法)およびグルコース(ヘキソキナーゼ法)を測定し,分離剤入り試験管に血液を採取し,3500回転/分で10分間の遠心分離により得られた血清を用いて,ALT(IFCC法),アルカリホスファターゼ(GSCC法),γ-GTP(L-γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),コリンエステラーゼ(ヨウ化ブチリルチオコリン基質法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff
blewski-La Due法)およびグルコース(ヘキソキナーゼ法)を測定し,分離剤入り試験管に血液を採取し,3500回転/分で10分間の遠心分離により得られた血清を用いて,ALT(IFCC法),アルカリホスファターゼ(GSCC法),γ-GTP(L-γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),コリンエステラーゼ(ヨウ化ブチリルチオコリン基質法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff 法),カルシウム(OCPC法),無機リン(Fiske-Subba Row法),総蛋白(ビウレット法)(以上,自動分析装置7150形,日立製作所),ナトリウムおよびカリウム(炎光光度法)(以上,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),蛋白分画およびA/G比(セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
法),カルシウム(OCPC法),無機リン(Fiske-Subba Row法),総蛋白(ビウレット法)(以上,自動分析装置7150形,日立製作所),ナトリウムおよびカリウム(炎光光度法)(以上,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),蛋白分画およびA/G比(セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
握力,着地開脚幅,自発運動量,体重,体重増加量および増加率,摂餌量,尿検査の定量的項目(尿比重を除く),血液学検査(白血球百分比を除く),血液生化学検査,器官の絶対および相対重量の成績についてBartlettの検定法によって等分散性を解析し,等分散の場合は一元配置分散分析法,不等分散の場合はKruskal-Wallisの検定法で解析した.一元配置分散分析の結果,有意差がみられた場合は,Dunnettの検定法を用いて,Kruskal-Wallis法の解析の結果,有意差がみられた場合は,Mann-WhitneyのU-検定法を用いてそれぞれ対照群との比較を行った.
行動機能観察の観察項目,尿検査の定性的項目,尿比重および白血球百分比の成績については,群毎の傾向をKruskal-Wallisの検定法で解析し,有意差がみられた場合はMann-WhitneyのU-検定法を用いて対照との比較を行った.なお,白血球百分比については群毎の平均値および標準偏差も算出した.対照群との比較検定については,危険率5 %未満を統計学的に有意とした.
200 mg/kgの雄では投与7日,雌では投与11日以降に麻痺性歩行や肛門周囲等の被毛汚れを伴う下痢が認められた.機能検査でも雌雄ともに投与7あるいは14日以降に筋緊張の低下,被毛の汚れや歩行不能等が認められ,体重や摂餌量の減少を伴う全身状態の悪化による死亡例も認められた.生存例についても死亡例と同様の経過が認められたため,衰弱の顕著な例から順次安楽死させ,雄で投与16日,雌で投与27日に全例安楽死とした.なお,雌では投与4週に後肢の握力に低下傾向が認められた.
回復期間には100 mg/kgの雌に自発運動量の有意な増加が測定開始後40〜50分にのみ認められた.

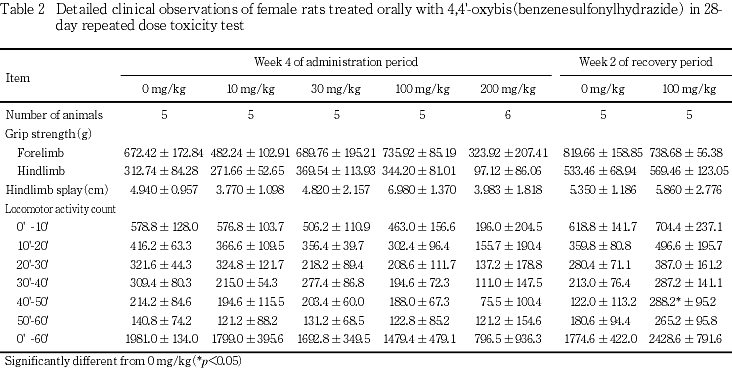
回復期間には,100 mg/kgの雌雄ともに変化は認められなかった.
200 mg/kgでは,雌雄ともに投与2日以降に有意な低値が認められた.
回復期間には,100 mg/kgの雌雄ともに有意差は認められなかった.
200 mg/kgの雌では,pH,飲水量および尿量の低値傾向が認められた.
回復期間には100 mg/kgの雌雄ともに有意な変化は認められなかった.
30 mg/kgの雄でプロトロンビン時間の有意な短縮と桿状核球の有意な高値,雌でも桿状核球の高値傾向が認められた.
100 mg/kgの雌雄ともにプロトロンビン時間の有意な短縮,桿状核球と分葉核球の有意な高値およびリンパ球の有意な低値が認められた.さらに,雄では血小板数と網赤血球数の有意な高値および活性化部分トロンボプラスチン時間の有意な短縮,雌ではヘマトクリット値とヘモグロビン量の有意な低値および単球の有意な高値が認められた.
回復期間には,100 mg/kgの雄で網赤血球数の有意な高値が認められた.
10および100 mg/kgの雄で認められた活性化部分トロンボプラスチン時間の短縮については,用量依存性がみられないこと,また短縮時の臨床的意義は乏しいことから,毒性学的意義はないものと判断した.
30 mg/kgの雌雄ともにASTおよびALTの有意な低値,さらに雄でβ-グロブリン分画比の有意な高値およびグルコースの有意な低値,雌でも無機リンの有意な高値が認められた.
100 mg/kgの雌雄ともにAST,ALT,グルコースおよびクロールの有意な低値,尿素窒素の有意な高値,さらに雄でβ-グロブリン分画比,総コレステロールおよびトリグリセリドの有意な高値,雌でも無機リンの有意な高値が認められた.
回復期間には,100 mg/kgの雄ではα1-グロブリン分画比と乳酸脱水素酵素の有意な低値およびコリンエステラーゼと尿素窒素の有意な高値,雌ではASTおよび総ビリルビンの有意な低値が認められた.
10 mg/kg以上の雌雄で用量依存的にASTとALTの低値が認められたが,同様の低下は化学療法薬のcefazolinやisoniazideでも報告され,その機序として薬物あるいはその代謝物のヒドラジン誘導体がASTおよびALTの補酵素と反応し酵素活性を阻害する1, 2)と考えられている.4,4'-オキシビス(ベンゼンスルホニルヒドラジド)はヒドラジン誘導体であることから,本試験で認められたASTおよびALT活性の低下は被験物質による直接的な阻害作用による可能性があり,毒性学的意義はないものと判断した.
生存例では,30 mg/kgの雌1例で頸部に痂皮がみられ,100 mg/kgの雄1例で精巣および精巣上体の小型が認められた.
回復期間には,100 mg/kgの雄1例で脾臓に隆起部が認められた.
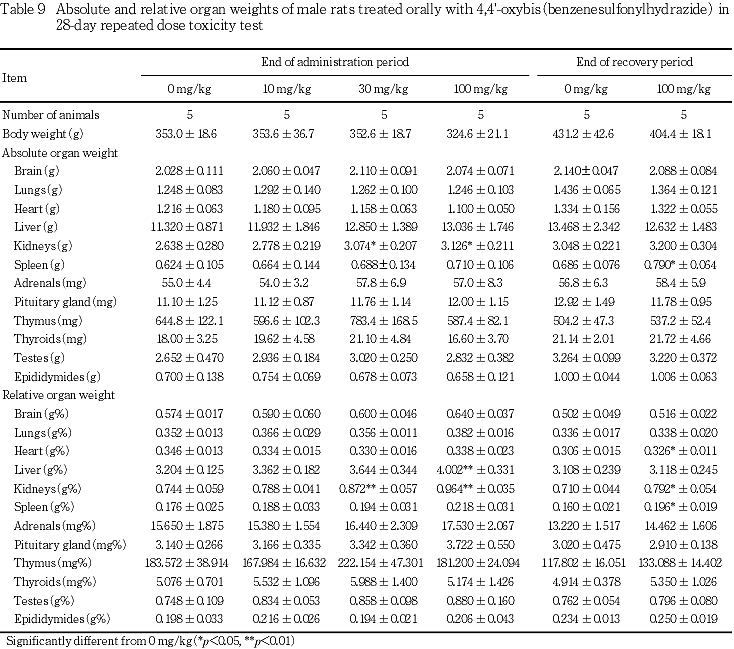
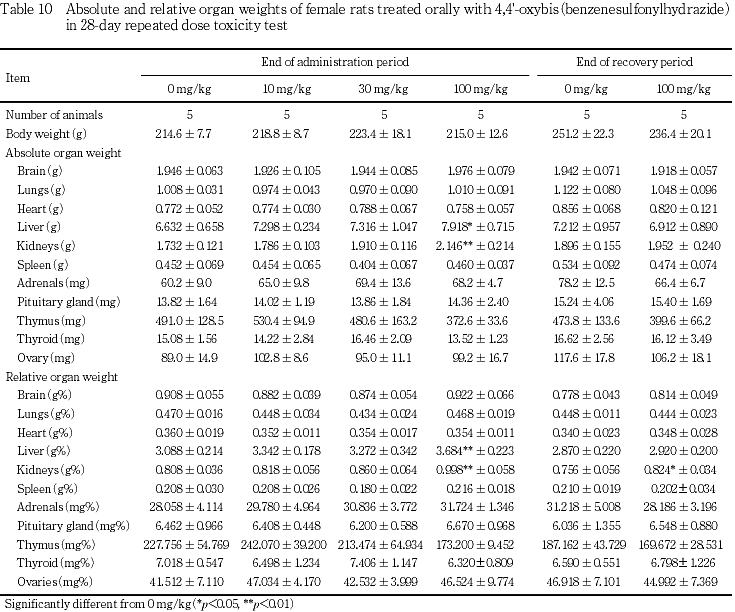
100 mg/kgの雌雄ともに肝臓の相対重量,腎臓の絶対および相対重量に有意な高値が認められ,雌では肝臓の絶対重量にも有意な高値が認められた.また,雌では副腎の絶対および相対重量に高値傾向がみられたが有意差は認められなかった.
回復期間には,100 mg/kgの雌雄ともに腎臓の相対重量に有意な高値,雄で脾臓の絶対および相対重量ならびに心臓の相対重量に有意な高値が認められた.
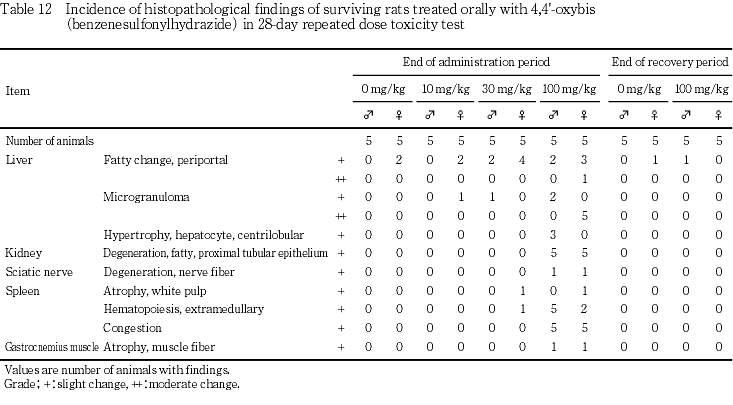
生存例では,10 mg/kgの雌で肝臓の軽度な小葉周辺性脂肪化が2例および小肉芽腫が1例で認められた.
30 mg/kgでは,肝臓の軽度な小葉周辺性脂肪化が雄2例および雌4例に,さらに雄では肝臓の軽度な小肉芽腫が1例,雌では脾臓の白脾髄の萎縮ならびに髄外造血が各1例に認められた.
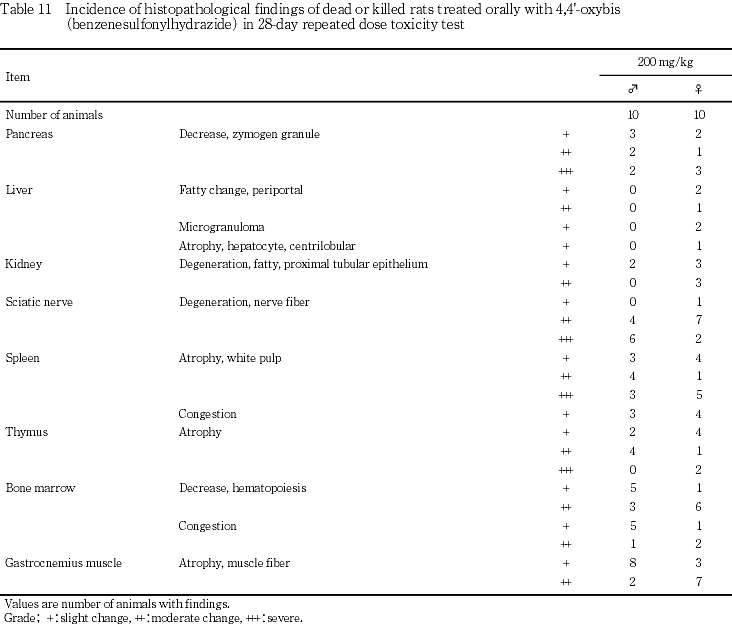
100 mg/kgでは,肝臓の軽度あるいは中等度な小葉周辺性脂肪化が雄2例および雌4例に,軽度あるいは中等度な小肉芽腫が雄2例および雌5例(全例),腎臓の近位尿細管上皮の軽度な脂肪変性が雌雄各5例,坐骨神経の軽度な神経線維の変性が雌雄各1例,脾臓の髄外造血が雄5例および雌2例,ならびにうっ血が雌雄各5例,腓腹筋の軽度な筋線維の萎縮が雌雄各1例に認められた.さらに雄では肝臓の軽度な小葉中心性肝細胞肥大が3例に認められた.
回復期間には,100 mg/kgの雄で軽度な小葉周辺性脂肪化が1例に認められた.
なお,10および30 mg/kgでみられた肝臓の軽度な小葉周辺性脂肪化や小肉芽腫は対照群でも通常観察される所見であることから,毒性学的意義はないものと判断した.
しかし,これら握力等の変化も休薬後には100 mg/kgの雌雄で認められていないことから,この神経毒性は可逆的な変化であると考えられた.
尿検査では,30 mg/kg以上で蛋白排泄量の低下,100 mg/kgでpHの低下,200 mg/kgの雌でpH,尿量および飲水量の低値傾向が認められた.これらの変化については,血液生化学検査で無機リンあるいは尿素窒素の高値とクロールの低値等が認められ,さらに腎臓重量の増加ならびに近位尿細管上皮の脂肪変性等の所見が認められたことから,被験物質投与による腎機能障害に関連した変化と考えられた.
また,200 mg/kgの死亡例あるいは安楽死例では近位尿細管上皮の壊死や再生に加え膀胱粘膜上皮の単純過形成もみられており,被験物質投与による尿路系への障害性あるいは刺激性も示唆された.
しかし,100 mg/kgの雄では休薬後にも尿素窒素の高値がみられたものの,雌では回復が認められることから,可逆性の変化であると考えられた.
血液学検査においては,100 mg/kgの雌でヘマトクリット値およびヘモグロビン量の低値を伴う貧血傾向が認められ,30あるいは100 mg/kgでみられた網赤血球数の高値や脾臓の髄外造血は,この貧血に対する反応性の変化と考えられた.
一方,100 mg/kgの雌雄でみられたリンパ球の低値や好中球の高値は,体重・摂餌量の低下あるいは貧血や腎機能障害などによる一般状態の悪化に伴う変化と推察された.
他に,30 mg/kgの雄および100 mg/kgの雌雄でプロトロンビン時間の短縮が認められた.プロトロンビン時間の短縮は妊婦や初期の汎発性血管内凝固症候群等で血液中の凝固因子が活性化されている場合や血栓傾向に関連してみられることがある3)といわれている.100 mg/kgの雄で血小板数の高値がみられているものの,剖検あるいは病理組織学検査において血栓を示唆する変化はみられていないことから,被験物質投与との関連性は明らかでなかった.
血液生化学検査において,30 mg/kgの雄あるいは100 mg/kgの雌雄でみられたグルコースの低値や総コレステロールおよびトリグリセリドの高値は,病理組織学検査でもこれらの群において肝臓の小葉中心性肝細胞肥大あるいは小葉周辺性脂肪化例の増加がみられていることから,肝機能障害に基づく糖・脂質代謝異常を生じている可能性が考えられた.
なお,器官重量で30 mg/kg以上の雌には副腎重量に若干の増加傾向がみられたが,病理組織学的所見を伴うものではなかった.
以上のように,4,4'-オキシビス(ベンゼンスルホニルヒドラジド)の30 mg/kg以上の投与で後肢の握力低下を始め麻痺性歩行や末梢神経線維の変性等の神経毒性,腎臓重量の増加を始め近位尿細管上皮の脂肪変性等の腎毒性,ならびにプロトロンビン時間の短縮等の凝固系の変化が認められた.さらに,100 mg/kg以上の投与では貧血傾向,体重と摂餌量の低値,総コレステロールの高値を始め肝臓重量の高値や小葉中心性肝細胞肥大等の肝毒性等,200 mg/kgでは麻痺性歩行や下痢がみられ,徐々に体重が減少し,全身状態の悪化による死亡例が認められた.また,生存例についても同様の経過が認められたため,全例を安楽死させた.
したがって,本試験条件下における4,4'-オキシビス(ベンゼンスルホニルヒドラジド)の無影響量(NOEL)は,雌雄ともに10 mg/kg/dayと推察された.
| 1) | 松本一彦,林 祐造,小野 宏,後藤昌司(編): 「毒性試験報告書のまとめ方 Vol. 1 毒性・一般薬理試験編」清至書院,東京(1982)pp.245-248. |
| 2) | Feuer G, Balazs T, Farber TM, Ilse RG: Effect of cefazolin on aminotransferase in the rat. J Toxicol Environ Health, 7:593-606(1981). |
| 3) | 福武勝之: APTT,PT,フィブリノーゲン -血栓症と血小板凝固線溶系検査-,臨床検査増刊号,40:99-103(1996). |
| 連絡先 | |||
| 試験責任者: | 須永昌男 | ||
| 試験担当者: | 木口雅夫,咲間正志,笠原みゆき 平田真理子,古川正敏 | ||
| (株)化合物安全性研究所 | |||
| 〒004-0839 札幌市清田区真栄363番24 | |||
| Tel 011-885-5031 | Fax 011-885-5313 | ||
| Correspondence | ||||
| Authors: | Masao Sunaga(Study director) Masao Kiguchi,Masashi Sakuma, Miyuki Kasahara,Mariko Hirata, Masatoshi Furukawa | |||
| Safety Research Institute for Chemical Compounds Co., Ltd. | ||||
| 363-24 Shin-ei, Kiyota-ku, Sapporo, Hokkaido, 004-0839, Japan | ||||
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | |||