 死亡動物
死亡動物N-(1,3-ジメチルブチル)-N'-フェニル-1,4-ベンゼンジアミンは,脱酸素剤やゴムの老化防止剤として使用されている化合物である.今回,OECDによる既存化学物質の安全性点検に係わる毒性調査事業の一環として,N-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミンの0(溶媒対照群),6,25および100 mg/kgを雌雄ラットの交配前14日から交配期間の2週間を通じ,さらに雄では交配期間終了後20日間,雌では妊娠期間および哺育3日まで連続経口投与し,親動物の反復投与毒性および生殖能ならびに児動物の発生・発育に及ぼす影響について検討した.
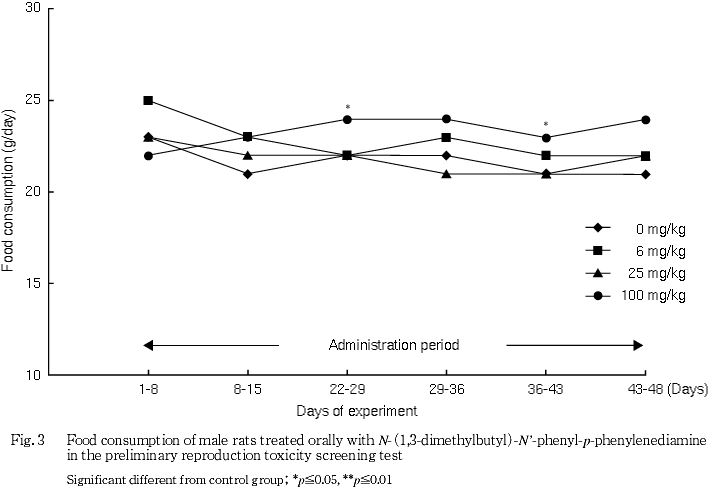
被験物質投与による症状として,流涎が雄の25および100 mg/kg群,雌の100 mg/kg群で観察された.体重および摂餌量には,被験物質投与の影響は認められなかった.
病理学的検査では,雌雄ともに25および100 mg/kg群で肝重量の増加が観察され,剖検所見では雌雄の100 mg/kg群で肝臓の肥大が,組織所見では雄の25および100 mg/kg群で微小な空胞変性が認められた.生殖器系には,被験物質投与に起因すると考えられる所見は雌雄ともに観察されなかった.
新生児の外表検査では,異常は認められず,生存性および体重変化にも被験物質投与の影響は認められなかった.哺育期間中の死亡児および哺育4日の出生児の剖検では,被験物質投与によると考えられる異常所見は観察されなかった.
以上の結果から,本試験条件下ではN-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミンの反復投与により肝重量の増加が雌雄の25 mg/kg以上の投与群で認められ,親動物に対する無影響量(NOEL)は雌雄とも6 mg/kg/dayと判断された.生殖能および次世代児に対する影響はともに100 mg/kg/day投与によっても認められず,無影響量は100 mg/kg/dayと判断された.雌雄の生殖に及ぼす影響は100 mg/kg/day投与でも認められず,無影響量は100 mg/kg/dayと判断された.
被験物質は,瑪瑙乳鉢で粉砕後,コ-ンオイル(Lot. V8P6862,V8P7097,V9B8669,ナカライテスク(株)製造)に溶解し,1.2,5および20 mg/mLの濃度になるよう各群の投与液を調製した.調製後は投与時まで冷蔵庫で保存し,7日以内に使用した.投与液中の被験物質は1.2および80 mg/mLについて,調製後室温保存で8日間まで安定であることを確認した.
投与液の濃度確認のため全試験群について,調製開始時に調製した各群の投与液から無作為にサンプルを抽出し投与液中の被験物質濃度の分析を実施した.その結果,投与液は設定濃度の90.8〜103.0 %の範囲で調製されており,ほぼ所定量のN-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミンが含有されていることを確認した.
動物は,温度24 ± 2 ℃(実測値:21.7〜25.6 ℃),湿度55 ± 10 %(実測値:36〜64 %),換気回数15回/時間,照度150〜300 lux,照明時間12時間(午前7時点灯,午後7時消灯)に管理されたバリアシステムの飼育室でアルミ製前面・床ステンレス網目飼育ケージに1匹ずつ収容し飼育した.妊娠18日以降の母動物は哺育4日までアルミ製前面・床ステンレス網目飼育ケージに哺育トレーおよび巣作り材料(CareFRESHTM, Absorption corporation製造)を入れて飼育した.
飼料は,オリエンタル酵母工業(株)製造のNMF固型飼料(放射線滅菌飼料)を使用し,飼育期間中自由に摂取させた.飲水は,水道水を自由に摂取させた.
これらの結果をもとに,0,6,25,100および400 mg/kgの用量で予備試験「N-(1,3-ジメチルブチル)-N'-フェニル-1,4-ベンゼンジアミンのラットを用いる経口投与簡易生殖毒性試験−2週間投与予備試験」を実施した.その結果,雄の25 mg/kg以上,雌の100 mg/kg以上の投与群で流涎が認められ,雄の400 mg/kg群で体重増加抑制,雌雄の400 mg/kg群で投与開始初期に摂餌量の減少が認められた.また,雌雄の100 mg/kg以上の投与群で肝臓の肥大が,雄の400 mg/kg群で肝臓の淡色化が認められ,雌雄の100 mg/kg以上の投与群で肝臓重量の高値,雌の100 mg/kg以上の投与群で副腎重量の高値が認められた.
以上のことから本試験では,投与期間が予備試験の3倍以上に延長されることを考慮して明らかな毒性兆候を示すことが予想される100 mg/kg/dayを高用量とし,以下公比約4で除し,25および6 mg/kg/dayを設定した.
投与液量は,体重100 g当り0.5 mLとし,交配前および交配期間中の雌雄および妊娠期間中の雌では,最新体重に基づいて算出した.また,哺育期間中の雌は,哺育0日に測定した個体別体重に基づいて算出した.胃ゾンデを用いて毎日1回(7日/週)強制経口投与した.対照群にはコーンオイルのみを同様に投与した.
雄の投与期間は,交配前14日間と交配期間14日間および交配期間終了後20日間の連続48日間とした.雌の投与期間は,交配前14日間と交配期間中(最長14日間)ならびに交尾成立雌の妊娠期間を通じて分娩後の哺育3日まで(41〜54日間)とした.なお,交尾成立後分娩しなかった雌は妊娠25日の解剖前日までの39〜41日間とした.
雌では,投与1(投与開始日),8および15日に測定し,投与1から15日までの体重増加量を算出した.また,交尾成立後の雌は,妊娠0,7,14および21日に,分娩した雌は哺育0および4日に測定し,それぞれ妊娠0から21日および哺育0から4日までの体重増加量を算出した.
雌では,投与1(投与開始日),8および15日に測定し,測定日から次の測定日までの摂餌量を求め平均1日摂餌量を算出するとともに投与1から15日までの累積摂餌量を算出した.また,交尾成立の雌は妊娠0,7,14および21日に,分娩した雌は哺育0および4日に餌重量を測定し,測定日から次の測定日までの摂餌量を求め平均1日摂餌量を算出するとともに妊娠0から21日までの累積摂餌量を算出した.なお,交配期間中の摂餌量は測定しなかった.
母動物は全例哺育4日に病理解剖した.新生児は哺育0日に出産児数(生存児+死亡児)を調べ,性別を判定するとともに外表異常の有無を調べた.また,哺育0および4日に雌雄個体別の重量を測定し,1腹の雌雄別平均体重を算出した.
哺育4日の新生児の同腹児重量を測定後に新生児全例をエーテル麻酔により安楽死させ,主要器官の肉眼観察を行った.なお,哺育期間中の死亡児についても同様に主要器官の肉眼観察を行った.また,新生児の4日の生存率[(哺育4日生児数/出産生児数)×100]を求めた.
 死亡動物
死亡動物 雄動物
雄動物 自然分娩した雌動物
自然分娩した雌動物 自然分娩の認められなかった雌動物
自然分娩の認められなかった雌動物 死亡動物
死亡動物 雄動物
雄動物 自然分娩した雌動物
自然分娩した雌動物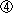 妊娠を成立させなかった雄および妊娠不成立の雌
妊娠を成立させなかった雄および妊娠不成立の雌出産率,交尾率および受胎率についてはx2検定5,6)を用いた.異常性周期発現率および病理学検査の所見の発生率については,Fisherの直接確率検定法6)を用いて検定し,グレードのある所見は,-を「1」,+1を「2」,+2を「3」および+3を「4」に割り当てた後,順位和検定であるMann-WhitneyのU検定6)を用いて検定した.なお,哺育期間中の新生児に関する成績は1母体当りの平均を1標本とした.有意水準は5および1 %の両側検定で実施した.
主な一般状態の変化として,流涎が雄では25および100 mg/kg群,雌では100 mg/kg群で観察された.流涎は雄の25 mg/kg群では投与2週から投与終了まで2〜4例に,100 mg/kg群では投与1週は1例に,投与2週以降は4〜9例に観察された.雌の100 mg/kg群では交配前・交配期間中は投与2週に3例,妊娠期間中は散発的に1〜5例,分娩後哺育3日までは散発的に1〜3例観察された.流涎は投与直後から認められ,おおむね投与後30分には消失した.その他,雌の6 mg/kg群で頸部の外傷および痂皮が同一個体の1例に,雌の6および100 mg/kg群で脱毛が各1例に観察された.

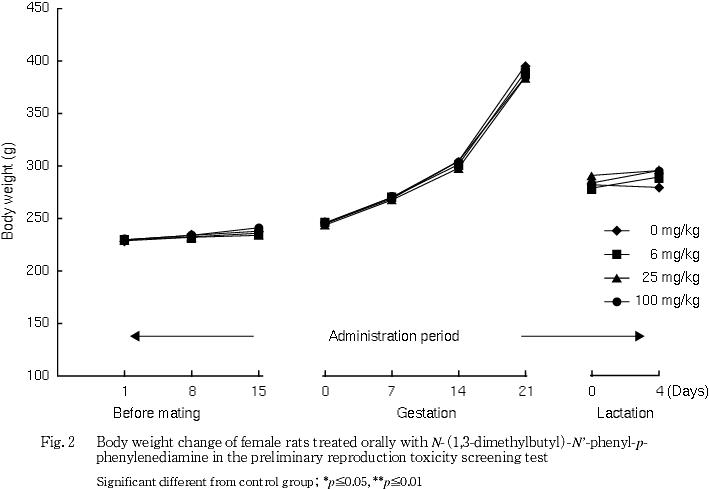
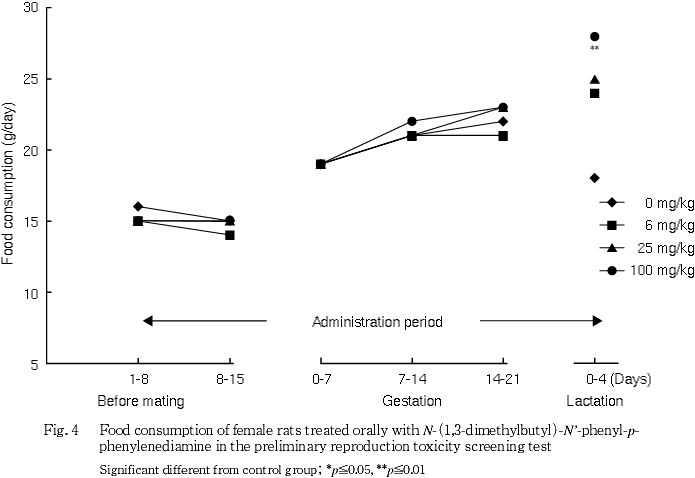
雌では,交配前および妊娠期間は対照群と被験物質投与群との間に有意な差は認められなかったが,哺育0から4日の平均1日摂餌量が対照群に比べ有意な高値を示した.
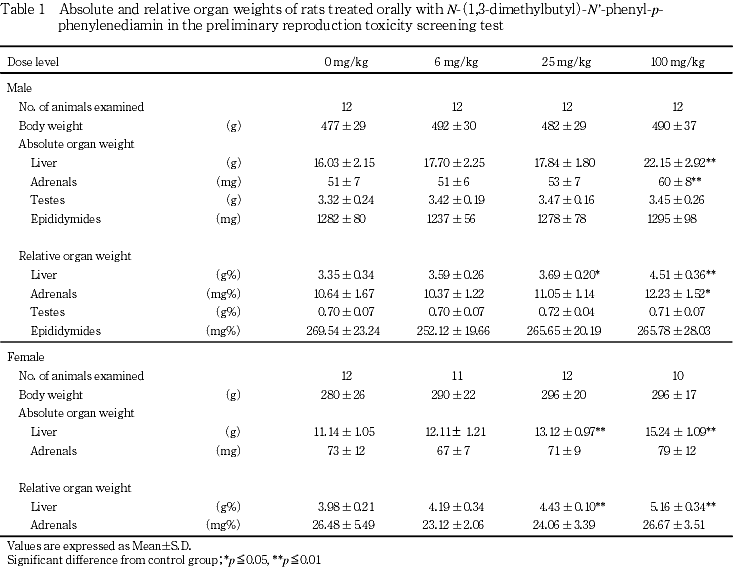
雄では妊娠を成立させなかった6および100 mg/kg群の各1例を含め,各群12例について剖検を行った.その結果,肝臓の肥大が6,25および100 mg/kg群でそれぞれ1,2および9例に観察され,対照群に比べ100 mg/kg群で有意な発生率の増加が認められた.その他,肺の結節が100 mg/kg群で1例に,腎臓の嚢胞が6 mg/kg群で1例に観察された.
自然分娩した雌では,対照群,6,25および100 mg/kg群でそれぞれ12,11,12および10例について剖検を行った.その結果,肝臓の肥大が100 mg/kg群で7例に観察され,対照群に比べ有意な発生率の増加が認められた.その他,100 mg/kg群で副腎の肥大が1例,脱毛が1例,6 mg/kg群で卵巣の嚢胞が1例,対照群で腎臓の白色斑点が1例に観察された.
妊娠25日に剖検し,妊娠不成立と判定された6および100 mg/kg群の各1例の雌では,異常所見は認められなかった.
雄では,肝臓の空胞変性が対照群,6,25および100 mg/kg群でそれぞれ1(小葉周辺性),0,2(小葉中間帯:1例,散発性:1例)および9(小葉中間帯)例に観察され,100 mg/kg群で有意な発生率の増加が認められた.その他,肝臓では細胞浸潤が3,7,1および1例に,小肉芽腫が7,6,5および7例に,リンパ球浸潤が6 mg/kg群で4例に観察された.肝臓以外では,精巣上体の細胞浸潤が対照群で5例,100 mg/kg群で2例に,副腎の球状帯空胞変性が対照群で11例,100 mg/kg群で9例にそれぞれ観察された.また,剖検所見で認められた6 mg/kgの腎臓の嚢胞は,組織学的には嚢胞と嚢胞周囲の尿細管好塩基化および線維化が観察された.
雌では,肝臓の空胞変性が対照群で2例,髄外造血が対照群で6例,100 mg/kg群で3例,細胞浸潤が100 mg/kg群で1例ならびに小肉芽腫が対照群で1例,副腎の球状帯空胞変性が対照群で3例,100 mg/kg群で1例にそれぞれ観察された.また,剖検所見で認められた対照群の腎臓の白色斑点は,組織学的には尿細管空胞変性ならびに好酸性小体が,100 mg/kg群の皮膚の脱毛は,組織学的に毛嚢の萎縮が観察された.
妊娠を成立させなかった雄では,6 mg/kg群の1例に肝臓の細胞浸潤,小肉芽腫,副腎の空胞変性が,100 mg/kg群の1例に肝臓の空胞変性がそれぞれ観察された.妊娠不成立の雌では,6 mg/kg群の1例に肝臓の小肉芽腫と子宮の内腔拡張が,100 mg/kg群の1例に子宮の内腔拡張がそれぞれ観察された.
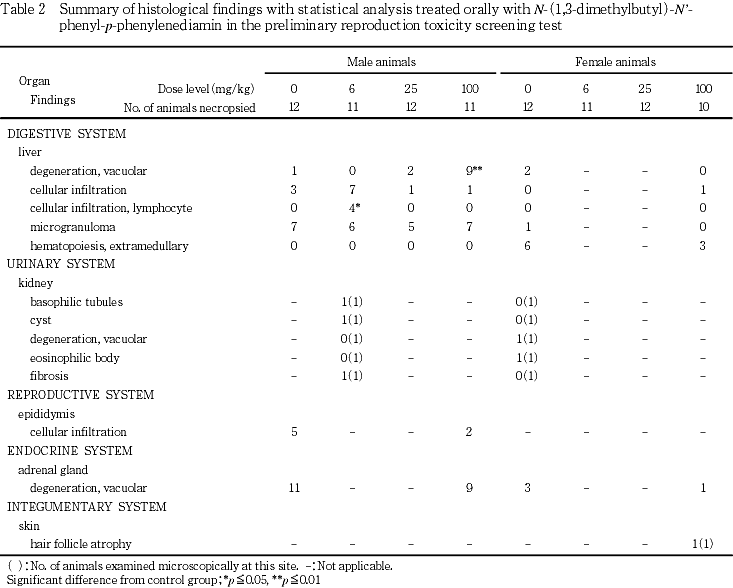

性周期観察では,平均性周期に群間差は認められなかった.異常性周期を示す動物が対照群,6,25および100 mg/kg群でそれぞれ1,3,2および1例認められたが,異常性周期発現率に群間差は認められなかった.
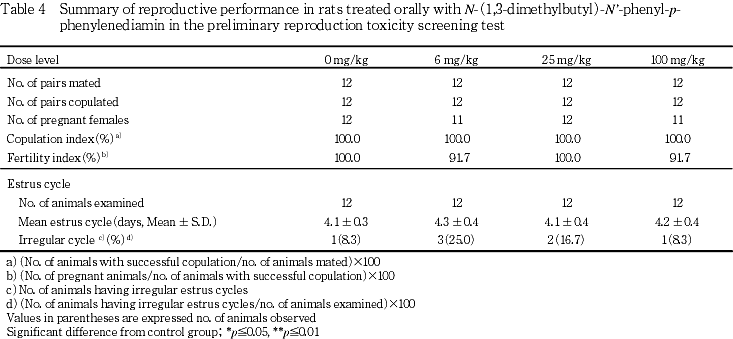
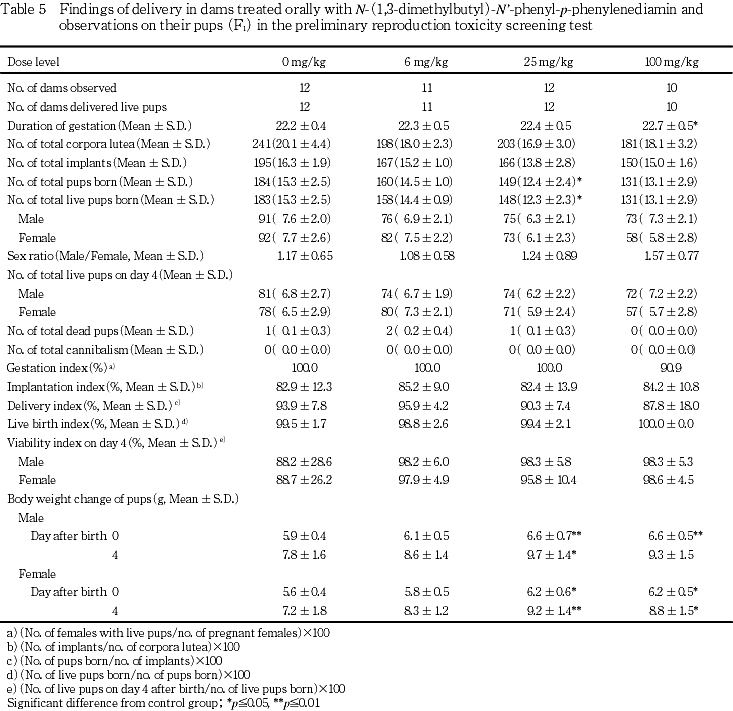
哺育0および4日の体重では,雌雄ともに25および100 mg/kg群で対照群に比べ高値を示し,雄では哺育0日は25および100 mg/kg群で,哺育4日は25 mg/kg群で有意な高値であった.雌では哺育0および4日ともに25および100 mg/kg群で有意な高値を示した.
哺育期間中の死亡児の剖検では,胸腺頸部残留が対照群および6 mg/kg群の雄各1例,腎臓の腎盂拡大が6 mg/kg群の雄1例に認められた.
哺育4日の剖検では,胸腺頸部残留が雄の6,25 mg/kg群および雌の対照群,6 mg/kg群でそれぞれ1,2,1および1例に認められた.その他,雄では肝臓の白色斑点および奇形結節,腎臓の嚢胞,尾の黒色化が,雌では肝臓の白色斑点,腎臓の腎盂拡大および尾の黒色化が各群で単発性に認められた.
体重には被験物質投与の影響は認められなかった.摂餌量では,100 mg/kg群の雄および同群の哺育期間の雌に増加が認められたが,体重には反映しない変化であり,一貫した変化ではないことから被験物質投与の影響とは判断しなかった.
病理学的検査では,生殖器系に対して被験物質投与に起因すると考えられる変化は認められなかったが,先に行われた28日間反復経口投与毒性試験1)と同様のものと考えられる病変が肝臓に認められた.即ち,雌雄ともに25および100 mg/kg群で肝重量の増加が観察され,剖検所見では雌雄の100 mg/kg群で肝臓の肥大が,組織所見では雄の25および100 mg/kg群で微小な空胞変性が認められた.この微細空胞は,肝小葉の主として中間部に出現した.空胞を持つ肝細胞の核は中央に位置しOil赤O染色に陽性,ナイル青染色にも青染することから,中性脂肪と共にリン脂質等を含む脂質の存在が示唆された.一方,雄で観察された空胞変性は雌では観察されなかった.この原因については不明であるが,妊娠から授乳期にかけて雌の肝臓における薬物代謝能が,非妊娠期と比べ異なること7)に起因している可能性が示唆された.また,雄の100 mg/kg群で副腎重量が増加したが,組織所見では異常は認められなかった.その他観察された所見は,いずれも対照群と比較し発生頻度に差は認められないか,用量に関連しない発生であり,全て自然発生性の病変と考えられた.
以上のことから,N-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミンの反復投与により肝重量の増加が雌雄の25 mg/kg以上の投与群で認められ,親動物に対する無影響量(NOEL)は雌雄とも6 mg/kg/dayと判断された.
生殖能および次世代児に対する影響はともに100 mg/kg/day投与によっても認められず,無影響量は100 mg/kg/dayと判断された.雌雄の生殖に及ぼす影響は100 mg/kg/day投与でも認められず,無影響量は100 mg/kg/dayと判断された.
| 1) | 大原直樹,化学物質毒性試験報告,7, 520(1999). |
| 2) | S. Gad and C. S. Weil, “Statistics and Experimental Design For Toxicologists,” Telford Press, New Jersey, 1986, pp.43-45. |
| 3) | 佐野正樹,岡山佳弘,医薬安全性研究会会報,32, 21(1990). |
| 4) | M, Yoshida, J. Japanese Soc. Comp. Statist., 1, 111(1988). |
| 5) | 佐久間昭,“薬効評価-計画と解析- ,”東京大学出版会,東京,1977, pp.109-117. ,”東京大学出版会,東京,1977, pp.109-117. |
| 6) | 石居進,“生物統計学入門,”培風館,東京,1975, pp.78-107. |
| 7) | 村田敏郎,“入門薬物代謝,”講談社サイエンティフィック,東京,1993, pp.130-131. |
| 連絡先 | |||
| 試験責任者: | 田中亮太 | ||
| 試験担当者: | 森山知通,伊賀達也,山本慎二 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田郡福田町塩新田字荒浜582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | ||||
| Authors: | Ryota Tanaka(Study director) Tomomichi Moriyama, Tatsuya Iga, Shinji Yamamoto | |||
| Biosafety Research Center, Foods, Drugs and Pesticides(An-pyo Center) | ||||
| 582-2 Shioshinden Arahama, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan | ||||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |||