N-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミンのラットを用いる
28日間反復経口投与毒性試験
Twenty-eight-day Repeat Dose Oral Toxicity Test of
N-(1,3-Dimethylbutyl)-N'-phenyl-p-phenylenediamine in Rats
要約
N-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミンの28日間反復経口投与毒性試験(回復14日間)を雌雄のSprague-Dawley系(Crj:CD)ラットを用いて実施した.投与量は,雌雄とも0(溶媒対照群),4,20および100 mg/kgを設定し,0および100 mg/kg投与群は回復試験の動物5匹を含む1群10匹,4および20 mg/kg投与群は1群5匹を使用して毒性試験を行った.
その結果,いずれの投与群においても死亡例は認められなかった.100 mg/kg投与群の雌雄において肝臓の重量が増加し,病理組織所見では100 mg/kg投与群の雌雄および20 mg/kg投与群の雌において門脈周囲性の肝細胞の脂肪化が認められた.20 mg/kg以上の投与群の雌および100 mg/kg投与群の雄の総蛋白濃度と100 mg/kg投与群の雄の総コレステロール濃度が増加した.さらに100 mg/kg投与群の雌雄では尿中蛋白が増加したが,腎臓の病理組織学所見に変化は認められなかった.100 mg/kg投与群の雌雄では貧血傾向がみられた.この他に100 mg/kg投与群の雌雄では,血小板数の増加が認められ,雌ではさらに,プロトロンビン時間と活性部分トロンボプラスチン時間が短縮した.100 mg/kg投与群について行った14日間の回復試験の結果,肝臓の重量増加ならびに門脈周囲性の肝細胞の脂肪化は軽減した.その他の異常は認められなかった.
以上のことから,本試験条件下におけるN-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミンの無影響量は,雌雄とも4 mg/kg/dayであると判断された.
方法
1. 被験物質および投与検体の調製法
被験物質は,精工化学(株)(東京)より提供されたN-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミン(ロット番号70911,暗紫褐色粒状固体,純度99 %)を使用し,入手後,試験開始まで密栓,冷蔵,遮光下で保管した.被験物質を各濃度ごとに秤量し,乳鉢で粉砕した後,コーンオイル(ロット番号:V7P1509,ナカライテスク(株))に0.08,0.4,2 w/v%となるように溶解して投与検体とした.投与検体は,ガラス容器に分注して投与時まで冷暗所(冷蔵庫)で保管した.なお,調製検体中の被験物質の安定性試験および含量試験を実施した結果,0.08および20 w/v%の濃度では,冷蔵遮光の条件で8日間安定であり,また,初回に調製した投与検体中の平均含量は,所定濃度の101〜106 %であることを確認した.
2. 動物および飼育方法
試験には,生後4 週で購入し,検疫を兼ねて6日間予備飼育した雌雄のSprague-Dawley系ラット(Crj:CD;SPF,日本チャールス・リバー(株))各30匹を使用した. 動物は,温度23.0〜24.5℃,湿度55〜68 %,換気回数約15回/時,照明12時間(7時〜19時)に制御した飼育室で,金属製金網床ケージに1匹ずつ収容し,固型飼料(CE-2,日本クレア(株))および水道水(秦野市水道局給水)を自由に摂取させて飼育した.
3. 群および群分け
予備試験において,Sprague-Dawley系ラットの雄,1 群5匹に,N-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミンを,100,300,および1000 mg/kgの用量で7日間反復投与した結果,1000 mg/kg投与群で4例が死亡し,黄疸が認められた.100および300 mg/kg投与群では肝臓およびパイエル板の腫大が認められた.従って,本試験における投与量は雌雄とも100 mg/kgを最高用量として,以下公比5で除し 20 mg/kgおよび4 mg/kgを設定した.対照群として溶媒(コーンオイル)投与群を設けた.
群分けは,検疫期間中に異常がなかった動物を用い,投与開始前日の体重に基づいて体重別層化無作為抽出法により行った.動物数は,雌雄とも0および100 mg/kg投与群を回復試験を行う5匹を含め各群10匹とし,4および20 mg/kg投与群を各群5匹とした.
4. 投与方法
投与経路は経口とし,1日1回,28日間,毎日9時〜12時の間にラット用胃管を用いて強制的に投与した.投与容量は,雌雄とも5 mL/kgとして,投与液量は各投与時に最も近い時点で測定した体重を基に個体別に算出した.なお,回復期間は14日間とした.
5. 検査項目
1) 一般状態の観察
投与期間および回復期間を通じて,死亡例の有無を調べたほか,全例の一般状態を投与期間中は毎日投与前および投与後の2回,回復期間中は1回観察した.
2) 体重および摂餌量の測定
投与第1週に,投与開始直前と投与第4日,第2週以降の投与期間および回復期間中には,1週に2回の頻度で全例の体重を測定し,投与期間あるいは回復期間終了日および剖検日にも測定した.また,投与開始週では,投与開始日に,第2週以降の投与期間および回復期間中は,1週に1回の頻度で全例の1日当たりの摂餌量を測定した.
3) 尿検査
投与期間終了週(投与第23日)に各群とも動物番号の若い方から5匹を選択し,また回復期間終了週(回復第9日)には全例を,いずれも約24時間代謝ケージに収容して採尿し,尿量(天秤で重量を計測し,比重で除す),色調および濁度(視診),比重(単位体積あたりの重量を測定)を検査した.また,代謝ケージに収容して約4時間以内に尿を採取し,pH,潜血,蛋白,糖,ケトン体,ビリルビン,ウロビリノーゲンおよび沈渣を試験紙法(クリニテック200+,バイエル・三共(株))および顕微鏡(光学顕微鏡)によりそれぞれ検査した.
4) 血液学検査
投与期間ないし回復期間終了日から翌日の剖検日にかけて定期解剖例全例を18から24時間絶食させ,ペントバルビタールナトリウム麻酔下で腹部後大静脈よりEDTA 2Kを抗凝固剤として採血し,Coulter Counter Model S-PLUS (コールターエレクトロニクス(株))により赤血球数(電気抵抗法),白血球数(電気抵抗法),血色素量(吸光度法)平均赤血球容積(電気抵抗法)および血小板数(電気抵抗法)を測定し,これらを基にヘマトクリット値,平均赤血球血色素量および平均赤血球血色素濃度を算出した.血液の一部は塗抹標本とし,白血球分類(Wright-Giemsa染色)および網状赤血球比率(Brecher法)を求めた.また,クエン酸ナトリウムを抗凝固剤として採取した血液を用いてプロトロンビン時間および活性部分トロンボプラスチン時間(光散乱検出法,CA-1000,東亜医用電子(株))を測定した.
(コールターエレクトロニクス(株))により赤血球数(電気抵抗法),白血球数(電気抵抗法),血色素量(吸光度法)平均赤血球容積(電気抵抗法)および血小板数(電気抵抗法)を測定し,これらを基にヘマトクリット値,平均赤血球血色素量および平均赤血球血色素濃度を算出した.血液の一部は塗抹標本とし,白血球分類(Wright-Giemsa染色)および網状赤血球比率(Brecher法)を求めた.また,クエン酸ナトリウムを抗凝固剤として採取した血液を用いてプロトロンビン時間および活性部分トロンボプラスチン時間(光散乱検出法,CA-1000,東亜医用電子(株))を測定した.
5) 血液生化学検査
血液学検査用の採血に引き続き,ヘパリンを抗凝固剤として全例から採血し,それぞれ血漿を分離して遠心方式生化学自動分析装置(COBAS-FARA,ロシュ・ダイアグノスティックス(株))により,総蛋白濃度(ビウレット法),アルブミン濃度(BCG法),総コレステロール濃度(COD ・DAOS法),ブドウ糖濃度(グルコキナーゼ・G6PDH法),尿素窒素濃度(ウレアーゼ・Gl.DH法),クレアチニン濃度(Jaff 法),アルカリフォスファターゼ活性(GSCC法),GOT活性(IFCC法),GPT活性(IFCC法),LDH活性(Wr
法),アルカリフォスファターゼ活性(GSCC法),GOT活性(IFCC法),GPT活性(IFCC法),LDH活性(Wr blewski-La Due法),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),トリグリセライド濃度(GPO・DAOS法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(イオン電極法)を測定した.
blewski-La Due法),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),トリグリセライド濃度(GPO・DAOS法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(イオン電極法)を測定した.
6) 病理学検査
上記の採血に引き続き,必要に応じて腋窩動脈を切断して放血屠殺したのち,器官および組織の肉眼的観察を行った.また,各動物の脳,胸腺,心臓,肝臓,腎臓,脾臓,副腎,卵巣または精巣,精巣上体の重量測定を行い,各器官重量を剖検日の体重で除して,それぞれの相対重量を算出した.さらに,脳,脊髄,下垂体,眼球,ハーダー腺,甲状腺(上皮小体を含む),顎下腺(舌下腺を含む),胸腺,心臓,肺,肝臓,腎臓,脾臓,膵臓,副腎,胃,十二指腸,空腸,回腸,結腸,直腸,卵巣または精巣,精嚢,精巣上体,膀胱,前立腺,大腿骨骨髄,坐骨神経および下腿部骨格筋を0.1 Mリン酸緩衝10 %ホルマリン液(pH 7.2)に固定した.病理組織学検査は,脳,脊髄,胸腺,心臓,肝臓,腎臓,脾臓,副腎,回腸,膀胱,大腿骨骨髄,坐骨神経のほか,剖検時に肉眼的変化の認められた一部の例の肺,皮膚,甲状腺についてパラフィン包埋後,ヘマトキシリン・エオジン染色標本を作製し,実施した.
6. 統計解析
体重,摂餌量,半定量検査を除く尿検査および定期解剖例の血液学検査,血液生化学検査ならびに器官重量について,各群ごとに平均値および標準偏差を求めた.また,試験群の構成が溶媒対照群を含め3群以上ある場合は,Bartlettの方法による分散の一様性の検定,一元配置型の分散分析ないしKruskal-Wallisの順位検定およびDunnettないしDunnett型の検定法で多重比較を行った.また,2群となる場合には,Studentのt検定ないしAspin-Welchのt検定を行った.さらに,病理組織学検査所見は,グレード分けしたデータについてMann-Whitney U検定(両側検定)を,陽性グレードを示した例数の合計値についてFisher直接確率の片側検定を行った.なお,これら溶媒対照群および被験物質投与群との間の有意差検定はいずれの場合も有意水準は5 %とした.
結果
1. 一般状態
一過性の流涎が,投与第8日から100 mg/kg投与群の雌雄で投与直後に観察され,投与期間終了日までに雄の計9例および雌の計10例に認められ,全ての例で3時間以内に消失した.その他の群でも雄または雌の1〜2例に認められた.これらの流涎は,回復期間中は認められなかった.
2. 体重(Fig. 1)
雌雄共に,投与期間および回復期間を通して,差は認められなかった.

3. 摂餌量
100 mg/kg投与群において,投与第1日に雌で有意な摂餌量の減少と回復第1日に雄で有意な増加が認められた.
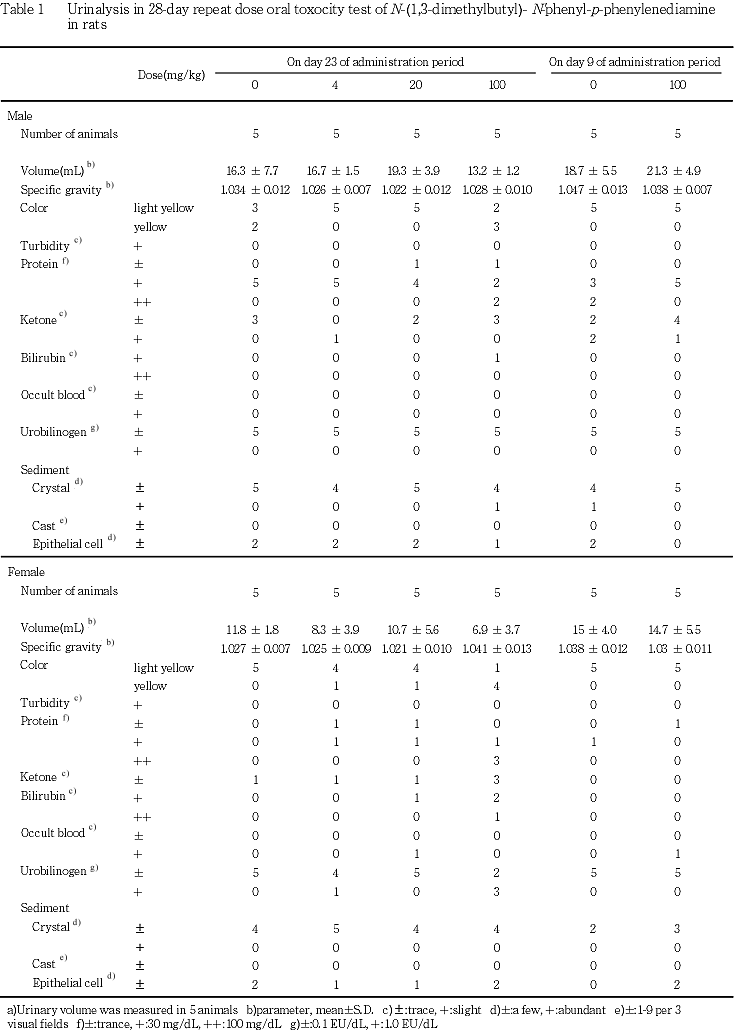
4. 尿検査(Table 1)
投与期間終了週の検査では,雌の100 mg/kg投与群の4例で蛋白が疑陽性または陽性を示し,100 mg/kg投与群ではその程度が4および20 mg/kg投与群より強かった.また,20 mg/kg投与群の雌1 例および100 mg/kg投与群の雄1例,雌3例にビリルビン陽性が認められた.なお,投与期間終了週の20 mg/kg投与群の雌1例および回復期間の100 mg/kg投与群の雌1例に潜血反応陽性が認められたが,これらは頸部皮膚の痂皮部位からの出血によるものと判断された.その他の検査項目については,溶媒対照群と被験物質投与群との間に差は認められなかった.
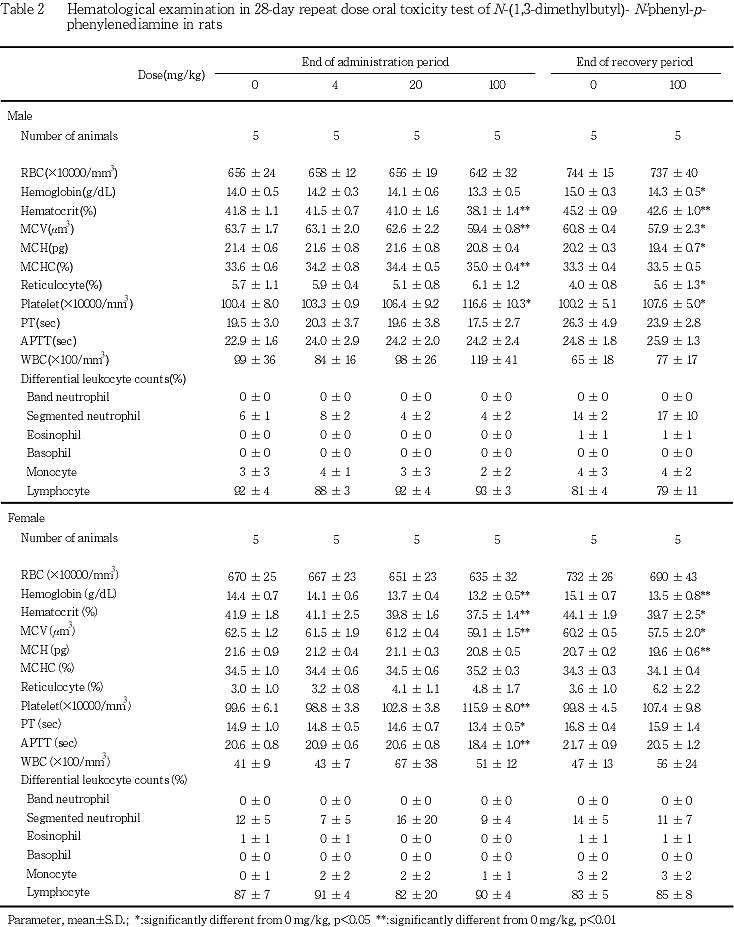
5. 血液学検査(Table 2)
投与期間終了時の検査では,100 mg/kg投与群の雌雄においてヘマトクリット値および平均赤血球容積の有意な減少ならびに血小板数の有意な増加が認められ,さらに,雄では平均赤血球血色素濃度の有意な増加,雌では血色素量の有意な減少およびプロトロンビン時間と活性部分トロンボプラスチン時間の有意な短縮がみられた.
回復期間終了時では,100 mg/kg投与群の雌雄において血色素量,ヘマトクリット値,平均赤血球容積ならびに平均赤血球血色素量の有意な減少が認められた.さらに,雄では網状赤血球比率の有意な増加もみられた.
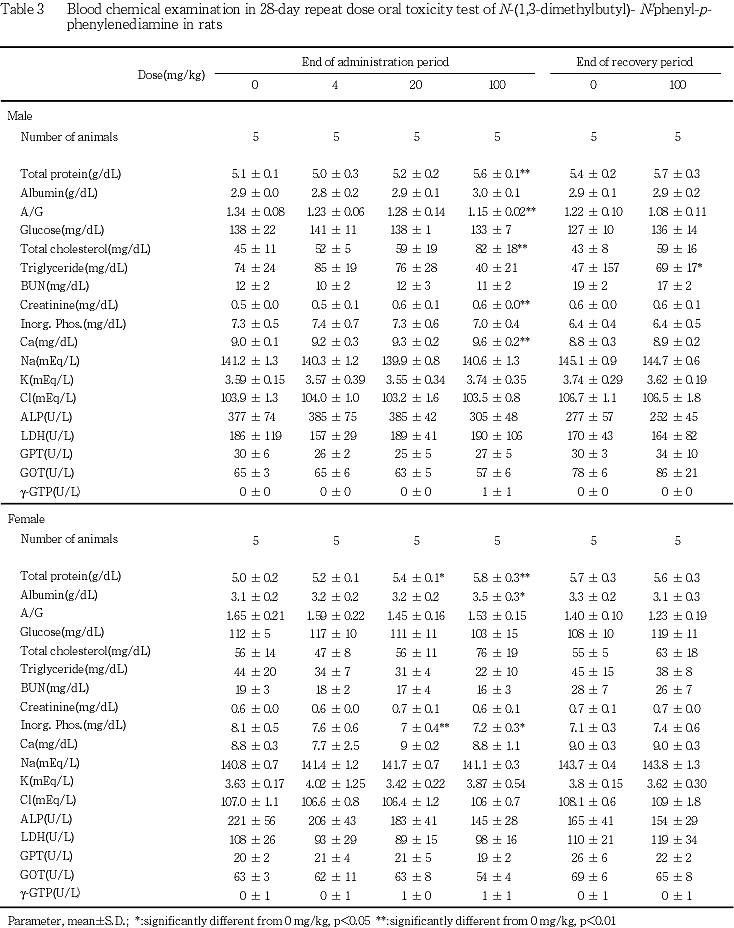
6. 血液生化学検査(Table 3)
投与期間終了時の検査では,100 mg/kg 投与群の雌雄において総蛋白濃度が有意に増加し.雌では20 mg/kg投与群においても有意な増加がみられた.また,100 mg/kg投与群の雄では総コレステロール濃度も有意に増加した.その他の項目にも有意差は認められたが,用量依存性はなかった.
回復期間終了時では,100 mg/kg投与群の雄においてトリグリセライド濃度が有意に増加したが,生理的変動範囲を越えるものではなかった.
7. 病理学検査
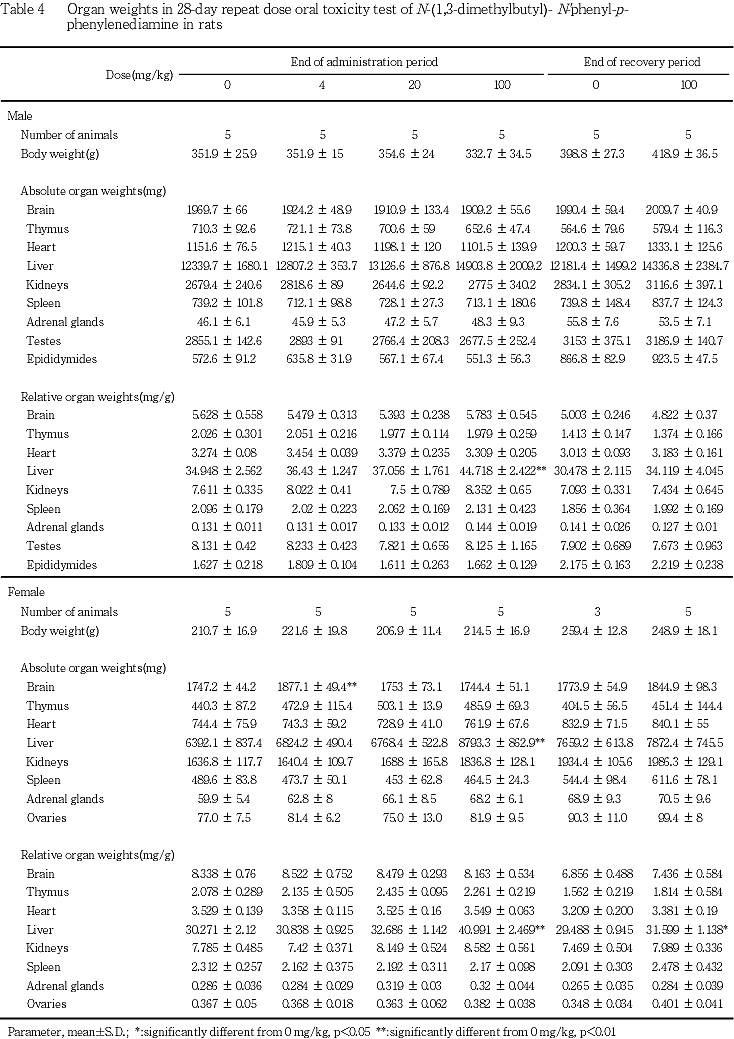
1) 器官重量(Table 4)
投与期間終了時剖検例では,100 mg/kg投与群の雌雄において,肝臓の相対重量と雌では絶対重量も有意に増加し,回復期間終了時剖検でも,雌の肝臓で相対重量の有意な増加が認められた.その他には被験物質投与によると考えられる変化は認められなかった.
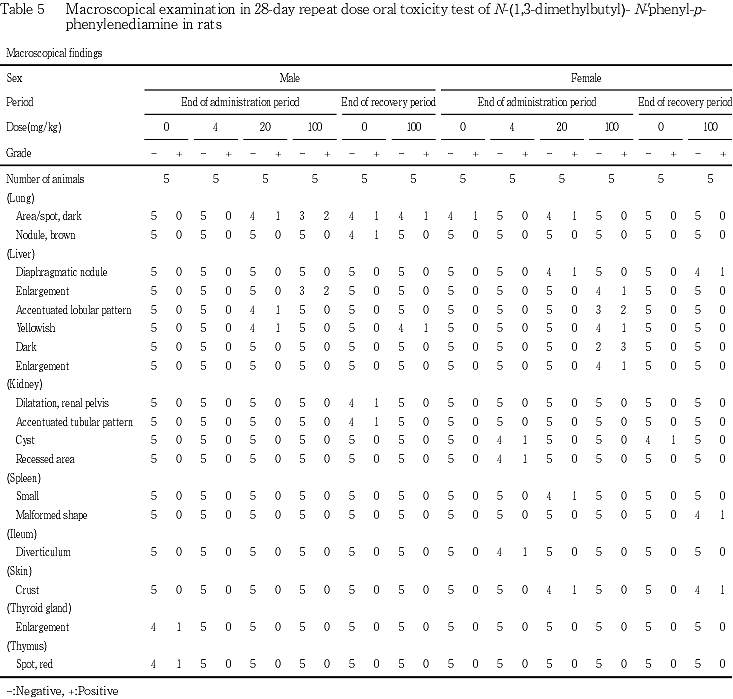
2) 剖検所見(Table 5)
投与期間終了時剖検例では,肝臓の腫大が100 mg/kg 投与群の雄2例,雌1例に,小葉構造の明瞭化が100 mg/kg投与群の雌2例,20 mg/kg投与群の雄1例に,黄色化が100 mg/kg投与群の雌1例,20 mg/kg投与群の雄1例に,暗色化が100 mg/kg投与群の雌3例に観察され,回復期間終了時剖検例では,肝臓の黄色化が100 mg/kg投与群の雄1例に観察された.その他にも肺,腎臓,皮膚などに所見が認められたが,被験物質投与による変化ではなかった.
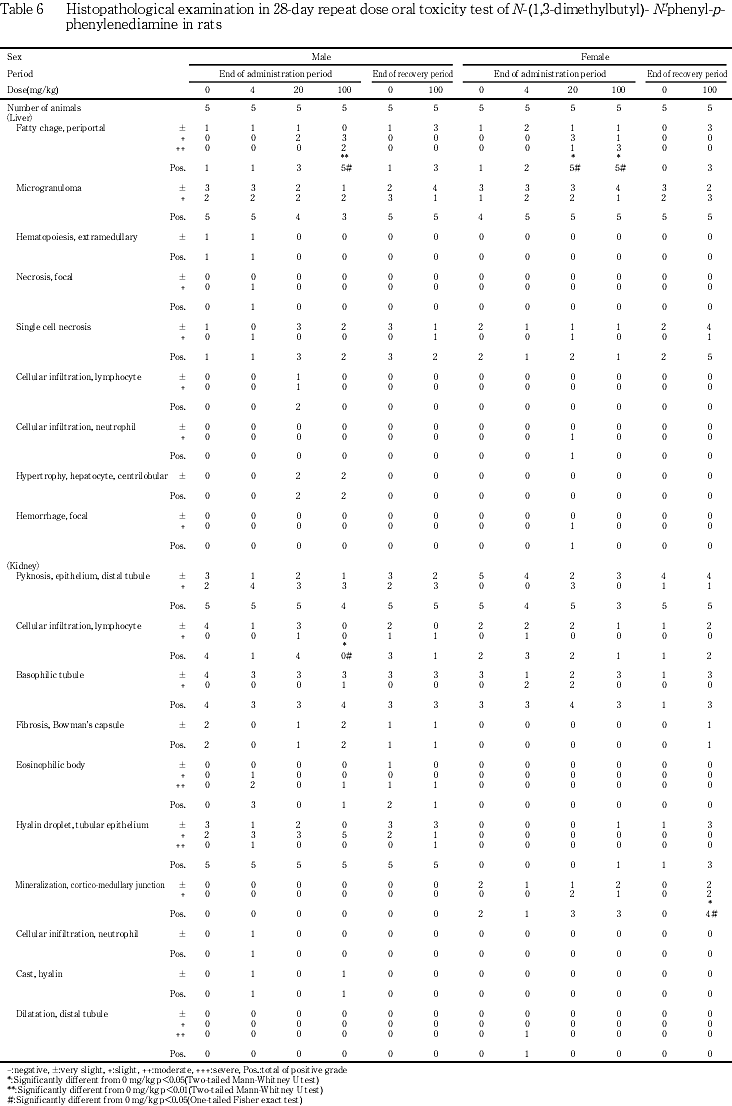
3) 病理組織学検査 (Table 6)
投与期間終了時剖検例では,門脈周囲性の肝細胞の脂肪化が100 mg/kg投与群の雌雄全例,20 mg/kg投与群の雄3例,雌全例,4 mg/kg投与群の雄1 例,雌2例,溶媒対照群の雌雄各1例に認められ,その発現頻度は100 mg/kg投与群の雌雄および20 mg/kg投与群の雌で溶媒対照群に比較して有意に増加し,病変の程度も強い傾向がみられた.回復期間終了時剖検例では,溶媒対照群の雄1例,100 mg/kg投与群の雌雄各3例に認められた.
その他にも腎臓,脾臓,副腎などに所見が認められたが,被験物質投与によると考えられる変化ではなかった.
考察
N-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミンを4,20および100 mg/kgの用量で,雌雄の Sprague-Dawley系(Crj:CD)ラットに1日1回,28日間にわたって反復経口投与した.
一般状態の変化として,投与期間終了日までにほぼ全例で観察された一過性の流涎は,N-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミンが刺激性を有することが報告されていることから1),被験物質の粘膜刺激性に対する反応であり,また,反復投与による条件反射であると考えられた.
尿検査では,100 mg/kg投与群の雌雄において溶媒対照群と比較し,蛋白質陽性あるいは疑陽性例の発現頻度が高く,これらの例では血液生化学検査においても血漿中の総蛋白濃度が増加しており,被験物質の影響である可能性が示唆される.
血液学検査では,貧血傾向が推察され,回復期間終了時に網状赤血球比率の増加が認められた.同様の変化は,N-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミンの3か月間混餌投与による毒性試験2)においても,1000 ppm投与群(摂餌量から雄で62.3 mg/kg/day,雌で75.0 mg/kg/day)あるいはそれ以上の用量を投与した群において認められていることから,被験物質投与による影響であると考えられる.
病理学検査では,投与期間終了時屠殺例の肝臓において,100 mg/kg投与群の雌雄で相対重量が増加し,雌では絶対重量の増加も認められ,雌雄ともに,20 mg/kg以上の投与群で門脈周囲性の肝細胞の脂肪化の発現頻度あるいは程度が増強する傾向が認められた.これらの結果から,本被験物質の投与による肝臓へ影響の可能性が示唆されたが血液生化学検査では,雄で総コレステロール濃度に変化はあったものの,血中トリグリセライド濃度には変化はみられないことから,その機序を明らかにすることはできなかった.回復期間終了時の肝臓でも,100 mg/kg投与群の雌での相対重量の増加は有意であったが,回復傾向が認められた.
以上の結果,20 mg/kg以上の投与群では雌で血中総蛋白濃度の増加,門脈周囲性の肝細胞の脂肪化が認められることから,本試験条件下におけるN-(1,3-ジメチルブチル)-N'-フェニル-p-フェニレンジアミンの無影響量は,雌雄とも4 mg/kg/dayであると判断された.
文献
| 1) | P. J. Moseley, International Polyner and Technology, 7, 12(1980). |
| 2) | Initial Submission, 3-month Feeding Study with SANTOFLEX 13 in Sprague-Dawley Rats with Cover Letter Dated 080792 and Attachment, EPA/OTS ; Doc #88-920007092 1992. |
| 連絡先 |
| 試験責任者: | 大原直樹 |
| 試験担当者: | 関 剛幸,高島宏昌,加藤博康,笠間菊子,永田伴子 |
| (財)食品薬品安全センター 秦野研究所 |
| 〒257-8523 神奈川県秦野市落合729-5 |
| Tel 0463-82-4751 | Fax 0463-82-9627 | |
| Correspondence |
| Authors: | Naoki Ohara(Study Director)
Takayuki Seki, Hiromasa Takasima, Hiroyasu Katoh, Kikuko kasama, Tomoko Nagata |
| Hatano Research Institute, Food and Drug Safety Center |
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan |
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |

 (コールターエレクトロニクス(株))により赤血球数(電気抵抗法),白血球数(電気抵抗法),血色素量(吸光度法)平均赤血球容積(電気抵抗法)および血小板数(電気抵抗法)を測定し,これらを基にヘマトクリット値,平均赤血球血色素量および平均赤血球血色素濃度を算出した.血液の一部は塗抹標本とし,白血球分類(Wright-Giemsa染色)および網状赤血球比率(Brecher法)を求めた.また,クエン酸ナトリウムを抗凝固剤として採取した血液を用いてプロトロンビン時間および活性部分トロンボプラスチン時間(光散乱検出法,CA-1000,東亜医用電子(株))を測定した.
(コールターエレクトロニクス(株))により赤血球数(電気抵抗法),白血球数(電気抵抗法),血色素量(吸光度法)平均赤血球容積(電気抵抗法)および血小板数(電気抵抗法)を測定し,これらを基にヘマトクリット値,平均赤血球血色素量および平均赤血球血色素濃度を算出した.血液の一部は塗抹標本とし,白血球分類(Wright-Giemsa染色)および網状赤血球比率(Brecher法)を求めた.また,クエン酸ナトリウムを抗凝固剤として採取した血液を用いてプロトロンビン時間および活性部分トロンボプラスチン時間(光散乱検出法,CA-1000,東亜医用電子(株))を測定した.
 法),アルカリフォスファターゼ活性(GSCC法),GOT活性(IFCC法),GPT活性(IFCC法),LDH活性(Wr
法),アルカリフォスファターゼ活性(GSCC法),GOT活性(IFCC法),GPT活性(IFCC法),LDH活性(Wr blewski-La Due法),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),トリグリセライド濃度(GPO・DAOS法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(イオン電極法)を測定した.
blewski-La Due法),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),トリグリセライド濃度(GPO・DAOS法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(イオン電極法)を測定した.






