メタクリルアミドのラットを用いる単回経口投与毒性試験
Single Dose Oral Toxicity Test of Methacrylamide in Rats
要約
繊維加工剤,接着剤,紙加工剤,凝集剤等の幅広い用途で使用されているメタクリルアミドの0(精製水),1315,1512,1739および2000 mg/kgを1群雌雄各5匹のCrj:CD(SD)IGSラットに単回経口投与してその急性毒性を検討し,以下の成績を得た.死亡は雌雄に投与後2日までに1512 mg/kg以上の投与群で認められた.一般状態では,投与日に1512 mg/kg以上の投与群で,よろめき歩行,振戦,流涎,過敏,口周囲の被毛の汚れ,座位(前肢を上げ腰は床についた状態),受け皿上に橙黄色尿が認められた.体重では,雌雄の各投与群で投与後1日に体重減少が認められたが,その後の推移には回復あるいは回復傾向が認められた.剖検では,死亡例には雌雄とも変化は認められなかったが,生存例の雄の数例に精巣の小型が認められ,病理組織学検査で精母細胞および精子細胞の減少がみられた.また,雌雄の生存例に中枢の神経細胞に変性・壊死が,末梢の神経線維に変性が認められた.LD50値(95 %信頼限界)は,雄で1789(1559〜2844)mg/kg,雌で1774(1575〜2212)mg/kgであった.
方法
1. 被験物質および投与液の調製
メタクリルアミド(純度:99.5 %,Lot No. 710130,三井化学(株),東京)は,白色の結晶で,融点が112〜114℃で,30℃で水100 gに40.9 g溶解する.入手後の被験物質は遮光気密容器に入れ,室温で保存し,残余被験物質を製造業者が分析し,投与期間中の被験物質の安定性を確認した.溶媒は日本薬局方精製水(ヤクハン製薬(株))を用い,これに被験物質を所定の濃度となるように溶解させた.調製液は,室温,遮光下で24時間安定であることから,調製後直ちに遮光できる褐色瓶に入れて室温で保存し,調製後24時間以内に使用した.また,これらの調製液について濃度を確認し,設定値の±5 %以内にあることを確認した.
2. 試験動物および飼育条件
日本チャールス・リバー(株)より受け入れた4週齢のSprague-Dawley系ラット(Crj:CD(SD)IGS)の雌雄を7日間の検疫・馴化を行った後,雌雄各25匹を選択して5週齢で試験に供した.投与日の体重は雄が112〜126 g,雌が96〜110 gであった.動物は,温度22〜24℃,湿度46〜56 %,換気回数10〜15回/時間および照明時間12時間(午前8時から午後8時まで点灯)に制御されたバリアシステムの飼育室で,ブラケット式金属製金網床ケージに群分け前は1ケージあたり4あるいは5匹を収容し,群分け後は個別飼育した.飼料は,γ線照射固型飼料(CRF-1,オリエンタル酵母工業(株))を金属製給餌器を用いて,飲料水は札幌市水道水を自動給水装置を用いてそれぞれ自由に摂取させた.
3. 投与量および投与方法
投与量設定試験では雌雄のラットに1000,1150,1323,1521および1749 mg/kgの5用量を1群3匹に投与し,雌雄とも1521 mg/kg以上で死亡がみられた.このことから,本試験の投与量は2000 mg/kgを最高用量として公比1.15で除し,1739,1512および1315 mg/kgとし,これに日本薬局方精製水を投与する対照群を含めた5群を設定した.1群の動物数は雌雄とも5匹とし,投与前日の体重に基づいて層化無作為抽出法により群分けを行った.
動物は,投与前に約17時間絶食させ,投与日の体重に基づいて10 mL/kgの容量でラット用胃ゾンデを用いて強制的に胃内に単回投与した.なお,給餌の再開は投与後4時間に行った.
4. 検査項目
1) 一般状態観察
投与後6時間までは頻繁に,その後は投与後14日の剖検日まで少なくとも1日1回観察した.
2) 体重測定
投与日の投与前,投与後1,3,5,7,10および14日に測定した.得られた体重から,体重増加量[(投与後14日体重)-(投与日体重)]および体重増加率[(体重増加量)/(投与日体重)×100]を算出した.
3) 病理学検査
死亡例は発見後速やかに,生存例は投与後14日に体外表を観察した後,エーテル麻酔下で放血致死させ,全身の器官・組織を肉眼的に観察し,肝臓,腎臓,脾臓,心臓,肺,脳,胃(前胃・腺胃・幽門部),十二指腸,空腸,回腸,盲腸,結腸,直腸,坐骨神経,腓腹筋および卵巣を10 %中性緩衝ホルマリン液で固定・保存し,精巣および精巣上体をブアン液で固定後,70 %エタノールに保存した.また,雌雄の各群から死亡例および生存例のそれぞれ1〜2例を選抜し,剖検時に摘出した器官・組織についてパラフィン包埋後薄切し,ヘマトキシリン・エオジン染色標本を作製して鏡検した.
5. 統計解析
雌雄の動物数および死亡動物数を用いて,probit法によりLD50値およびその95 %信頼限界を算出した.
体重,体重増加量および体重増加率について,Bartlettの検定法によって等分散性を解析し,等分散を示した場合は,一元配置分散分析法によって解析し,有意な場合には,Dunnettの検定法により対照群と他群との比較を行った.不等分散を示した場合は,Kruskal-Wallis法で解析し,有意な場合には,Mann-WhitneyのU-検定法を用いて対照群との比較を行った.なお,対照群との検定については,危険率5 %以下を統計学的に有意とした.
結果
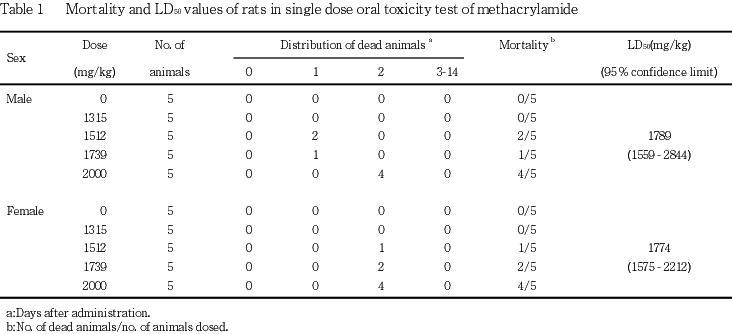
1. 死亡状況およびLD50値(Table 1)
雌雄とも投与日には死亡はみられず,投与後1〜2日に1512 mg/kg群の雄2例および雌1例,1739 mg/kg群の雄1例および雌2例,ならびに2000 mg/kg群の雄4例,雌4例が死亡した.
LD50値(95 %信頼限界)は,雄で1789(1559〜2844)mg/kg,雌で1774(1575〜2212)mg/kgであった.
2. 一般状態
雌雄とも投与日には1512 mg/kg以上の投与群で投与後1時間以内ないし数時間からよろめき歩行が認められ,投与後6時間まで継続した.投与後1日以降は雌雄とも1315 mg/kg以上の投与群で振戦が認められ,1512 mg/kg以上の投与群ではその他に流涎,過敏,口周囲の被毛の汚れあるいは座位(前肢を上げ腰は床についた状態)等も認められた.生存例では投与後5〜11日には全ての症状が消失した.
3. 体重
雌雄とも各投与群で投与後1日に体重減少が認められた.その後は体重増加がみられたものの,雄では1512および1739 mg/kg群で投与後14日まで有意な低値が継続し,1315 mg/kg群でも投与後3日まで有意な低値が認められた.しかし,1315 mg/kg群では投与後5日以降は順調な体重増加が認められた.また,雌では1739 mg/kg群で投与後7日,1512 mg/kg群で投与後5日,1315 mg/kg群で投与後3日まで有意な低値が認められたが,その後は各群とも順調な体重増加を示した.
4. 剖検
死亡例には雌雄とも変化は認められなかったが,生存例では,雄の1512および1739 mg/kg群の各1例に精巣の小型が認められた.
5. 病理組織学検査
死亡例では,雄の2000 mg/kg群および雌の1512 mg/kg以上の投与群で軽度な脾臓の萎縮が認められ,雄の1512 mg/kg以上の投与群では中等度な精巣のstep 1精子細胞の変性/壊死も認められた.
生存例では,雄の1512 mg/kg以上の投与群で精巣に軽度な精細管内多核巨細胞,軽度〜中等度な精細管のstage VII〜XIIのパキテン期精母細胞の減少,中等度なelongate精子細胞の減少等が認められ,精巣上体に中等度な精子減少も認められた.また、雄の1739 mg/kg以上の投与群では精巣上体に軽度な腔内細胞残屑も認められた.一方,雄の1512 mg/kg群の1例に大脳の海馬における中等度な神経細胞の壊死および軽度なグリオーシス,ならびに扁桃核における軽度な神経細胞の壊死が認められ,雌雄の1315 mg/kg以上の群では,小脳核における軽度な神経細胞の壊死,雄の1512および1739 mg/kg群ならびに雌の1739 mg/kg群では軽度なプルキンエ細胞の壊死,雄の1512 mg/kg群では分子層の軽度な空胞変性,雄の1512 mg/kg群および雌の1739 mg/kg群では坐骨神経の軽度な神経線維の変性が,それぞれ多くの検査例に認められた.
考察
投与後2日までに,1512 mg/kg群の雄2例および雌1例,1739 mg/kg群の雄1例および雌2例,ならびに2000 mg/kg群の雄4例,雌4例が死亡し,LD50値(95 %信頼限界)は雄で1789(1559〜2844)mg/kg,雌で1774(1575〜2212)mg/kgであった.
一般状態では,雌雄とも投与日に1512 mg/kg以上の群でよろめき歩行が認められ,雌雄とも投与後1日以降に多くの例で振戦,流涎,過敏,口周囲の被毛の汚れが認められた.これらの症候はその他少数例に認められた座位(前肢を上げ腰は床についた状態)も含めて神経症状あるいは神経症状に起因するものと考えられた.
体重では,雌雄とも各投与群で投与後1日に体重減少がみられ,その後も低値が継続したが,投与後5日以降は順調な体重増加が認められ回復あるいは回復傾向にあると考えられた.
剖検では,死亡例には変化は認められなかったが,生存例には雄の1512および1739 mg/kg群の各1例に精巣の小型が認められた.病理組織学検査で,精巣の小型の認められた精巣も含めて死亡例・生存例いずれにも精巣の変化が認められた.死亡例については精巣にstep 1精子細胞の変性/壊死,生存例については精細管内多核巨細胞,stage VII〜XIIのパキテン期精母細胞およびelongate精子細胞の減少が認められた.多核巨細胞は減数分裂期における分裂異常によって生じるものと考えられている1)ことから,減数分裂期前後の精細胞が障害されたと考えられた.また,elongate精子細胞の減少も,減数分裂期の精細胞が障害された結果と推察された.パキテン期精母細胞の減少については,死亡例において,精母細胞の障害を示唆する所見が認められていないことから,メタクリルアミドの直接の障害かあるいは二次的なものかについては明らかでなかった.メタクリルアミドにはマウスの生殖器官に対する毒性はないと報告されている2)が,今回の精巣の変化は,ラットにおけるメタクリルアミドの精巣毒性を示唆するものと考えられた.
一方,1512 mg/kg以上の投与群の生存例で,神経組織,特に中枢神経組織の壊死あるいは変性等の変化が認められ,類縁物質であるアクリルアミドでは短期間かつ大量の投与により発現するとの報告があること3)からアクリルアミドと同様に中枢神経を障害したものと考えられた.海馬における神経細胞の壊死については,脳の虚血に起因して起こるとの報告があり4,5),本試験においては1512 mg/kg群の1例のみに認められた変化であった.一方,本試験において末梢神経の変化は1512あるいは1739 mg/kg群の少数例にのみ認められた.メタクリルアミドの神経毒性はアクリルアミドに比べると弱いとの報告があり2),アクリルアミドの短期間かつ大量投与時の神経毒性が,末梢神経よりも中枢神経に強い変化をもたらすことが知られている3).これらのことから,メタクリルアミドの場合にもアクリルアミドと同様に末梢神経よりも中枢神経に強い変化を起こしたものと推察された.
脾臓の萎縮に関しては死亡例のみに認められている変化であることから,死亡に至る強度の侵襲および衰弱による二次的な変化と考えられた.
文献
| 1) | 高橋道人ら,"精巣毒性評価のための精細管アトラス ―ラット,マウス,イヌ―,"高橋道人編,ソフトサイエンス社,東京,1994,p. 50. |
| 2) | K. Hashimoto, J. Sakamoto and H. Tanii, Arch. Toxicol., 47, 179(1981). |
| 3) | D. J. O'Shaughnessy and G. J. Losos, Toxicol. Pathol., 14, 389(1986). |
| 4) | A. W. Brown and J. B. Brierley, Br. J. Exp. Pathol., 49, 87(1968). |
| 5) | M. Takeshita, K. Doi, K. Imaizumi and T. Mitsuoka, Exp. Anim., 38, 31(1989). |
| 連絡先 |
| 試験責任者: | 試験責任者:須永昌男 |
| 試験担当者: | 吉田文子,皆川英俊,平田真理子,古川正敏,山本美代子 |
| (株)化合物安全性研究所 |
| 〒004-0839 札幌市清田区真栄363番24 |
| Tel 011-885-5031 | Fax 011-885-5313 | |
| Correspondence |
| Authors: | Masao Sunaga (Study director)
Ayako Yoshida, Hidetoshi Minagawa, Mariko Hirata, Masatoshi Hurukawa, Miyoko Yamamoto |
| Safety Research Institute for Chemical Compounds Co., Ltd. |
| 363-24 Shin-ei, Kiyota-ku, Sapporo, Hokkaido, 004-0839, Japan |
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | |

