2−ヒドロキシプロパンニトリルのチャイニーズ・ハムスター
培養細胞を用いる染色体異常試験
In vitro Chromosomal Aberration Test of
2-Hydroxypropanenitrile on Cultured Chinese Hamster Cells
要約
2−ヒドロキシプロパンニトリルの染色体異常誘発能を、チャイニーズ・ハムスター培養細胞(CHL)を用いて検討した。
1) 細胞増殖抑制試験
2−ヒドロキシプロパンニトリルのCHL細胞に対する50%増殖抑制濃度は、直接法では0.38 mg/ml、代謝活性化法では1.00 mg/mlであった。
従って、染色体異常試験において、直接法では0.38 mg/ml、代謝活性化法では10 mMに相当する0.71 mg/mlの濃度を高濃度とし、その1/2の濃度を中濃度、1/4の濃度を低濃度として用いた。
2) 染色体異常試験
直接法により、CHL細胞を24時間および48時間処理した結果、0.38 mg/mlの濃度において両群ともそれぞれ6.5%および25.5%の細胞に構造異常の誘発がみられ、48時間処理では、濃度に依存して倍数性細胞が誘発された。また、代謝活性化法においては、S 9mix存在下および非存在下のいずれの処理条件においても、0.71 mg/mlの高濃度処理群で約10%の細胞に構造異常が誘発された。
3) 結論
2−ヒドロキシプロパンニトリルは、今回実施した試験条件下で、試験管内のCHL細胞に染色体異常を誘発すると結論した。
緒言
OECDを中心として行われている国際協力による安全性点検評価事業の一環として、高生産量既存化学物質で現在十分な安全性資料のない2−ヒドロキシプロパンニトリルについて、培養細胞に及ぼす細胞遺伝学的影響を評価するため、チャイニーズ・ハムスター培養細胞(CHL)を用いて試験管内染色体異常試験を実施した。
この試験は、「新規化学物質に係る試験の方法について」(昭和62年3月31日、環保業第237号、薬発第306号、62基局第303号)およびOECDガイドライン:473に準拠し、化学物質GLP(昭和59年3月31日、環保業第39号、薬発第229号、59基局第85号、改訂昭和63年11月18日、環企研第233号、衛生第38号、63基局第823号)に基づいて実施したものである。
方法
1. 使用した細胞
リサーチ・リソースバンク(JCRB)から入手(1988年2月、入手時:継代4代)したチャイニーズ・ハムスター由来のCHL細胞を、解凍後継代10代以内で試験に用いた。
2. 培養液の調製
培養には、牛胎児血清(FCS; J.R.Scientific、ロット番号C019407)を10%添加したイーグルMEM培養液を用いた。
3. 培養条件
2×10^4個のCHL細胞を、培養液5mlを入れたシャーレ(径6 cm、Corning)に播き、37℃のCO2インキュベーター(5% CO2)内で培養した。
4. 被験物質
2−ヒドロキシプロパンニトリル(CAS No. 78-97-7、ロット番号:302P4109、関東化学(株)製造、(社)日本化学工業協会提供)は褐色の液体で、水、アルコールに可溶、石油エーテル、二硫化炭素に不溶である。分子式C3H5NO、分子量71.08、融点−40℃、沸点182〜184℃、比重0.992〜0.998(20℃)の物質で、本試験に用いた2−ヒドロキシプロパンニトリルの純度は92%である(関東化学(株)資料)。本実験では被験物質が蒸留水に可溶であることから、溶媒として蒸留水を用いた。原体の安定性に関しては情報は得られなかったが、秦野研究所分析化学研究室で実施したエームス試験(試験計画番号:M-91-172)における溶媒中での安定性試験では、0.0469〜24.0 mg/mlの濃度範囲で3時間は安定であった。
5. 被験物質の調製
被験物質の調製は、使用のつど行った。原体を注射用蒸留水(以下蒸留水、(株)大塚製薬工場、ロット番号:KOJ84およびK1D79)に溶解して原液を調製し、ついで原液を蒸留水で順次希釈して所定の濃度の被験物質調製液を作製した。被験物質調製液は、全ての試験において培養液の10%(v/v)になるように加えた。染色体異常試験においては、直接法および代謝活性化法に用いた最高濃度群と最低濃度群について、被験物質調製液の含量測定を秦野研究所分析化学研究室において行った。その結果、調製液の濃度は、すべて許容範囲内(平均含量が添加量の85%以上)の値であった。
6. 細胞増殖抑制試験による処理濃度の決定
染色体異常試験に用いる被験物質の処理濃度を決定するため、被験物質の細胞増殖に及ぼす影響を調べた。被験物質のCHL細胞に対する増殖抑制作用は、単層培養細胞密度計(オリンパス)を用いて各群の増殖度を計測し、被験物質処理群の溶媒対照群に対する細胞増殖の比をもって指標とした。
その結果、50%の増殖抑制を示す濃度は、直接法では0.38 mg/ml、代謝活性化法では1.00 mg/mlとなった(Fig.1)。

7. 実験群の設定
細胞増殖抑制試験の結果より、染色体異常試験で用いる被験物質の最高処理濃度を、直接法(24および48時間連続処理)では0.38 mg/ml、代謝活性化法(6時間処理後18時間培養)では0.71 mg/ml(10 mM)とし、それぞれ最高処理濃度の1/2の濃度を中濃度、1/4の濃度を低濃度とした。
8. 染色体標本作製法
培養終了の2時間前に、コルセミドを最終濃度が約0.1μg/mlになるように培養液に加えた。染色体標本の作製は常法に従って行った。スライド標本は各シャーレにつき6枚作製し、試験系識別番号、暗番号およびスライド番号を記入した。ギムザ染色したスライド標本は、暗番号順にスライドケースに入れ、ケースには試験系識別番号、標本作製の日付を明示して保存した。
9. 染色体分析
作製したスライド標本のうち、1つのシャーレから得られた異なる標本を、複数の観察者がそれぞれブラインドの状態で分析した。
染色体の分析は、日本環境変異原学会、哺乳動物試験(MMS)分科会1)による分類法に基づいて行い、染色体型あるいは染色分体型のギャップ、切断、交換などの構造異常の有無と倍数性細胞(polyploid)の有無について観察した。また構造異常については1群200個、倍数性細胞については1群800個の分裂中期細胞を分析した。
10. 記録と判定
無処理対照、溶媒および陽性対照群と被験物質処理群についての分析結果は、観察した細胞数、構造異常の種類と数、倍数性細胞の数について集計し、各群の値を記録用紙に記入した。
染色体異常を有する細胞の出現頻度について、フィッシャーの“Exact probability test”法により溶媒対照群と被験物質処理群間および溶媒対照群と陽性対照群間の有意差検定を行った。
被験物質の染色体異常誘発性についての最終判定は、石館ら2)の判定基準に従い、染色体異常を有する細胞の頻度が5%未満を陰性、5%以上10%未満を疑陽性、10%以上を陽性とした。
結果および考察
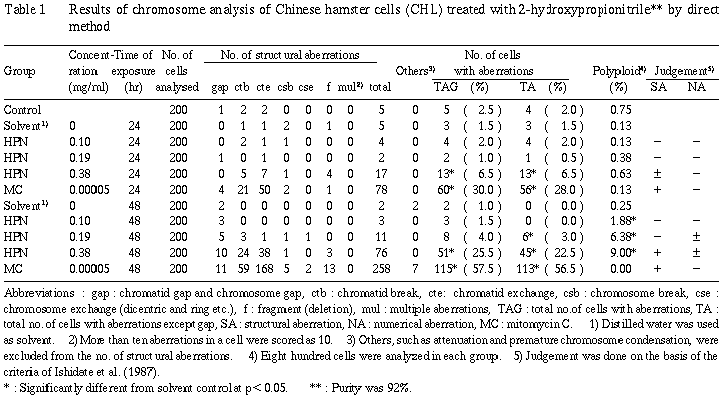
直接法による染色体分析の結果をTable 1に示した。
2−ヒドロキシプロパンニトリルを加えて24時間処理した高濃度処理群(0.38 mg/ml)において、観察細胞の6.5%(p=9.41×10^-3)に構造異常が誘発された。さらに、48時間処理した高濃度処理群では25.5%(p=5.31×10^-15)の細胞に異常が観察され陽性となった。また、倍数性細胞の出現頻度については濃度依存性が認められ、高濃度処理群では9%(p=3.02×10^-20)の細胞に倍数性細胞が誘発され、疑陽性の結果が得られた。
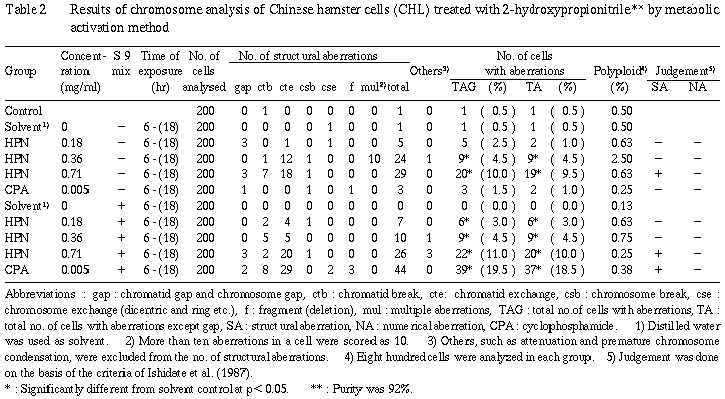
代謝活性化法による染色体分析の結果をTable 2に示した。
2−ヒドロキシプロパンニトリルを加えてS9 mix存在下および非存在下で6時間処理した高濃度(0.71 mg/ml)処理群において、それぞれ構造異常を有する細胞が10%(p=6.67×10^-6)および11%(p=1.29×10^-7)誘発され、陽性となった。一方、倍数性細胞はS9 mix非存在下の中濃度群(0.36 mg/ml)で有意な増加(p=7.14×10^-4)が認められた。
陽性対照として用いた直接法でのMC処理群、およびS9 mix存在下でのCPA処理群では染色分体交換(cte)や染色分体切断(ctb)などの構造異常をもつ細胞が高頻度に誘発された。
なお、本試験の実施にあたり、試験の信頼性に悪影響を及ぼす疑いのある予期し得なかった事態及び試験計画書からの逸脱はなかった。
文献
| 1) | 日本環境変異原学会・哺乳動物試験分科会編:"化学物質による染色体異常アトラス", 朝倉書店, 1988. |
| 2) | 石館基監修:"<改訂>染色体異常試験データ集",エル・アイ・シー社, 1987. |
| 連絡先: |
| 試験責任者 | 田中憲穂 |
| (財)食品薬品安全センター秦野研究所 |
| 〒257 神奈川県秦野市落合 729-5 |
| Tel 0463-82-4751 | Fax 0463-82-9627 | |
| Correspondence: |
| Tanaka, Noriho |
| Hatano Research Institute, Food and Drug Safety Center |
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257, Japan |
| Tel 81-463-82-4751 | Fax 81-463-82-9627 | |