1, 1, 1-トリス(ヒドロキシメチル)エタンのラットを用いる
反復経口投与毒性・生殖発生毒性併合試験
Combined Repeat Dose and Reproductive/Developmental Toxicity Screening Test of
1,1,1-Tris(hydroxymethyl)ethane by Oral Administration in Rats
要約
1,1,1-トリス(ヒドロキシメチル)エタンは,3価のオキシメチル基を含む炭化水素である.1,1,1-トリス(ヒドロキシメチル)エタンの毒性については,ラットに 2000 mg/kg を単回経口投与しても,一般状態の異常および死亡は認められないことが報告されている1).本試験では,OECDによる既存化学物質の安全性点検に係わる毒性調査事業の一環として,1,1,1-トリス(ヒドロキシメチル)エタンの 0(溶媒対照),100,300 および1000 mg/kg を Sprague-Dawley 系(Crj:CD)ラットの雌雄(各13匹/群)に,交配前2週間および交配期間2週間経口投与し,雄では交配期間終了後2週間,雌では妊娠期間を通して分娩後哺育3日まで投与を継続して,親動物に対する反復投与毒性および生殖能力,ならびに次世代児の発生・発育に及ぼす影響について検討した.
その結果,雄では,1000 mg/kg を反復投与しても一般状態,体重増加および摂餌量に変化は認められず,42回反復投与後に実施した,器官重量測定,病理学検査および血液学検査の各成績にも投与の影響は認められなかった.しかし,1000 mg/kg 投与によりGOT および GPT 活性が上昇し,ブドウ糖濃度が低下したことから,肝臓に影響を及ぼす可能性が示唆された.
雌では,1000 mg/kg を最長44回反復投与しても一般状態および摂餌量に変化は認められなかったが,妊娠期間中の体重増加が抑制された.その他の時期の体重増加および哺育4日における器官重量ならびに病理学検査には投与の影響は認められなかった.
生殖発生毒性については,1000 mg/kg を投与しても,交尾,排卵および受胎に影響は認められず,分娩および哺育状態の異常も認められなかった.また,出生児の生存性,性比および体重にも影響は認められず,形態異常も観察されなかった.
これらのことから,本試験条件下では,1,1,1-トリス(ヒドロキシメチル)エタンの反復投与毒性に関する無影響量は,雌雄いずれの動物に対しても 300 mg/kg/day であり,生殖発生毒性に関する無影響量は,1000 mg/kg/day 以上であると結論される.
方法
1. 被験物質
1,1,1-トリス(ヒドロキシメチル)エタン〔分子式:C5H12O3; 分子量:120.15; 融点:200℃; 沸点:283℃/1176 mmHg〕は,白色固体で,三菱ガス化学 から入手した.本被験物質〔ロット番号:80913; 純度:99.0 wt%( 主な不純物:ビス(2,2-ジメチロールプロピル)エーテル 0.1%,ビス(2,2-ジメチロール)プロポキシメタン0.3 %,ペンタエリスリトール0.3 %,水分0.14 %)は,使用時まで室温で保管し,日局注射用水〔光製薬
から入手した.本被験物質〔ロット番号:80913; 純度:99.0 wt%( 主な不純物:ビス(2,2-ジメチロールプロピル)エーテル 0.1%,ビス(2,2-ジメチロール)プロポキシメタン0.3 %,ペンタエリスリトール0.3 %,水分0.14 %)は,使用時まで室温で保管し,日局注射用水〔光製薬 ,製造番号:9609CA〕に溶解して,いずれの用量においても1回の投与液量が 5 mL/kg 体重になるように含量を調整した.調製液は,冷蔵保管し,調製後7日以内に投与した.調製液中の被験物質は,冷蔵条件下で少なくとも8日間安定である1).また,本試験において調製された投与検体には,ほぼ所定量の被験物質が含有されていたことを確認した.
,製造番号:9609CA〕に溶解して,いずれの用量においても1回の投与液量が 5 mL/kg 体重になるように含量を調整した.調製液は,冷蔵保管し,調製後7日以内に投与した.調製液中の被験物質は,冷蔵条件下で少なくとも8日間安定である1).また,本試験において調製された投与検体には,ほぼ所定量の被験物質が含有されていたことを確認した.
2. 使用動物および飼育条件
試験には,雌雄ともに7週齢で購入した日本チャールス・リバー 日野飼育センター生産の Sprague-Dawley 系ラット(Crj:CD,SPF)を使用した.購入した動物は,入荷後6日間,馴化と検疫を兼ねて予備飼育して試験に供した〔群分け時体重範囲:雄296.5〜330.7 g,雌195.0〜223.1 g〕.
日野飼育センター生産の Sprague-Dawley 系ラット(Crj:CD,SPF)を使用した.購入した動物は,入荷後6日間,馴化と検疫を兼ねて予備飼育して試験に供した〔群分け時体重範囲:雄296.5〜330.7 g,雌195.0〜223.1 g〕.
各動物は,基準温湿度各24±1℃,および50〜65 %,換気回数約15回/時間,照明12時間(午前7時〜午後7時)に条件設定された飼育室で,金属製ケージ(日本ケージ)に個別に収容して飼育し,固型飼料(CE-2,日本クレア)および水道水を自由に摂取させた.妊娠14日以後の母動物は,ラット用繁殖ケージ(日本クレア )に収容し,床敷として紙パルプ製チップ(ALPHA-dri,加商
)に収容し,床敷として紙パルプ製チップ(ALPHA-dri,加商 )を適宜供給した.
)を適宜供給した.
3. 群分け法
雌雄とも投与開始日の体重をもとに体重別層化無作為抽出法に準じて群分けし,1群につき各13匹を用意した.
4. 投与量,群構成,投与期間および投与方法
投与量は,先に実施した14日間反復経口投与による予備試験において,被験物質投与により雌雄動物に軽度な体重増加抑制傾向が認められた1000 mg/kg を高用量に設定し,公比約3で減じ,中用量には300 mg/kg,低用量には100 mg/kg を設定した.対照群のラットには,1,1,1-トリス(ヒドロキシメチル)エタンの媒体とした日局注射用水を被験物質投与群と同一条件で投与した.各用量の投与検体は,雄に対しては交配前14日間と交配期間14日間および交配期間終了後14日間の連続42日間,また,雌に対しては交配前14日間と最長14日間の交配期間中(交尾まで)ならびに交尾した雌では妊娠期間を通して分娩後の哺育3日まで毎日1回,ラット用胃管を用いて強制的に経口投与した.毎日の投与は,通常9時〜12時に行い,各動物の投与液量は,雄ならびに交配前および交配期間中の雌については週1回の測定体重をもとに,また,交尾した雌については妊娠0日の体重をもとにそれぞれ算定した.
5. 観察方法
1) 親動物
A. 一般状態
雌雄とも,全例について試験期間中毎日観察した.
B. 体重
雌雄とも,全例について体重を試験期間中週1回〔雄:投与1,8,15,22,29,36,42日,雌:投与1,8,15日〕および解剖日に測定した.投与29日までに交尾しなかった雌は,投与22日にも体重を測定した.また,交尾した雌では,妊娠0,7,14,20日,分娩した雌では,分娩後0および4日(哺育0および4日)の体重を測定した.
C. 摂餌量
雌雄とも,全例について体重測定日と同日に餌重量を測定し,測定日から次の測定日までの間の摂餌量を算定した.2週間の交配期間中の摂餌量は測定しなかった.交尾した雌では,妊娠0〜7,7〜14,14〜20日の,さらに,分娩した雌では,哺育0〜4日の摂餌量を測定した.
D. 交配
交配は,投与15日の夕方から最長2週間,同一群内の雌雄を1対1で同居させて行った.交尾成立の確認は,毎朝,腟栓および腟垢標本を作製し,標本中の精子の存在を調べることにより行い,交尾が確認された雌は,その日を妊娠0日と起算して雄から分離し,個別に飼育した.交配結果から,各群について交尾率〔(交尾動物数/同居動物数)×100〕,受胎率〔(受胎動物数/交尾動物数)× 100〕,同居開始日から交尾確認日までの日数およびその間に回帰した発情数を求めた.
E. 分娩・哺育状態
各群とも交尾した雌は,全例を自然分娩させた.分娩状態は,直接観察が可能なものについてのみ行い,それ以外の動物については,分娩後の徴候から分娩状態の異常の有無を判断した.分娩後は哺育状態を観察した.
F. 分娩日の算定
分娩の確認は,午前9時〜11時に限定し,この時間帯に分娩が完了していることを確認した動物について,その日を哺育0 日と規定した.午前11時を過ぎて分娩した動物については,翌日を分娩日とした.
分娩を確認した全例について妊娠期間(妊娠0日から分娩日までの日数)を算定し,出産率〔(生児出産雌数/受胎雌数)×100〕を各群について求めた.
G. 剖検
a) 雄動物
イ. 血液学検査
全例について,最終投与日の投与終了後から絶食を開始し,翌日(絶食開始18〜24時間後)に,ペントバルビタール麻酔下で腹部後大静脈より EDTA を抗凝固剤として採血し,赤血球数(RBC),白血球数(WBC),血色素量(Hb),平均赤血球容積(MCV),血小板数を多項目血液自動測定機(Coulter Counter Model S-PLUS IV)により測定し,ヘマトクリット値(Ht),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC)を算出した.白血球百分比は Wright-Giemsa 染色を行い,光学顕微鏡下で観察して算出した.
ロ. 血液生化学検査
全例について,血液学検査のための採血に引き続き,ヘパリンを抗凝固剤として採血し,血漿を分離して遠心方式生化学自動分析装置(COBAS- FARA)および全自動電解質分析装置 EA-05(A & T)を用い,総蛋白濃度(ビウレット法),アルブミン濃度(BCG 法),総コレステロール濃度(COD ・DAOS 法),トリグリセライド濃度(GPO・DAOS法),ブドウ糖濃度(グルコキナーゼG6PDH 法),尿素窒素濃度(ウレアーゼGl.DH 法),クレアチニン濃度(Jaff 法),アルカリフォスファターゼ活性(パラニトロフェニルリン酸基質法),GOT 活性(SSCC法),GPT 活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットS シリーズ),カルシウム濃度(OCPC 法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法),A/G 比(計算)について分析した.
法),アルカリフォスファターゼ活性(パラニトロフェニルリン酸基質法),GOT 活性(SSCC法),GPT 活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットS シリーズ),カルシウム濃度(OCPC 法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法),A/G 比(計算)について分析した.
ハ. 器官重量および病理学検査
全例について剖検し,肝臓,腎臓,胸腺,精巣および精巣上体の重量を測定した.これらの器官のうち,精巣および精巣上体はブアン液に固定して保存し,その他の器官および脳,心臓,脾臓,副腎,膀胱は,10 %ホルマリンに固定して保存した.これらの器官は高用量群および対照群について常法に従ってパラフィン切片とし,ヘマトキシリン・エオジン染色を行って病理組織学検査を行った.また,これらの器官以外で剖検時に異常の観察された器官は,10%ホルマリンに固定して保存したが,いずれも投与に関連した変化ではないと判断されたので,病理組織学検査は実施しなかった.
b) 雌動物
イ. 器官重量および病理学検査
交尾したが分娩しない雌は妊娠25日相当日に,分娩した雌は哺育4日に,それぞれ致死量のペントバルビタールを投与後に放血・致死させ,剖検した.妊・不妊のいずれの例においても卵巣および子宮を摘出し,子宮については着床数を数え,着床の認められた動物を受胎例とした.卵巣は実体顕微鏡下で妊娠黄体数を数え,ブアン液に固定して保存した.不妊例の卵巣については,病理組織学検査を行った.また,肝臓,腎臓および胸腺の重量を全例について測定し,脳,心臓,脾臓,副腎,子宮,膀胱とともに10 %ホルマリンに固定して保存した.これらの器官は高用量群および対照群について常法に従ってパラフィン切片とし,ヘマトキシリン−エオジン染色を行って病理組織学検査を行った.これらの器官以外で剖検時に異常が観察された器官も,10 %ホルマリンに固定して保存したが,いずれも投与に関連した変化であると判断されなかったので,病理組織学検査は実施しなかった.
2) 出生児
A. 産児数の算定
哺育0日に産児数(生存児+死亡児)を調べ,分娩率〔(産児数/着床痕数)×100〕および生児出産率〔(出産生児数/着床痕数)×100〕を求めた.また,産児の外表奇形の有無および性別を調べ,生存児の性比〔(雄の生児数/出産生児数)×100〕を算出した.
B. 死亡児数の算定
死亡児数を毎日調べ,出生率〔(出産生児数/産児数)×100〕,新生児の哺育4日の生存率〔(哺育4日の生児数/哺育0日の生児数)×100〕および哺育4日における性比〔(雄の生児数/雌の生児数)×100〕を求めた.死亡児は剖検し,異常の有無,外表および内部器官の肉眼的観察を行った.
C. 体重測定
哺育0日および4日に一腹単位で雌雄別に体重(litter 重量)を測定し,〔litter重量/測定児数〕を各腹について求めた.
D. 剖検
哺育4日に全例をエーテル吸入により致死させて剖検し,外表および内部器官の肉眼的観察を実施した.
6. 統計解析
交尾率,受胎率および性比については Yates の補正を含むχ^2検定を行った.病理組織所見については,グレード分けしたデータについては Mann-Whitney のU検定2, 3)を用いて検定し,陽性グレードの合計値については Fisher 直接確率の片側検定3)で行った.その他のデータは,個体ごとに得られた値あるいはlitterごとの平均値を1標本として,各群の分散が0より大きい場合は,先ず,Bartlett法4)により各群の分散の一様性について検定した.その結果,分散が一様とされた場合には,一元配置型の分散分析5)を行い,群間に有意性が認められた場合には Dunnett法6)あるいは Scheff 法7)により対照群と被験物質投与群との間で平均値の差の検定を行った.分散が一様でなかった場合,および分散が0となる群が存在するときは,Kruskal-Wallis 順位検定7)を行い,群間に有意性が認められた場合に,対照群と被験物質投与群との差について Dunnett 法5)あるいは Scheff
法7)により対照群と被験物質投与群との間で平均値の差の検定を行った.分散が一様でなかった場合,および分散が0となる群が存在するときは,Kruskal-Wallis 順位検定7)を行い,群間に有意性が認められた場合に,対照群と被験物質投与群との差について Dunnett 法5)あるいは Scheff 法6)の検定を行った.有意水準は5%および1%とした.
法6)の検定を行った.有意水準は5%および1%とした.
結果
 .反復投与毒性(親動物所見)
.反復投与毒性(親動物所見)
1) 死亡例,瀕死屠殺例,一般状態
雌雄とも,いずれの投与群にも死亡は認められず,瀕死屠殺例もなかった.
一般状態については,雄には異常は認められず,雌についても,貧毛が1000 mg/kg 投与群の1例に観察された他に異常は認められなかった.
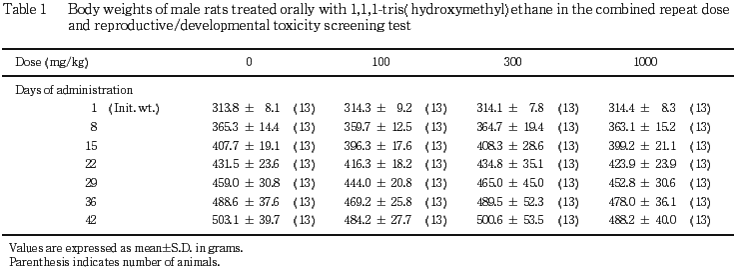
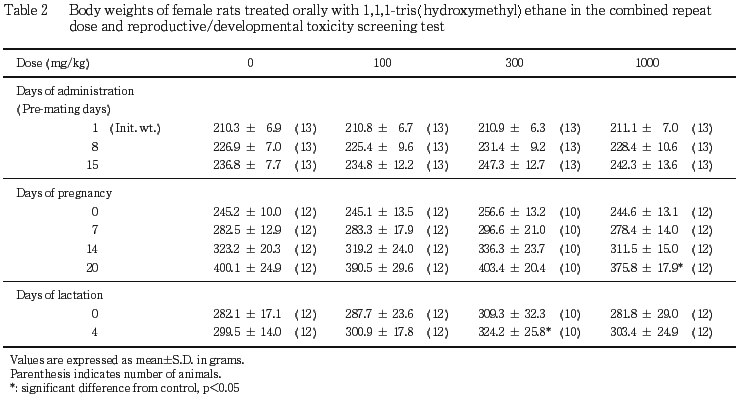
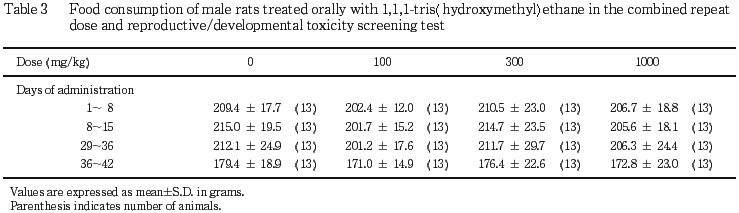
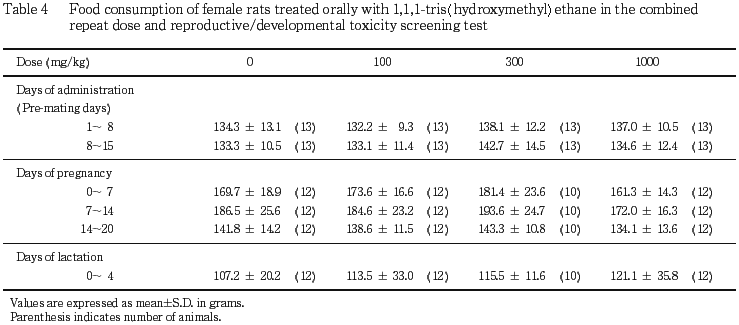
2) 体重,摂餌量(Tables 1〜4)
雄では,いずれの時期の体重および摂餌量にも対照群との間に有意差は認められなかった.雌では,1000 mg/kg 投与群の妊娠期の体重増加に抑制が認められ,妊娠20日の体重,妊娠7〜14日の増加量および妊娠20日までの累積増加量が対照群と比較して有意(p<0.05,p<0.01)に低い値を示した.300 mg/kg 投与群の体重については,増加が認められ,投与8〜15日の増加量および投与15日までの累積増加量,哺育4日の体重が,対照群と比較してそれぞれ有意(p<0.05)に高い値を示した.100 mg/kg 投与群の体重については対照群と同様であり,また,摂餌量については,いずれの投与群も対照群との間に有意差は認められなかった.
3) 解剖時検査所見
A. 雄〔解剖日:投与期間(42回投与)終了翌日〕
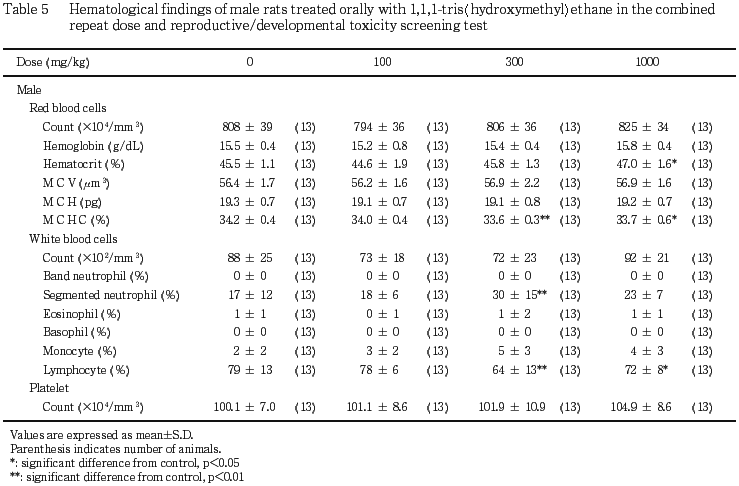
(1) 血液学検査所見(Table 5)
100 mg/kg 投与群では,いずれの項目にも対照群との間に有意差は認められなかった.300 mg/kg 以上の投与群で平均血色素濃度が対照群と比較して有意な低値(p<0.05,p<0.01)を示したが,被験物質の投与量に依存した変化ではなかった.このほか,1000 mg/kg 投与群においてヘマトクリット値が対照群と比較して有意(p<0.05)に増加した.白血球百分比については,300 mg/kg 投与群において,分節核好中球が対照群と比較して有意(p<0.01)に増加し,リンパ球が300 mg/kg 以上の投与群で有意(p<0.05,p<0.01)に減少したが,いずれも被験物質の用量に依存した変化ではなかった.その他の項目には対照群と被験物質投与群との間で有意差は認められなかった.
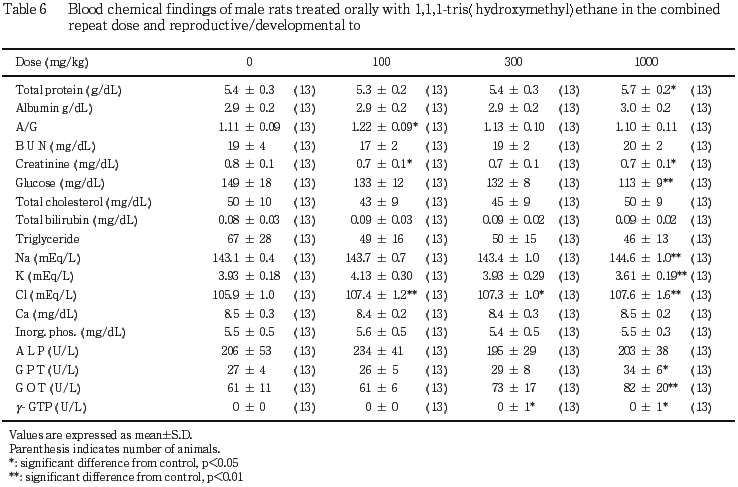
(2) 血液生化学検査所見(Table 6)
対照群と比較して1000 mg/kg 投与群において総蛋白濃度,ナトリウム濃度が,有意(p<0.05,p<0.01)に増加し,GOT 活性およびGPT活性も有意(p<0.05,p<0.01)に上昇した.一方,ブドウ糖濃度およびカリウム濃度は有意(p<0.01)に減少した.また,γ-GTP活性は僅少差ではあるが,300 mg/kg 以上の投与群において対照群と比較して有意(p<0.05)に増加した.この他,用量に依存した変化ではないが,対照群と比較して,A/G 比が100 mg/kg 投与群において有意(p<0.05)に増加し,クレアチニン濃度が100 mg/kgおよび 1000 mg/kg 投与群で有意(p<0.05)に減少し,塩素濃度が被験物質投与群で有意(p<0.05,p<0.01)に増加した.
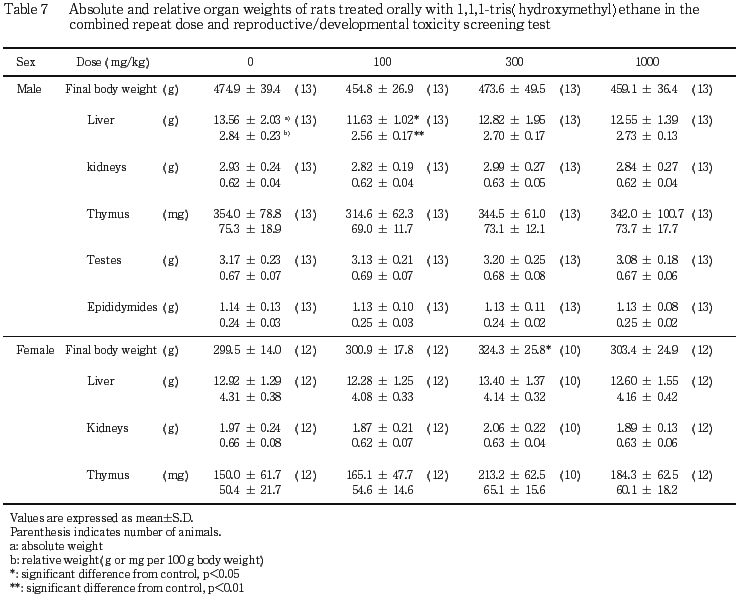
(3) 器官重量(Table 7)
100 mg/kg 投与群において肝臓重量およびその比体重値が対照群と比較して有意(p<0.05,p<0.01)に減少したが,その他の器官重量および比体重値については対照群との間に有意差は認められなかった.また,300 mg/kg 以上の投与群の器官重量および比体重値については,対照群との間に有意差は認められなかった.
(4) 剖検所見
以下の所見が観察されたが,いずれも被験物質の用量に依存した変化ではなかった.脳では,対照群の1例の大脳皮質の一部に陥凹部が認められ,肝臓では300および1000 mg/kg 投与群に淡色域が,300 mg/kg 投与群には黒色の帯状斑がそれぞれ1例認められ,対照群の2例に小葉像の明瞭化が認められた.また,腎臓では,対照群の1例に皮髄境界部に暗色点が,100 mg/kg 投与群の1例に腎臓の陥凹部が認められた.100 mg/kg 投与群では精巣上体の結節も1例にみられた.その他,肺では暗赤色域,暗褐色あるいは暗赤色点が各群に1例ずつ,精嚢では小型化が対照群に1例認められた.
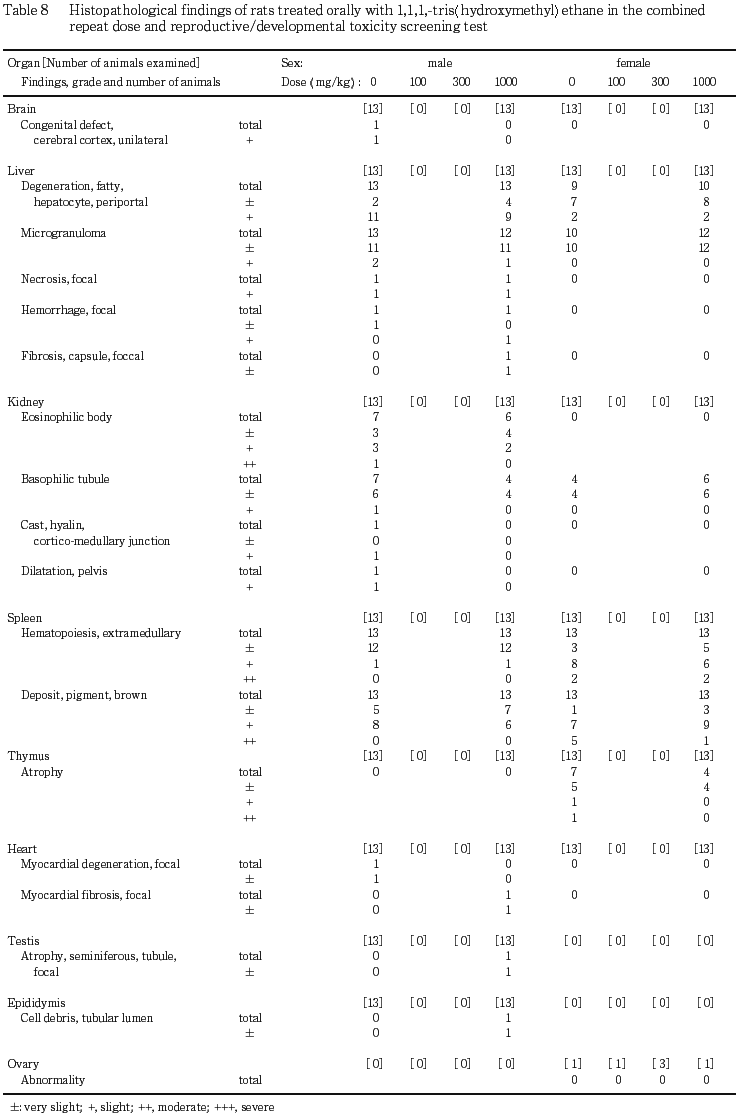
(5) 病理組織学検査所見(Table 8)
以下の所見が観察されたが,いずれの所見の頻度および程度も,1000 mg/kg 投与群と対照群との間で差は認められなかった.また,胸腺,副腎および膀胱には,異常は認められなかった.
(脳)
肉眼的に大脳皮質の一部に陥凹部が認められた対照群の動物の脳では,皮質の一側に先天性と考えられる欠損部が確認された.
(肝臓)
対照群および1000 mg/kg 投与群の全例に門脈周辺性の肝細胞の脂肪変性が,また,両投与群のほぼ全例に小肉芽腫が観察された.この他,対照群および1000 mg/kg 投与群の各1例に出血を伴う限局性の壊死巣が認められ,別の1000 mg/kg 投与群の例に被膜の限局性の線維化が観察された.
(腎臓)
対照群の7例,1000 mg/kg 投与群の6例に eosinophilic body が認められ,両群に好塩基性の尿細管がみられた.その他,対照群に腎盂の拡張,皮髄境界部の硝子円柱が観察された.
(心臓)
対照群および1000 mg/kg 投与群に限局性の心筋変性あるいは線維化がそれぞれ1例観察された.
(脾臓)
対照群および1000 mg/kg 投与群の全例に髄外造血および褐色色素の沈着が観察された.
(精巣および精巣上体)
1000 mg/kg 投与群の1例には,精巣に限局性の精細管の萎縮が,また精巣上体の管腔内には細胞残屑が観察された.
B. 雌〔解剖日:哺育4日,妊娠25日相当日(不妊例)〕
(1) 剖検所見
以下の所見が観察されたが,いずれも被験物質の用量に依存した変化ではなかった.
腎臓では,対照群の1例に腎盂の拡張が,300 mg/kg 投与群の1例に陥凹部が認められた.胸腺では,100 および 300 mg/kg 投与群の各1例に赤色化が,対照群の3例,被験物質投与群の各1例に小型化が認められた.その他,肺では,100 mg/kg 投与群に暗赤色化を伴う小型化が,腺胃では対照群に白色点,100 mg/kg 投与群に暗色点がそれぞれ1例みられた.
(2) 器官重量(Table 7)
300 mg/kg 投与群において剖検時の体重が対照群と比較して有意(p<0.05)に高い値を示したが,各器官の重量および比体重値には対照群と被験物質投与群との間で有意差は認められなかった.
(3) 病理組織学所見(Table 8)
以下の所見が観察されたが,いずれの所見の頻度および程度も,1000 mg/kg 投与群と対照群との間で差は認められなかった.また,脳,心臓,副腎,膀胱および不妊例の卵巣には異常は認められなかった.
(肝臓)
対照群および1000 mg/kg 投与群の多くの例に門脈周辺性の肝細胞の脂肪変性および小肉芽腫が観察された.
(腎臓)
対照群の4例,1000 mg/kg 投与群の6例に好塩基性の尿細管が観察された.
(脾臓)
対照群および1000 mg/kg 投与群の全例に髄外造血および褐色色素の沈着が観察された.
(胸腺)
対照群の7例,1000 mg/kg 投与群の4例に萎縮が観察された.
 .生殖発生毒性
.生殖発生毒性
1. 生殖学的検査所見
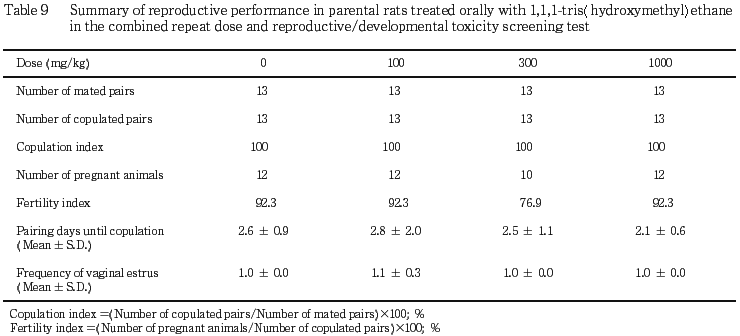
1) 交配成績(Table 9)
交尾率および同居開始から交尾成立までに要した日数ならびにその間に回帰した発情期の回数に,対照群と被験物質投与との間で有意差は認められなかった.受胎率については,300 mg/kg 投与群が低値の傾向を示したが,対照群との間に有意差は認められなかった.
2) 分娩および哺育状態
観察が可能であった動物については,分娩状態の異常は観察されなかった.
哺育状態の異常は,いずれの動物にも認められなかった.
3) 黄体数,着床数および着床率(Table 10)
妊娠黄体数,着床数および着床率に対照群と被験物質投与群の間で有意差は認められなかった.
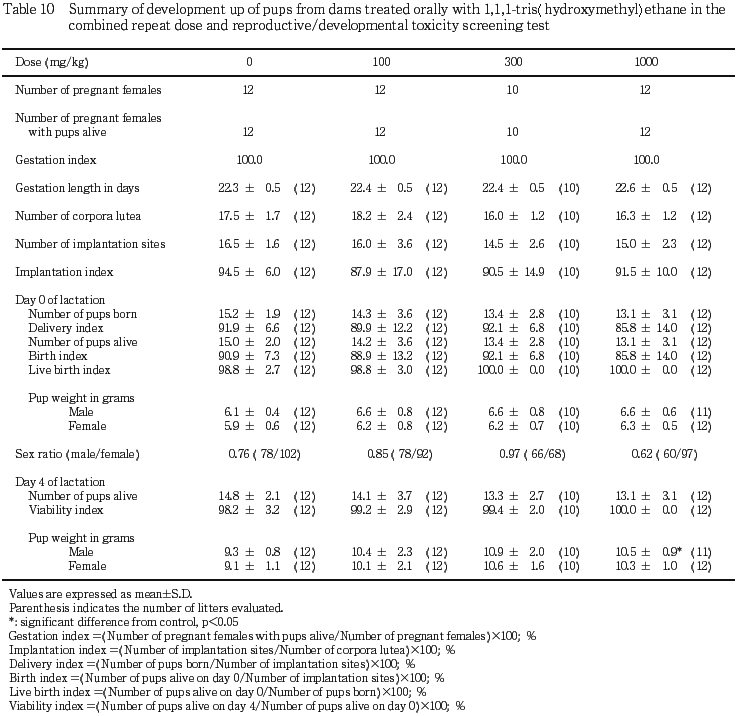
4) 出産率および妊娠期間(Table 10)
出産率および妊娠期間に対照群と被験物質投与群の間で有意差は認められなかった.
2. 出生児所見
1) 一般状態および生存性(Table 10)
一般状態に異常は認められず,出生率,および新生児の哺育4日の生存率ならびに性比についても対照群と被験物質投与群との間で有意差は認められなかった.
2) 体重(Table 10)
被験物質投与群の雌雄出生児の体重は,哺育0日および4日のいずれも対照群と比較して高値の傾向が認められ,1000 mg/kg 投与群の哺育4日における雄の体重については,対照群との間に有意差(p<0.05)も認められた.
3) 形態
哺育0日に実施した産児の外表観察では,いずれの動物にも異常は観察されなかった.
哺育4日における出生児の剖検においても,いずれの投与群の出生児にも異常は認められなかった.
死亡児の剖検でも,異常はいずれの投与群にも認められなかった.
考察
以上の試験成績から,雄については,一般状態ならびにその間に測定した体重および摂餌量に,被験物質投与による影響は認められなかった.また,投与期間終了後の剖検においても,器官重量,解剖所見,病理組織学検査所見のいずれにも被験物質投与による影響は認められなかった.血液学検査では,1000 mg/kg 投与群のヘマトクリット値がやや増加した.同群では,対照群との間に有意差はなかったが,赤血球数および平均赤血球容積が僅かずつ増加していることから,ヘマトクリット値の増加は,その算定の基礎となる測定値の僅かな増加が相加された結果であると考えられる.しかし,病理組織学検査および血液生化学検査において造血系の異常あるいは脱水に関連する腎機能の変化などは認められなかったことから,赤血球数および平均赤血球容積の僅かな増加は偶発的変化であると考えられる.血液生化学検査では,被験物質の用量に依存した変化として,総蛋白濃度,ナトリウム濃度,ならびに GPT および GOT 活性の上昇,ブドウ糖濃度およびカリウム濃度の低下が認められた.肝臓の重量および病理組織学所見のいずれにも肝臓障害を示唆する変化は認められなかったが,GPT および GOT 活性の上昇,ならびにブドウ糖濃度の低下は肝機能障害を疑わせる.従って,1,1,1-トリス(ヒドロキシメチル)エタン投与は肝障害を惹起する可能性があるものと推測される.総蛋白濃度およびナトリウム濃度の上昇ならびにカリウム濃度の低下については,数値の変動がごく僅かであることから,被験物質投与による影響は疑わしい.従って,雄に対する1,1,1-トリス(ヒドロキシメチル)エタンの反復投与毒性に関する無影響量は300 mg/kg/day であると推定される.
雌においても,一般状態ならびにその間に測定した摂餌量には,被験物質投与による影響は認められなかった.しかし,体重については,1000 mg/kg 投与群において妊娠期間中,とくに妊娠中期の体重増加が抑制された.妊娠期間中の体重増加は,胎児の数とその発育に負うところが大きい.しかし,1000 mg/kg 投与群において妊娠7〜14日あるいは妊娠0〜20日の体重増加量が低値であった動物の哺育0日の litter 重量あるいは産児数は,4匹しか分娩しなかった1例を除き,必ずしも低値の傾向は示していない.従って,1000 mg/kg 投与群における妊娠期間中の体重増加抑制は,胎児の数あるいは発育に起因した変化であるよりも,被験物質の母動物に対する直接的な影響である可能性が高いと考えられる.しかし,これは妊娠期間中のみの一過性の変化であると考えられる.
投与期間終了後の剖検では,器官重量,解剖所見,病理組織所見のいずれにも被験物質投与による影響は認められなかった.これらのことから,雌に対する1,1,1-トリス(ヒドロキシメチル)エタンの反復投与毒性に関する無影響量は300 mg/kg/day であると推定される.
投与動物の生殖能力については,いずれの投与群も全例の交尾が確認された.受胎率については,300 mg/kg 投与群がやや低い傾向を示したが,1000 mg/kg 投与群は対照群と同率であり,被験物質の投与量に依存した変化ではなかった.また,生殖器官の重量および形態にも異常は認められなかった.従って,1,1,1-トリス(ヒドロキシメチル)エタン投与は交尾および受胎能力に影響を及ぼさないものと考えられる.また,妊娠期間ならびに分娩および哺育観察の結果から,1,1,1-トリス(ヒドロキシメチル)エタン投与は分娩および哺育に影響を及ぼさないと考えられる.
発生毒性については,前述のように,1000 mg/kg 投与群には産児数の少ない litter が1例認められたが,この1例以外の産児数は12〜16匹と正常な値であった.また,産児数,分娩率および生児出産率のいずれにも,被験物質投与と対照群との間で有意差は認められず,形態異常を示す産児も観察されなかったことから,1000 mg/kg までの1,1,1-トリス(ヒドロキシメチル)エタンは,胎児の発生に影響を及ぼさないものと考えられる.出生児については,被験物質投与群の哺育0日および4日における雌雄体重が対照群と比較して高値の傾向を示し,1000 mg/kg 投与群では哺育4日における雄の体重に有意差が認められた.しかし,litter 重量については哺育0日および4日のいずれの時期も対照群と差のない値であったことから,出生児体重の増加傾向は,生児数の僅かな変化に起因した偶発的変化であると考えられる.出生率,および新生児の哺育4日の生存率には被験物質投与群と対照群との間で有意差が認められなかった.これらのことから,1000 mg/kg までの1,1,1-トリス(ヒドロキシメチル)エタン投与は出生児の発育に影響を及ぼさないものと考えられ,1,1,1-トリス(ヒドロキシメチル)エタンの生殖発生毒性に関する無影響量は1000 mg/kg/day であると推定される.
文献
| 1) | 1,1,1-トリス(ヒドロキシメチル)エタンのラットを用いる単回投与毒性試験最終報告書,(財)食品薬品安全センター秦野研究所(1998). |
| 2) | 丹後俊郎,"医学への統計学,"古川俊之監修,朝倉書店,東京,1985. |
| 3) | 石居 進,"生物統計学入門,"培風館,東京,1992. |
| 4) | 佐久間昭,"薬効評価-計画と解析,"東京大学出版会,東京,1977. |
| 5) | C. W. Dunnett, Biometrics, 20, 482(1964). |
| 6) | H. Scheff , Biometrika, 40, 87(1953). , Biometrika, 40, 87(1953). |
| 7) | W. H. Kruskal and W. A. Wallis, J. Amer. Statist. Assoc., 47, 583(1952). |
| 連絡先 |
| 試験責任者: | 長尾哲二 |
| 試験担当者: | 代田眞理子,松本亜紀,神谷幸男,加藤博康 |
| (財)食品薬品安全センター秦野研究所 |
| 〒257 神奈川県秦野市落合729-5 |
| Tel 0463-82-4751 | Fax 0463-82-9627 | |
| Correspondence |
| Authors: | Tetsuji Nagao(Study director)
Mariko Shirota, Aki Matsumoto,
Yukio Kamiya, Hiroyasu Ktoh |
| Hatano Research Institute, Food and Drug Safety Center |
| 729-5 Ochiai, Hadano, Kanagawa, 257, Japan |
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |
 )に収容し,床敷として紙パルプ製チップ(ALPHA-dri,加商
)に収容し,床敷として紙パルプ製チップ(ALPHA-dri,加商 )を適宜供給した.
)を適宜供給した. から入手した.本被験物質〔ロット番号:80913; 純度:99.0 wt%( 主な不純物:ビス(2,2-ジメチロールプロピル)エーテル 0.1%,ビス(2,2-ジメチロール)プロポキシメタン0.3 %,ペンタエリスリトール0.3 %,水分0.14 %)は,使用時まで室温で保管し,日局注射用水〔光製薬
から入手した.本被験物質〔ロット番号:80913; 純度:99.0 wt%( 主な不純物:ビス(2,2-ジメチロールプロピル)エーテル 0.1%,ビス(2,2-ジメチロール)プロポキシメタン0.3 %,ペンタエリスリトール0.3 %,水分0.14 %)は,使用時まで室温で保管し,日局注射用水〔光製薬 ,製造番号:9609CA〕に溶解して,いずれの用量においても1回の投与液量が 5 mL/kg 体重になるように含量を調整した.調製液は,冷蔵保管し,調製後7日以内に投与した.調製液中の被験物質は,冷蔵条件下で少なくとも8日間安定である1).また,本試験において調製された投与検体には,ほぼ所定量の被験物質が含有されていたことを確認した.
,製造番号:9609CA〕に溶解して,いずれの用量においても1回の投与液量が 5 mL/kg 体重になるように含量を調整した.調製液は,冷蔵保管し,調製後7日以内に投与した.調製液中の被験物質は,冷蔵条件下で少なくとも8日間安定である1).また,本試験において調製された投与検体には,ほぼ所定量の被験物質が含有されていたことを確認した. 日野飼育センター生産の Sprague-Dawley 系ラット(Crj:CD,SPF)を使用した.購入した動物は,入荷後6日間,馴化と検疫を兼ねて予備飼育して試験に供した〔群分け時体重範囲:雄296.5〜330.7 g,雌195.0〜223.1 g〕.
日野飼育センター生産の Sprague-Dawley 系ラット(Crj:CD,SPF)を使用した.購入した動物は,入荷後6日間,馴化と検疫を兼ねて予備飼育して試験に供した〔群分け時体重範囲:雄296.5〜330.7 g,雌195.0〜223.1 g〕. )に収容し,床敷として紙パルプ製チップ(ALPHA-dri,加商
)に収容し,床敷として紙パルプ製チップ(ALPHA-dri,加商 )を適宜供給した.
)を適宜供給した. 法),アルカリフォスファターゼ活性(パラニトロフェニルリン酸基質法),GOT 活性(SSCC法),GPT 活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットS シリーズ),カルシウム濃度(OCPC 法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法),A/G 比(計算)について分析した.
法),アルカリフォスファターゼ活性(パラニトロフェニルリン酸基質法),GOT 活性(SSCC法),GPT 活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットS シリーズ),カルシウム濃度(OCPC 法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法),A/G 比(計算)について分析した. 法7)により対照群と被験物質投与群との間で平均値の差の検定を行った.分散が一様でなかった場合,および分散が0となる群が存在するときは,Kruskal-Wallis 順位検定7)を行い,群間に有意性が認められた場合に,対照群と被験物質投与群との差について Dunnett 法5)あるいは Scheff
法7)により対照群と被験物質投与群との間で平均値の差の検定を行った.分散が一様でなかった場合,および分散が0となる群が存在するときは,Kruskal-Wallis 順位検定7)を行い,群間に有意性が認められた場合に,対照群と被験物質投与群との差について Dunnett 法5)あるいは Scheff 法6)の検定を行った.有意水準は5%および1%とした.
法6)の検定を行った.有意水準は5%および1%とした. .反復投与毒性(親動物所見)
.反復投与毒性(親動物所見)







 .生殖発生毒性
.生殖発生毒性

 , Biometrika, 40, 87(1953).
, Biometrika, 40, 87(1953).