以上の結果より,ジシクロペンタジエンの反復投与毒性に関する無影響量は雄が4 mg/kg/day未満,雌が20 mg/kg/day,生殖発生毒性に関する無影響量は親動物に対して雄が100 mg/kg/day,雌が20 mg/kg/day,児動物に対しては20 mg/kg/dayと考えられる.
検疫・馴化期間を含めた全飼育期間中,温度20〜25℃,湿度40〜70 %R.H.,換気約12回/時,照明12時間/日(7:00〜19:00)に自動調節された飼育室を使用した.動物は実験動物用床敷(ベータチップ:日本チャールス・リバー)を敷いたポリカーボネート製ケージに,1ケージあたり投与開始後は1匹,交配期間中は雌雄各1匹,哺育期間は1腹で収容し, 飼育した.
動物には,オートクレーブ滅菌した実験動物用固型飼料(CRF-1:オリエンタル酵母工業)および5 μmのフィルター濾過後,紫外線照射した水道水をそれぞれ自由摂取させた.
投与期間は,雌雄とも交配前14日間,交配期間中,および雄は計画殺前日までの計44日間,雌は交尾成立後分娩を経て哺育3日までとし,オリーブ油に溶解させた被験物質を,胃管を用いて1日1回,午前中に強制経口投与した.投与液量は5 ml/kgとし,至近測定日の体重を基に算出した.投与液は調製後投与に供するまで冷暗所に保存した.また,投与開始前に投与液の安定性および濃度を確認した.
 法),総ビリルビン(Jendrassik改良法),総蛋白(Biuret法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(O-CPC法),無機リン(UV法),ナトリウム,カリウム,クロライド(イオン選択電極法)を自動分析装置(日立736-10形:日立製作所)により測定した.
法),総ビリルビン(Jendrassik改良法),総蛋白(Biuret法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(O-CPC法),無機リン(UV法),ナトリウム,カリウム,クロライド(イオン選択電極法)を自動分析装置(日立736-10形:日立製作所)により測定した.
哺育4日の解剖時に卵巣,子宮を摘出して黄体数および着床数を検査した.交尾確認後25日を経ても分娩しない雌は剖検し,肉眼的に着床が認められない動物の子宮については,2%KOH水溶液に浸漬し,着床の有無を確認した.これらの結果から,妊娠期間(妊娠0日から出産が確認された日までの期間),出産率([生児出産雌数/受胎雌数]×100),着床率([着床数/黄体数]×100),分娩率([総出産児数/着床数]×100)を算出した.
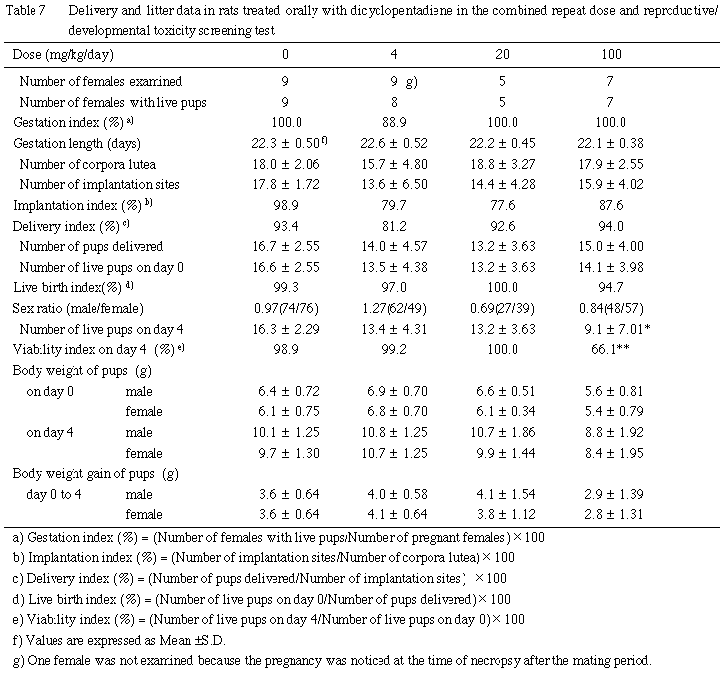
哺育0日に出産児数,出産生児数,死産児数,性別および外表異常の有無を検査した.その後,一般状態,死亡の有無を毎日観察した.死亡動物は食殺等で検査に耐えないものを除き,10 %リン酸緩衝中性ホルマリン液に浸漬・固定後,実体顕微鏡下で剖検した.哺育0および4日の生存児数から出生率([出産生児数/総出産児数]×100),4日生存率([哺育4日生児数/出産生児数]×100)を算出した.
(2)体重
哺育0日および4日に1腹毎に雌雄単位でまとめて測定し,それぞれの平均値を算出した.また,哺育0日の体重を基準に体重増加量を算出した.
 法またはScheff
法またはScheff 型により多重比較を行った.ただし,下記 * 印の項目については,Kruskal-Wallisの検定から行った.計数データはFisherの直接確率法により検定した.有意水準は5 %以下とした.新生児に関するデータについては,各母動物毎に算出した平均値を統計単位とした.以下に検定の対象となる項目を示す.
型により多重比較を行った.ただし,下記 * 印の項目については,Kruskal-Wallisの検定から行った.計数データはFisherの直接確率法により検定した.有意水準は5 %以下とした.新生児に関するデータについては,各母動物毎に算出した平均値を統計単位とした.以下に検定の対象となる項目を示す.
死亡した100 mg/kg群の雌の2例に認められた主要所見は,肺のうっ血,副腎の腫大,胸腺の出血,胃粘膜面の出血であった.
肝臓では単細胞壊死が100 mg/kg群の雄に認められた.壊死に陥り好酸性を示す肝細胞が,肝小葉内に散在性に認められた.
腎臓では尿細管上皮の硝子滴の増加が4 mg/kg以上の群の雄に認められた.さらに,20 mg/kg以上の群には尿細管上皮の好塩基性変化が認められ,有糸分裂像も散見された.
副腎では束状帯における大小の脂肪滴の増加が20 mg/kg以上の群の雄および100 mg/kg群の雌に認められた.
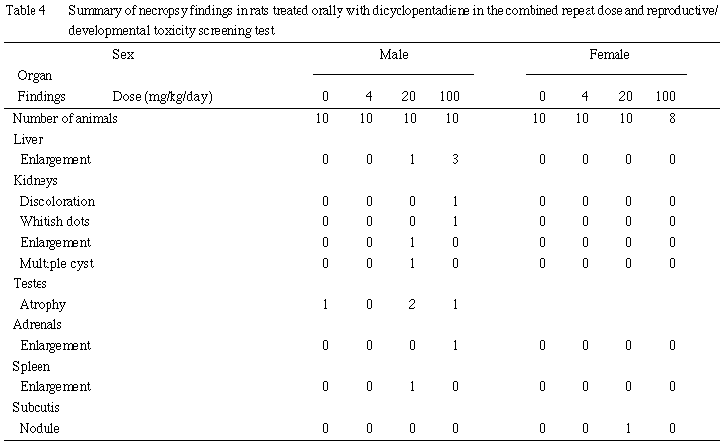
その他に認められた組織変化については,いずれも少数例であり,その発現状況から非特異的な偶発病変と考えられた.なお,未交尾および非妊娠雌の卵巣には組織変化は認められなかった.また,20 mg/kg群の雄1例の腫大した肝臓には多房性胆嚢性のう胞が認められ,腫大の原因と考えられたが,本所見は100 mg/kg群では認められなかったことから,被験物質とは関連のない変化と判断した.
死亡した雌の2例に共通してみられた所見は,肝臓のうっ血,うっ血性肺水腫,副腎束状帯の出血を伴う壊死およびうっ血,胸腺のうっ血およびリンパ球の核崩壊であった.また, 1例に胃粘膜の出血,肝臓の小葉中間帯の出血を伴う壊死,肺の出血および胸腺の水腫性肥厚,脾臓の萎縮およびリンパ球の核崩壊が認められた.

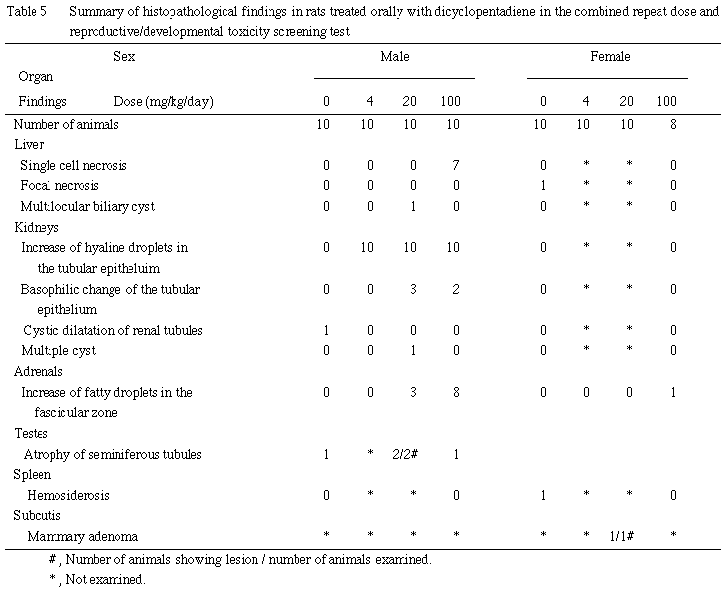
哺育期間の観察において,100 mg/kg群の母動物2例で哺育1日に全新生児死亡が観察された.これらのうち1例では新生児への授乳が認められず,いずれの母動物も哺育1日には多数の新生児を食殺していた.その他の母動物には異常は認められなかった.
100 mg/kg群で哺育4日の生存児数および4日生存率に有意な低下が認められた.これは,100 mg/kg群では2腹の新生児全例が死亡したことに加えて, 他の腹でも生後の死亡が散見されたことに起因したものであった.出産児数,出産生児数,出生率および性比には対照群と被験物質投与群との間に有意な差は認められなかった.
(2)新生児の観察
外表異常については,無尾が20 mg/kg群で1例観察されたのみであった.生後の一般状態には各群とも異常は認められなかった.
(3)体重(Table 7)
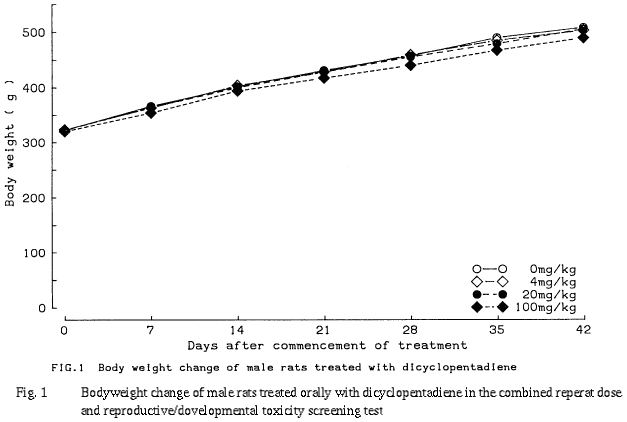
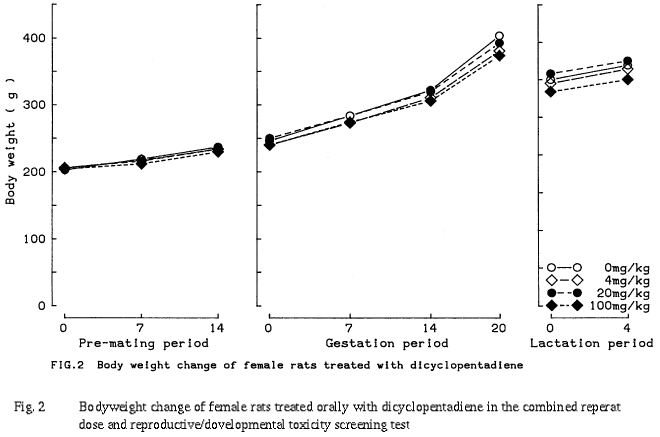
100 mg/kg群において,哺育0日および4日の体重,ならびにその間の体重増加量が,有意差は認められなかったものの,雌雄とも若干低値を示した.
(4)剖検
生存動物では,肝横隔膜面結節が4 mg/kg群で1例,腎盂拡張および胸腺頸部残留が 20 mg/kg群で各1例に認められた.また,死亡動物では,顎下の浮腫が対照群で1例,腎盂拡張が100 mg/kg群で1例観察された.いずれも極少数の発現であったことから,被験物質に起因したものではないと判断した.
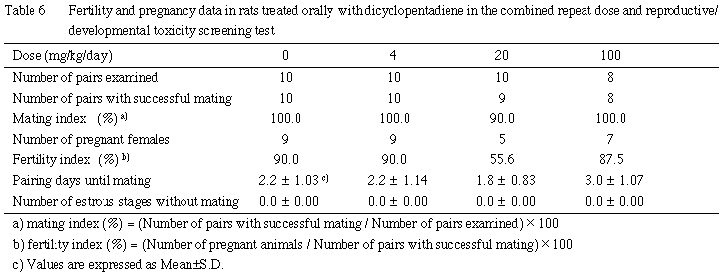
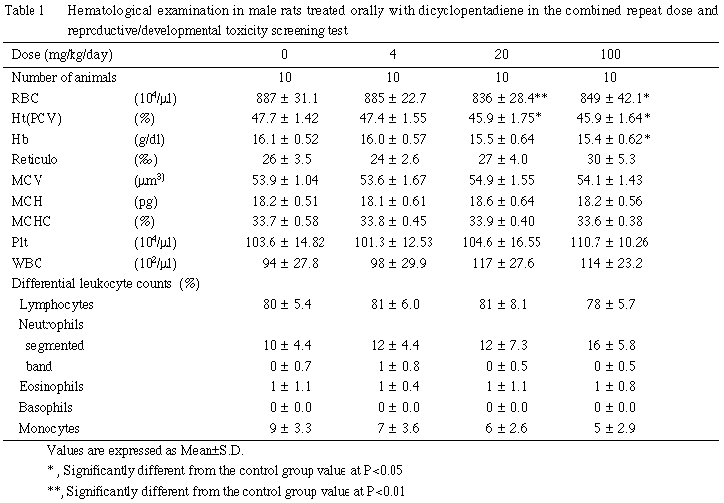
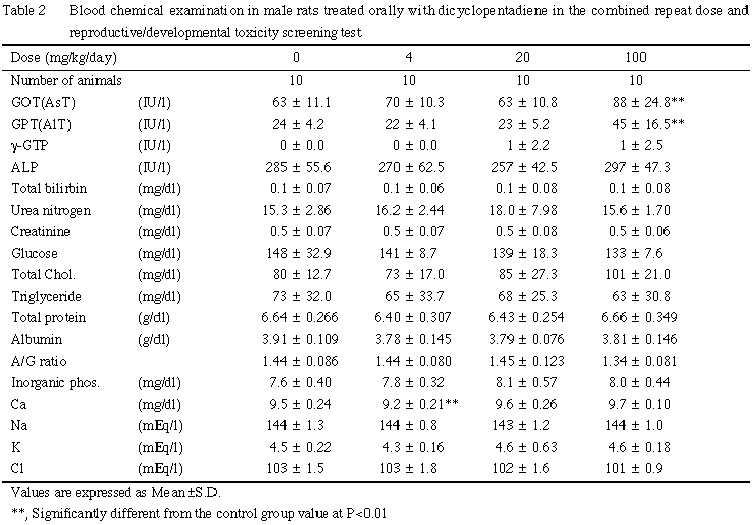
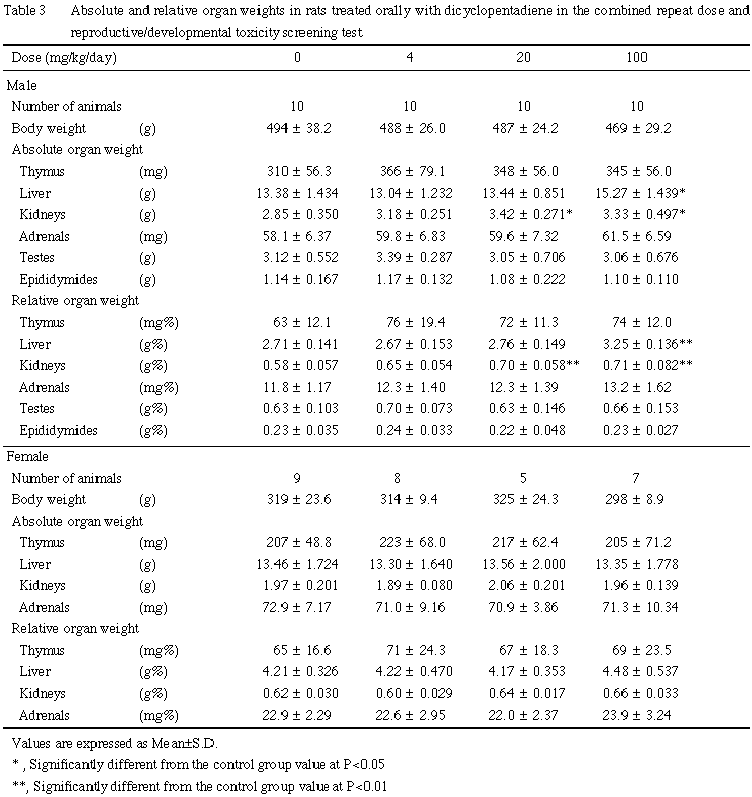
肝臓への影響として,肝臓重量の増加および組織変化が100 mg/kg群の雄で認められた.肝臓の単細胞壊死は細胞障害性の変化であり2, 3),血液生化学検査において認められたGOTおよびGPTの上昇も被験物質による肝細胞への障害を裏付けるものと考えられる.
腎臓への影響として,組織変化が4 mg/kg以上の群で,また腎臓重量の増加が20 mg/kg以上の群で雄のみに認められた.腎臓の尿細管上皮に認められた硝子滴の増加は雄ラットに特異的な変化であり,炭化水素化合物の投与により生じることが知られている4, 5).硝子滴が過剰に沈着すると上皮は変性・壊死・脱落を生じ,その反応として好塩基性の再生性上皮が出現する4, 5).本試験においても,これと同様の一連の変化が認められたことから,他の炭化水素化合物と同様の現象が生じたものと考えられる.本変化は低用量の4 mg/kg群でも認められたが,血液生化学検査においては100 mg/kg群でも腎機能障害を示す変化は認められなかった.なお,被験物質は吸入暴露でも雄の腎臓に同様な変化を起こし1, 6),その変化は投与中止により回復することが報告されている6).また,雄ラットの尿細管上皮への硝子滴の沈着については,投与物質あるいはその代謝物がα2u-グロブリンと結合し,ライソゾームの加水分解に対し抵抗性が大きい硝子滴を形成するためと解釈されているが7, 8),雌ラットおよび他の動物では発現しないこと,またヒトではこの低分子蛋白はみられないことなどから,ヒトの腎臓への影響との関連は否定的である9).
その他,副腎束状帯の脂肪滴の増加が 20 mg/kg以上の群の雄,100 mg/kg群の雌で認められた.本変化は束状帯細胞への直接作用あるいはステロイド合成阻害作用により生じるものであるが10, 11),本試験では細胞障害像あるいは本変化と関係すると思われる血液生化学検査値の変動は認められておらず,毒性学的意義は不明であった.
投与直後の一過性の流涎が,全被験物質投与群の雄および100 mg/kg群の雌で観察されたが,ほとんどは断続的で経時的な増強もみられなかったことから,被験物質が有する刺激性1) あるいは物理的性状に起因したもので,毒性学的意義に乏しい変化と判断した.
新生児の検査において,出産児数,出産生児数,性比および出生率には被験物質の影響は認められなかったが,100 mg/kg群では4日生存率の低下が認められ,さらに低体重および体重増加抑制の傾向が認められた.4日生存率の低下については,全新生児が死亡した以外の腹でも死亡児が散見されたことから,母動物の哺育機能障害に加えて,新生児側の要因である可能性も考えられる.一般状態,外表検査および剖検では被験物質に起因する変化は認められなかった.
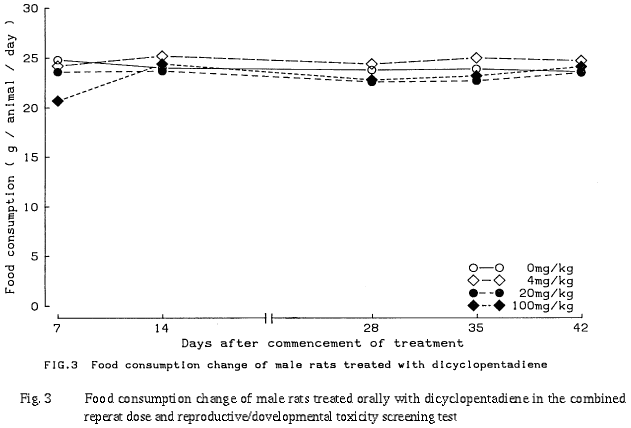
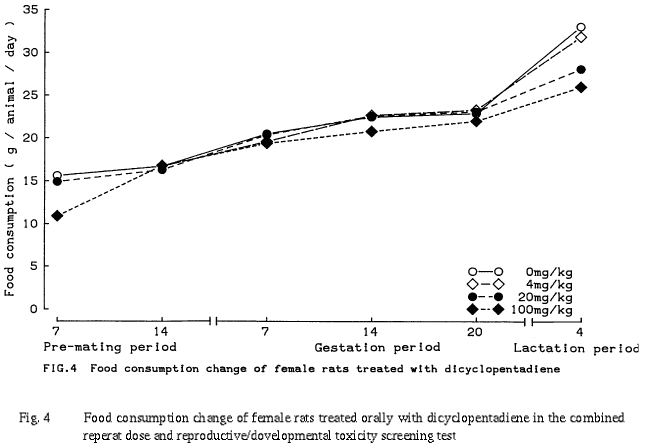
以上のように,本試験では反復投与による影響として,4 mg/kg以上の群で雄の腎臓に,また 20 mg/kg以上の群で雄の副腎に組織変化が認められた.さらに,100 mg/kg群では雌雄の体重増加抑制傾向と摂餌量減少,雌の死亡,雄の肝臓および雌の副腎に組織変化が認められた.生殖・発生に及ぼす影響として,親動物の生殖機能および分娩には異常は認められなかったが,100 mg/kg群で母動物の哺育機能および新生児の発育への影響を示唆する変化が認められた.従って,本試験条件下における反復投与毒性に関する無影響量は雄が4 mg/kg/day未満,雌が20 mg/kg/day,生殖発生毒性に関する無影響量は親動物に対して雄が100 mg/kg/day,雌が20 mg/kg/day,児動物に対しては20 mg/kg/dayと考えられる.
| 1) | E.R. Kinkead et al.,Toxicol.Appl.Pharmacol., 20, 552-561(1971). |
| 2) | C. Gopinath et al., "Atlas of experimental toxicological pathology," MTP Press Limited, Lancaster, 1987, pp.43-60. |
| 3) | 榎本 眞, 赤崎兼義, "毒性病理学," ソフトサイエンス社, 東京, 1987, pp. 109-159. |
| 4) | P. Greaves, "Histology of preclinical toxicity studies," Elsevier, Amsterdam, 1990, pp.532-538. |
| 5) | 渡辺満利, "毒性病理学(前川昭彦,林裕造 編)," 地人書館, 東京, 1991, pp. 267-293. |
| 6) | C. Bevan et al.,Toxicol.Ind.Health, 8, 353-367(1990). |
| 7) | L.D. Lehman-McKeeman et al., Toxicol. Appl. Pharmacol., 103, 539-548(1990). |
| 8) | J.A. Swenberg et al.,Toxicol.Appl.Pharmacol., 97, 35-46(1989). |
| 9) | C.L. Alden, Toxicol. Pathology, 14, 109-111(1986). |
| 10) | 榎本眞, 赤崎兼義, "毒性病理学," ソフトサイエンス社, 東京, 1987, pp. 211-224. |
| 11) | C. Gopinath et al., "Atlas of experimental toxicological pathology," MTP Press Limited, Lancaster, 1987, pp. 104-108. |
| 連絡先 | |||
| 試験責任者: | 松浦郁夫 | ||
| 試験担当者: | 岩井真弓,土谷 稔,涌生ゆみ,豊田直人,高野克代 | ||
| (株)三菱化学安全科学研究所鹿島研究所 | |||
| 〒 314-02 茨城県鹿島郡波崎町砂山14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence | |||
| Authors: | Ikuo Matsuura (Study director) Mayumi Iwai, Minoru Tsuchitani, Yumi Wako, Naoto Toyota, Katsuyo Takano | ||
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory | |||
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-02 Japan | |||
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | ||