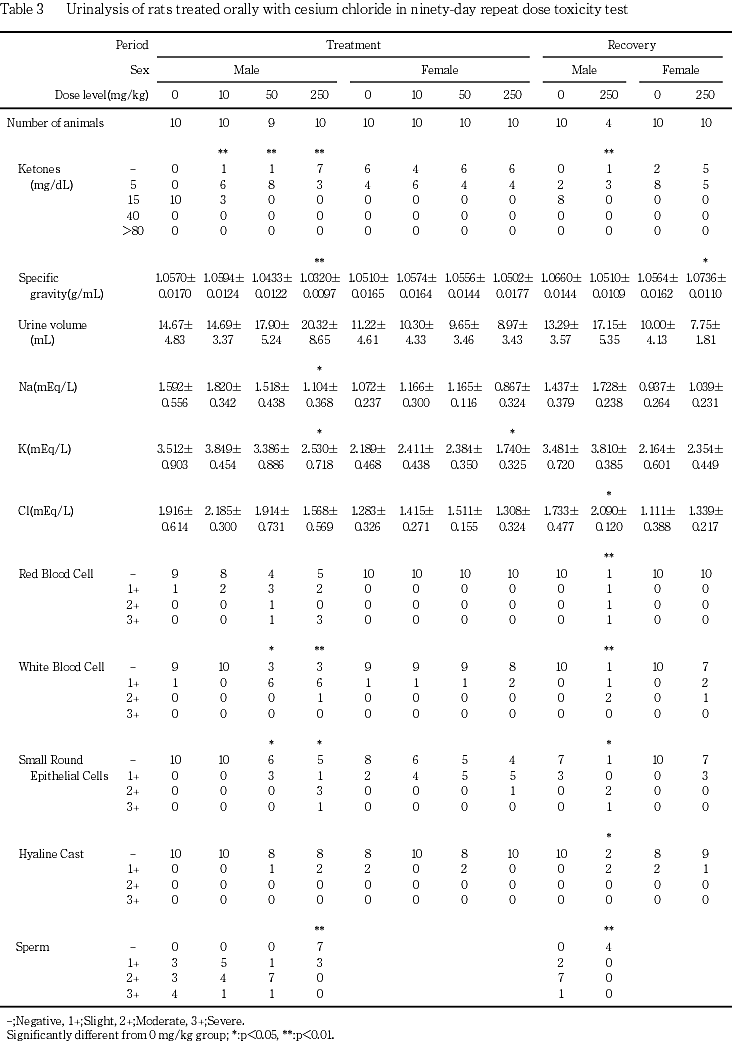
今回,塩化セシウムを0,10,50および250 mg/kgの用量でSD系ラットの雌雄に90日間反復経口投与し,その毒性について検討した.対照群および250 mg/kg群については28日間回復群を設けた.
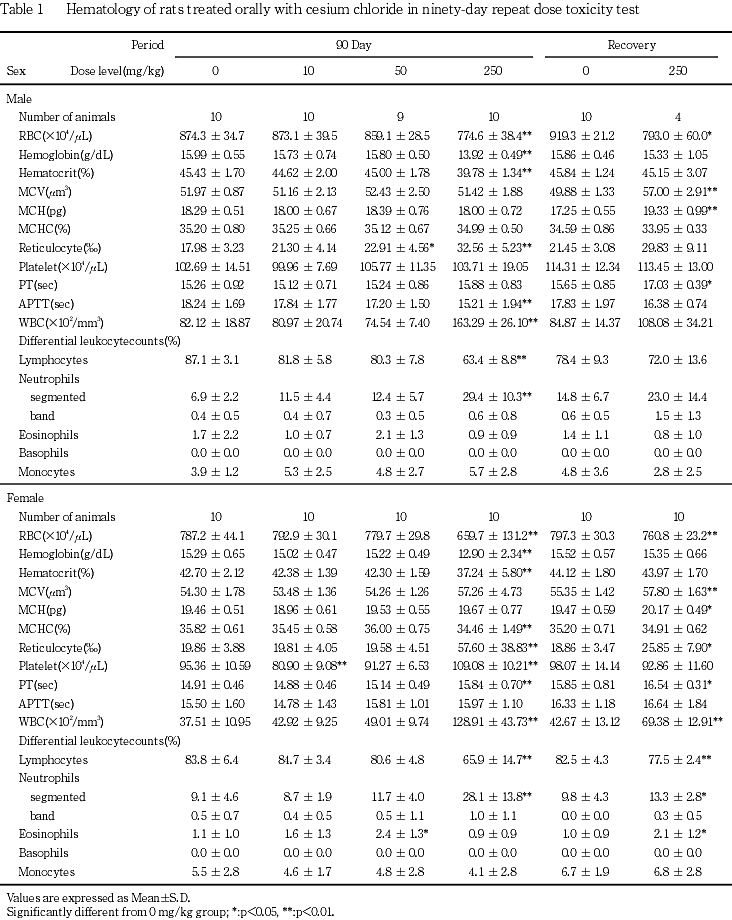
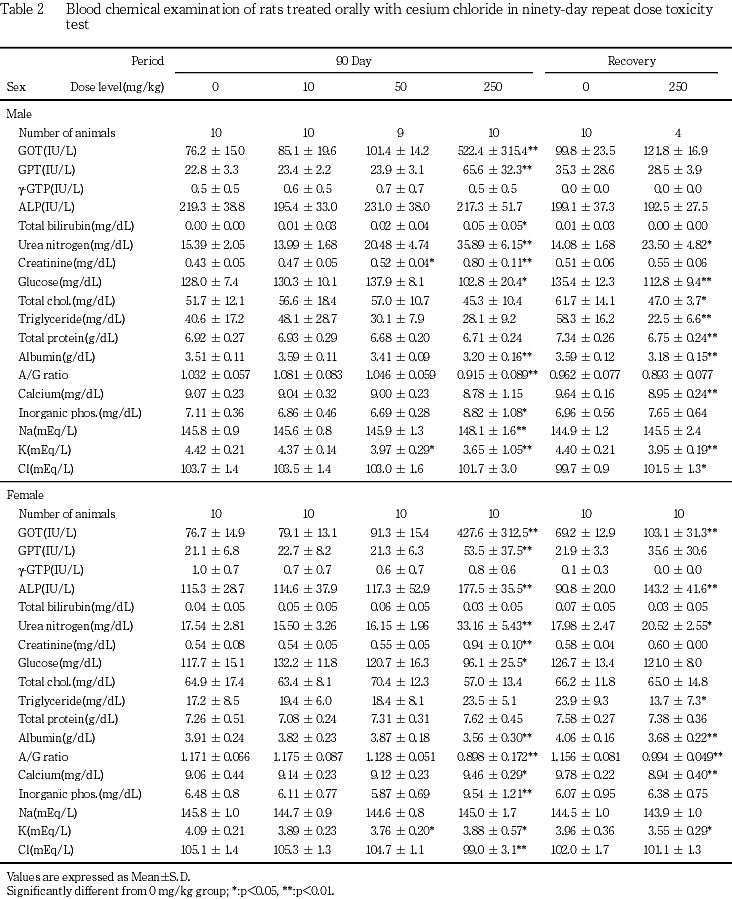
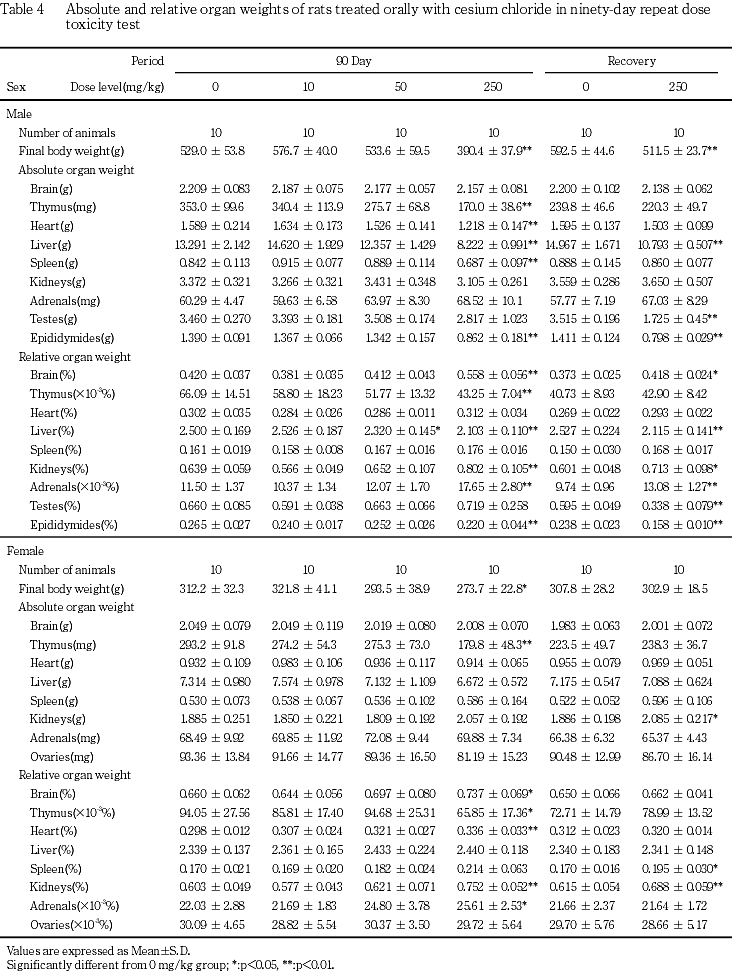
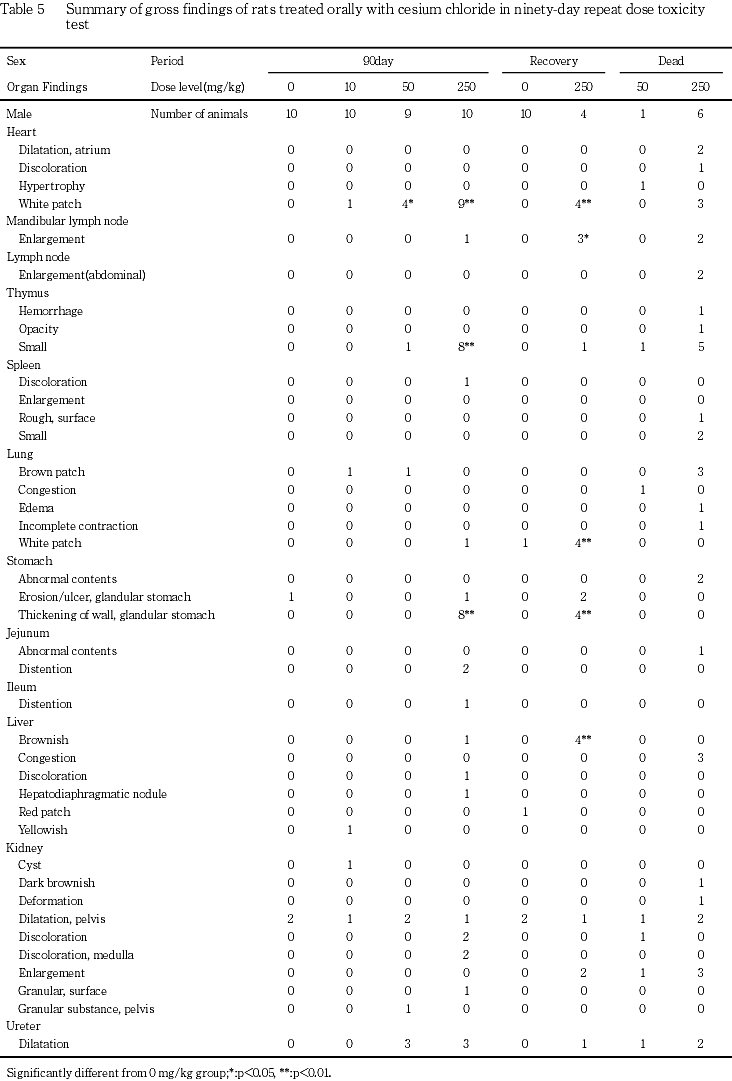
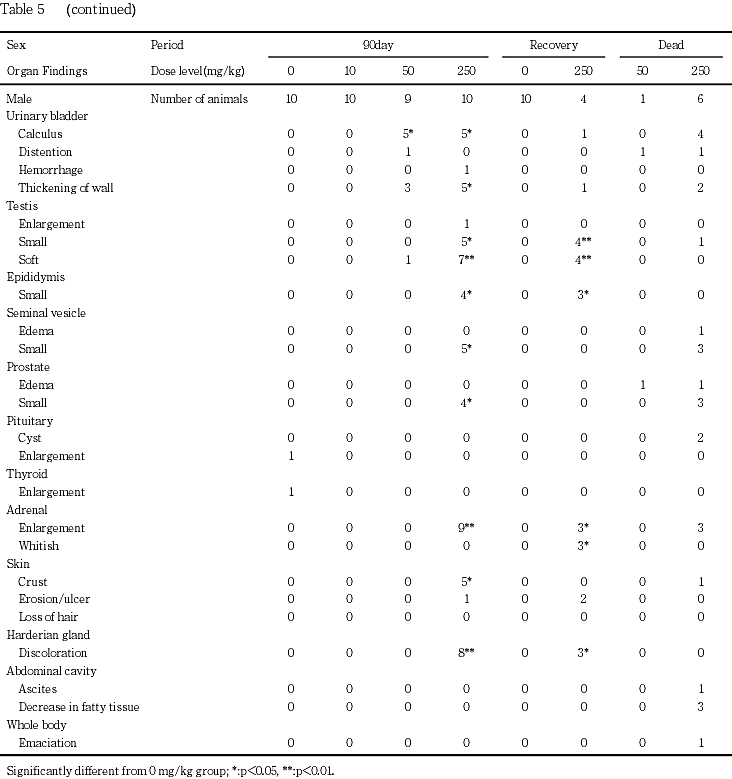
250mg/kg群では,易刺激性,痙攣と洗顔行動および痂皮,一過性の自発運動亢進等の症状が観察され,雄で死亡あるいは瀕死期解剖動物が発現した.体重と摂餌量の低値および摂水量の高値が認められた.血液学的検査で,赤血球数,ヘモグロビン濃度,ヘマトクリット値および平均赤血球血色素濃度の低値,網状赤血球率と血小板数の高値およびプロトロンビン時間の延長,活性化部分トロンボプラスチン時間の短縮,白血球数の高値と白血球百分比のリンパ球比の低値と分葉核好中球比の高値が認められた.血液生化学検査で,AST(GOT),ALT(GPT),アルカリフォスファターゼ,総ビリルビン,尿素窒素,クレアチニン,カルシウム,無機リンとナトリウムの高値およびグルコース,アルブミン,A/G比,カリウムとクロールの低値が認められた.尿検査で,尿比重,ナトリウムとカリウムの低値,尿沈渣中の白血球と小円形上皮細胞の高値,精子数の低値,尿潜血の増強,尿沈渣中の六角板状結晶の出現が認められた.器官重量で,胸腺,心臓,肝臓,脾臓および精巣上体の絶対重量の低値,脳,心臓,腎臓および副腎の相対重量の高値と胸腺,肝臓および精巣上体の相対重量の低値が認められた.剖検で,心臓の白色斑の増強,下顎リンパ節の腫大,胸腺の小型化,脾臓の褪色と腫大,腺胃壁の肥厚,小腸の膨満,肝臓の褐色化と褪色,腎臓の褪色,髄質外帯の褪色と表面顆粒状化,膀胱の結石,壁の肥厚,膨満と出血,尿管の拡張,精巣の腫大,小型化と軟化,精巣上体,前立腺および精嚢の小型化,副腎の腫大と白色化,皮膚の痂皮,びらん/潰瘍あるいは脱毛およびハーダー腺の褪色が認められた.病理組織学的検査では,限局性の心筋変性の増強,下顎リンパ節の形質細胞過形成,胸腺の萎縮の増強,脾臓の赤脾髄の萎縮と髄外造血の増強,骨髄の顆粒球系造血の亢進,肺の泡沫細胞集簇の増強,腺胃粘膜のびまん性過形成と水腫,腺胃粘膜の限局性炎症性細胞浸潤とびらんの増強,膵腺房細胞様細胞の出現,胃腺の拡張,十二指腸の粘膜上皮の肥大,下顎腺の腺房萎縮と導管上皮の顆粒の減少,舌下腺の腺房萎縮,肝臓の肝細胞萎縮と髄外造血,膵臓のびまん性の腺房萎縮,腎臓の好塩基性尿細管の増強,皮質遠位尿細管上皮の肥大,髄質外帯の空胞化および再生像を伴う遠位尿細管上皮の腫大,腎盂内結晶物,腎盂粘膜上皮の過形成および腎盂炎の増強,腎盂腎炎,尿管の拡張と粘膜上皮の過形成,膀胱の粘膜移行上皮の過形成と出血,精細管萎縮と精細管拡張,精巣上体の精子の減数,下垂体の中間葉細胞の肥大,甲状腺の濾胞拡張の増強,上皮小体の主細胞の肥大,副腎の髄外造血と束状帯細胞の肥大および球状帯細胞の脂肪滴増加,坐骨神経の変性の増強,皮膚の潰瘍,痂皮,びらんおよび限局性の炎症性細胞浸潤,大腿筋と外肋間筋の変性が,骨梁の減少,ハーダー腺の腺房細胞のびまん性肥大が認められた.
50 mg/kg群では,一般状態観察で易刺激性が認められ,雄で瀕死期解剖動物が発現した.また,摂水量の高値,網状赤血球率の高値,クレアチニンの高値,カリウムの低値,尿沈渣中の白血球と小円形上皮細胞の高値,尿潜血の増強,尿沈渣中の六角板状結晶の出現,肝臓の相対重量の低値,心臓の白色斑の増強,胸腺の小型化,腎盂内顆粒状物(結石),膀胱の結石,壁の肥厚と膨満,尿管の拡張,限局性の心筋変性の増強,骨髄の顆粒球系造血の亢進,髄質外帯の空胞化および再生像を伴う遠位尿細管上皮の腫大,腎盂内結晶物,腎盂粘膜上皮の過形成および腎盂炎の増強,尿管の拡張と粘膜上皮の過形成,膀胱の粘膜移行上皮の過形成,下垂体の中間葉細胞の肥大,副腎の球状帯細胞の脂肪滴増加,外肋間筋の変性およびハーダー腺の腺房細胞のびまん性肥大が認められた.
10 mg/kg群では,限局性の心筋変性の増強が雄で認められた.
投与期間中に被験物質投与に起因すると考えられる上記変化は,投与を止めることにより概ね軽減あるいは回復していたが,一部の変化については28日間の休薬期間では十分な回復性がみられなかった.
以上の結果から,本試験条件下における塩化セシウムの無影響量(NOEL)は雄が10 mg/kg未満,雌が10 mg/kgと判断した.
検疫・馴化期間を含めた全飼育期間中,温度22±2℃(目標値),相対湿度55±15 %(目標値),換気約12回/時,照明12時間/日(7:00-19:00)に自動調節した飼育室を使用した.動物は,実験動物用床敷(ベータチップ:日本チャールス・リバー(株))を敷いたポリカーボネート製ケージに1ケージあたり2匹で収容し飼育した.
動物には,実験動物用固型飼料(MF:オリエンタル酵母工業(株))および5 μmのフィルター濾過後,紫外線照射した水道水を,それぞれ自由に摂取させた.
 法),グルコース(GlcK-G6PDH法),総コレステロール(CES-CO-POD法),トリグリセライド(LPL-GK-G3PO-POD法),総蛋白(Biuret法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(OCPC法),無機リン(PNP-XOD-POD法),ナトリウム,カリウム,クロール(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
法),グルコース(GlcK-G6PDH法),総コレステロール(CES-CO-POD法),トリグリセライド(LPL-GK-G3PO-POD法),総蛋白(Biuret法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(OCPC法),無機リン(PNP-XOD-POD法),ナトリウム,カリウム,クロール(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
また,全例の上記器官に加え,脊髄(頸部,胸部,腰部),下垂体,甲状腺・上皮小体,気管と肺,大動脈,唾液腺,膵臓,前立腺,精嚢,子宮,膣,皮膚,食道,胃,十二指腸,空腸,回腸,盲腸,結腸,直腸,膀胱,腸間膜リンパ節,下顎リンパ節,乳腺(雌),大腿筋,坐骨神経,胸骨(骨髄を含む),大腿骨(関節面を含む),眼球,ハーダー腺,外涙腺,肉眼的異常部位を採取し,10 %中性リン酸緩衝ホルマリン液で固定し,保存した.ただし,精巣と精巣上体はブアン液で,死亡動物以外の眼球とハーダー腺はダビドソン液で固定した.
病理組織学検査の実施状況を以下に示す.なお,採取した器官・組織は常法に従ってヘマトキシリン・エオジン染色標本を作製し,鏡検した.
(1)死亡および瀕死期解剖動物を含む全群の全例について検査した器官・組織
雌雄の心臓,下顎リンパ節,胸腺,脾臓,骨髄(大腿骨,胸骨),肺,胃,十二指腸,下顎腺,舌下腺,肝臓,膵臓,腎臓,下垂体,甲状腺,上皮小体,副腎,坐骨神経,大腿筋,外肋間筋,大腿骨,胸骨およびハーダー腺.雄の精巣,精巣上体,尿管および膀胱.
(2)投与期間終了後解剖動物の対照群および250 mg/kg群の動物についてのみ検査した器官・組織
雌雄の大動脈,腸間膜リンパ節,気管,食道,空腸,回腸,盲腸,結腸,直腸,脳,脊髄,皮膚(腹部),眼球および外涙腺,精嚢および前立腺,雌の膀胱,卵巣,子宮,膣,乳腺.
(3)死亡および瀕死期解剖動物を含む全群の雌雄でみられた肉眼的異常部位
250 mg/kg群では,痙攣が雄で第32日と第69日以降,雌で第63日以降に発現した.また,易刺激性が雄で第31日以降および雌で第35日以降に認められた.その他,洗顔行動や口角部,鼻周囲,頸背部あるいは頭部などの皮膚の痂皮あるいはびらんが雌雄で,一過性の自発運動の亢進が雌で認められた.同群の死亡・瀕死期解剖動物では,死亡あるいは解剖前に側臥位,自発運動の減少,呼吸不整,体温低下,立毛,蒼白(全身性),貧血,眼瞼下垂,肛門周囲の汚れ,円背位,鼻腔周囲の汚れおよび流涎も認められた.回復期間には,易刺激性,皮膚の痂皮あるいは潰瘍が雌雄で認められた.
50 mg/kg群では,易刺激性が雄で第57日以降,雌で第60日以降に認められた.瀕死期解剖した同群の雄1例では,解剖前に赤色尿,側臥位,自発運動の減少,呼吸不整および体温低下が認められた.
10 mg/kg群では,異常は認められなかった.
10および50 mg/kg群については,対照群との間で有意差は認められなかった.

10 mg/kg群の雌雄と50および250 mg/kg群の雌については,対照群との間で有意差は認められなかった.
投与期間終了時に血小板数の低値が10 mg/kg群の雌,白血球百分比の好酸球比の高値が50 mg/kg群の雌で,回復期間終了時に白血球百分比の好酸球比の高値が250 mg/kg群の雌で認められたが,その発現状況から被験物質投与とは関連のない変化と判断した.
投与期間中の検査で,ケトン体の有意な低値が10,50および250 mg/kg群の雄で,回復期間中にケトン体の有意な低値が250 mg/kg群の雄で認められたが,毒性学的には意義のない変化と判断した.
偶発的変化として,硝子体血管遺残と血管蛇行が散見された.
250 mg/kg群の死亡・瀕死期解剖動物6例では,心臓の心房拡張が2例,褪色が1例および白色斑が3例,下顎リンパ節の腫大が2例,胸腺の出血および混濁が各1例と小型化が5例,脾臓の表面粗ぞう化が1例と小型化が2例,肺の水腫と退縮不全が各1例,胃の異常内容物が2例,十二指腸の異常内容物が1例,肝臓のうっ血が3例,腎臓の暗褐色化と変形が各1例,腎盂拡張が2例と腫大が3例,尿管の拡張が2例,膀胱の結石が4例,膨満が1例と壁の肥厚が2例,精巣の小型化が1例,精嚢の水腫が1例と小型化が3例,前立腺の水腫が1例と小型化が3例,副腎の腫大が3例,口角部皮膚の痂皮と腹水が各1例,腹腔内脂肪織の減少が3例と削痩が1例で認められた.その他,偶発所見として肺の褐色斑が3例,下垂体の嚢胞が2例で認められた.なお,内腸骨リンパ節の腫大が2例で認められたが,病理組織学的には異常は認められなかった.
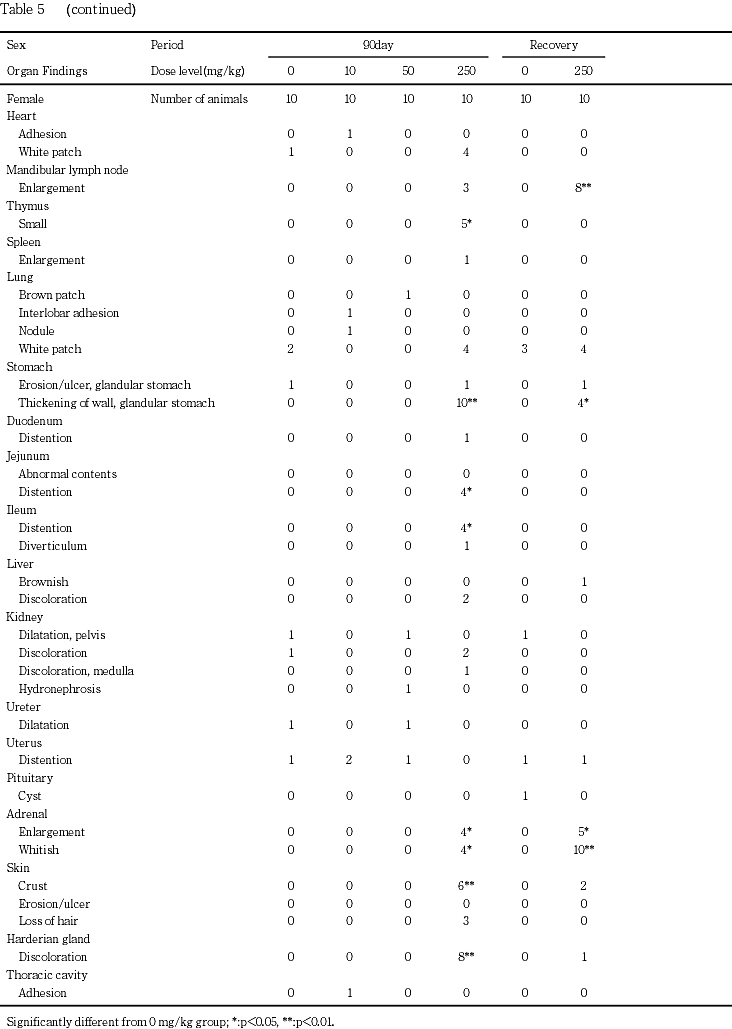
下顎リンパ節の腫大が250 mg/kg群の雄1例と雌3例で認められた.
胸腺の小型化が50 mg/kg群の雄1例および250 mg/kg群の雄8例と雌5例で認められた.
脾臓の褪色が250 mg/kg群の雄1例,腫大が250mg/kg群の雌1例で認められた.
腺胃の壁の肥厚が250 mg/kg群の雄8例と雌全例で認められた.
十二指腸の膨満が250 mg/kg群の雌1例,空腸の膨満が250 mg/kg群の雄2例と雌4例,回腸の膨満が250 mg/kg群の雄1例と雌4例で認められた.
肝臓の褐色化が250 mg/kg群の雄1例,褪色が250 mg/kg群の雄1例と雌2例で認められた.
腎臓の褪色が250 mg/kg群の雌雄各2例,髄質外帯の褪色が250 mg/kg群の雄2例と雌1例,表面顆粒状化が250 mg/kg群の雄1例,腎盂内顆粒状物(腎結石)が50 mg/kg群の雄1例で認められた.なお,腎臓の褪色は対照群の雌1例でもみられたが,腎盂拡張を伴う片側性の変化であり,両側性に発現する250 mg/kg群の変化とは異なっていた.
膀胱の結石が50および250 mg/kg群の雄各5例,膨満が50 mg/kg群の雄1例,出血が250 mg/kg群の雄1例,壁の肥厚が50 mg/kg群の雄3例と250 mg/kg群の雄5例で認められた.
尿管の拡張が50および250 mg/kg群の雄各3例で認められた.これらの動物は,いずれも膀胱結石を有していた.
精巣の腫大が250 mg/kg群の1例,小型化が250 mg/kg群の5例,軟化が250 mg/kg群の7例で認められた.なお,軟化が50 mg/kg群の1例でも認められたが,片側性の変化であり,対側の精巣は組織学的にも正常であったことから,偶発的変化と判断した.
精巣上体と前立腺の小型化がそれぞれ250 mg/kg群の4例,精嚢の小型化が250 mg/kg群の5例で認められた.
副腎の腫大が250 mg/kg群の雄9例と雌4例および白色化が250 mg/kg群の雌4例で認められた.
口角部,鼻周囲,あるいは頸背部および左右前肢の皮膚の痂皮が250 mg/kg群の雄5例と雌6例,腹部の皮膚のびらん/潰瘍が250 mg/kg群の雄1例,腹部,頭部あるいは頸背部の脱毛が250 mg/kg群の雌3例で認められた.
ハーダー腺の褪色が250 mg/kg群の雌雄各8例で認められた.
その他,被験物質投与群で偶発変化と思われる種々の変化が散見された.また,10 mg/kg群の雌1例で投与過誤を疑わせる肺の結節,心臓と心嚢,肺の葉間および肺と胸壁あるいは横隔膜との癒着が認められた.
その他,被験物質投与群で偶発変化と思われる種々の変化が散見された.
250 mg/kg群の死亡・瀕死期解剖動物6例では,心臓の心筋変性が5例および心筋炎が1例,下顎リンパ節の形質細胞増生が4例,胸腺の萎縮が全例および出血が2例,脾臓の赤脾髄の萎縮とヘモジデリン沈着が各4例,脾臓の全体的萎縮と被膜の線維化が各1例および髄外造血が2例,骨髄の赤芽球系造血の亢進が1例と顆粒球系造血の亢進が5例,肺の泡沫細胞集簇が全例,うっ血と肺胞水腫が各2例および限局性の炎症性細胞浸潤が3例,胃の膵腺房細胞様細胞の出現と胃腺の拡張が各1例,腺胃のびらんが2例,腺胃粘膜のびまん性過形成が3例,前胃および腺胃の限局性炎症性細胞浸潤が各1例および前胃の潰瘍が2例,十二指腸の粘膜上皮の肥大が3例,下顎腺の腺房萎縮が2例,導管上皮の顆粒の減少が全例および腺房細胞の肥大が1例,舌下腺の腺房萎縮が3例および導管上皮の過形成が2例,肝臓のうっ血が3例,びまん性および門脈周囲性の肝細胞の脂肪化が各1例および巣状壊死が3例,膵臓のびまん性の腺房萎縮が5例,腎臓の好塩基性尿細管の増強が全例,細胞残渣を含む円柱が5例,腎盂拡張が4例,近位および遠位尿細管の拡張と遠位尿細管のみの拡張が各1例,腎盂粘膜上皮の過形成が5例,遠位尿細管上皮の肥大が2例,間質の限局性炎症性細胞浸潤が3例,皮髄境界部の鉱質沈着と乳頭壊死が各1例,腎盂炎と腎盂腎炎が各1例,尿管の拡張が2例,膀胱の粘膜移行上皮のびまん性過形成が全例,精巣のびまん性精細管萎縮が1例と限局性精細管萎縮が5例,精巣上体の管内細胞残渣の貯留が1例と精子の減数が5例,精嚢の萎縮が4例,びまん性の炎症性細胞浸潤が1例,前立腺の萎縮,水腫およびびまん性あるいは限局性の炎症性細胞浸潤が各1例,下垂体の中間葉細胞の肥大が3例,甲状腺の濾胞拡張が全例,上皮小体の主細胞の肥大が3例,副腎のうっ血が1例,束状帯細胞の肥大が2例,束状帯細胞の脂肪滴の増加が1例,球状帯細胞の脂肪滴の増加が5例および脂肪滴の増加は不明瞭だが球状帯層の肥厚が1例で認められた.坐骨神経の変性が2例,皮膚の潰瘍が1例,大腿筋の変性が3例,外肋間筋の変性が3例と再生像が1例,大腿骨骨梁の減少が1例および胸骨骨梁の減少が全例,ハーダー腺の腺房細胞のびまん性肥大が2例で認められた.その他,偶発変化が散見された.
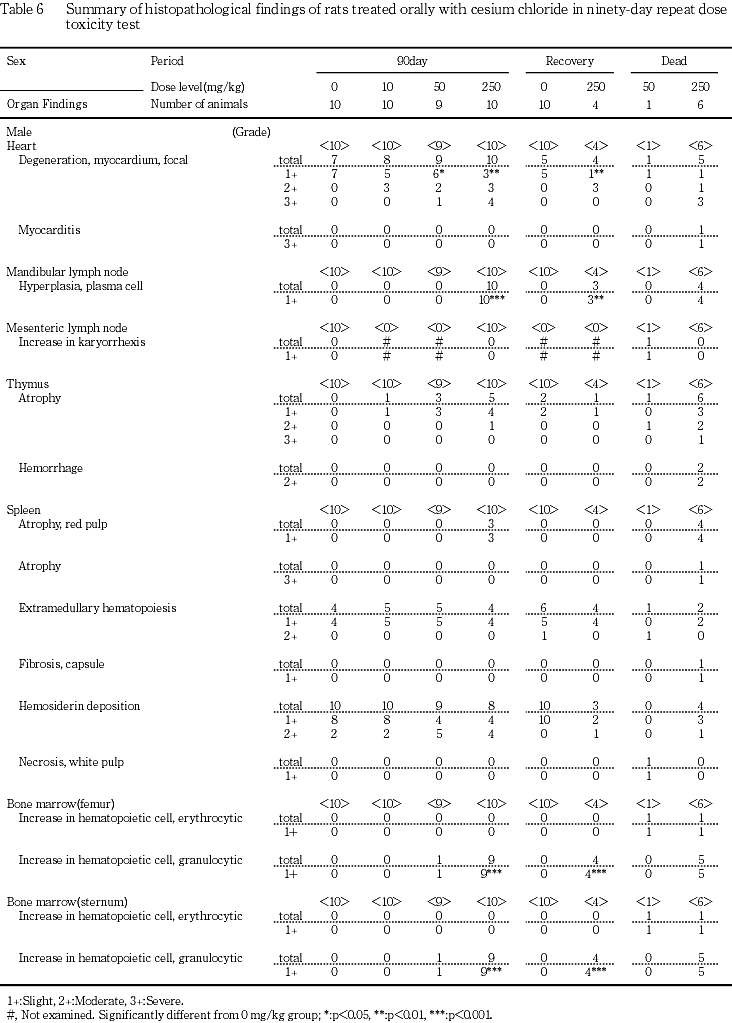
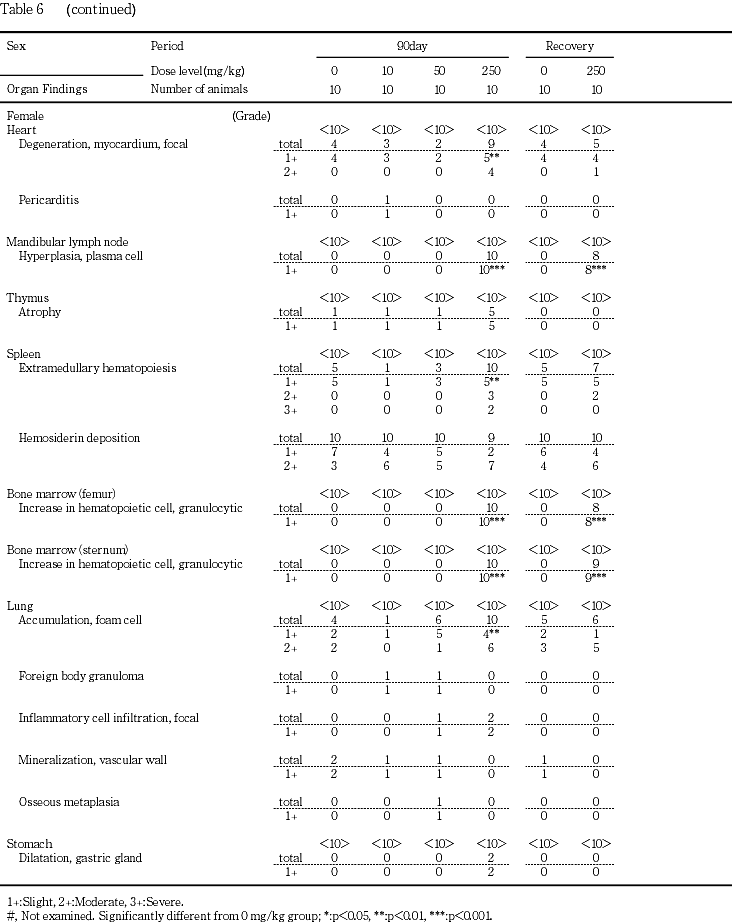
下顎リンパ節の形質細胞増生が250 mg/kg群の雌雄全例に認められた.
胸腺の萎縮が対照群,10,50および250 mg/kg群の順に雄で0,1,3,5例,雌では同順に1,1,1,5例で認められ,250 mg/kg群の雌雄でやや発現頻度が高かった.
脾臓の赤脾髄の萎縮が250 mg/kg群の雄3例で認められた.また,雌では髄外造血が対照群,10,50および250 mg/kg群の順に5,1,3,10例で認められ,250 mg/kg群で中等度および重度の変化を示す例が多かった.
大腿骨および胸骨骨髄の顆粒球系造血の亢進がそれぞれ50 mg/kg群の雄1例と250 mg/kg群の雄9例および雌全例で認められた.
肺の泡沫細胞集簇が対照群,10,50および250 mg/kg群の順に雄で4,7,7,10例,雌では同順に4,1,6,10例で認められ,250 mg/kg群の雌雄で中等度の変化を示す例が多かった.
腺胃粘膜のびまん性の過形成が250 mg/kg群の雌雄全例,膵腺房細胞様細胞の出現が250 mg/kg群の雄2例,胃腺の拡張が250 mg/kg群の雌2例,水腫が250 mg/kg群の雌雄各1例で認められた.また,腺胃の限局性の炎症性細胞浸潤が対照群,10,50および250 mg/kg群の順に雄で1,1,1,7例と250 mg/kg群の雌2例で認められ,250 mg/kg群の雌雄で発現頻度が高かった.腺胃粘膜のびらんが対照群の雌雄各1例と250 mg/kg群の雌雄各3例で認められた.対照群と250 mg/kg群でみられたびらんの組織像は同様であり,有意差もなかったが,他の線胃粘膜の変化を含め総合的にみた場合,250 mg/kg群でみられたびらんは被験物質の影響と判断した.
十二指腸の粘膜上皮の肥大が250 mg/kg群の雄8例と雌5例で認められた.
下顎腺の腺房萎縮が250 mg/kg群の雄5例と雌4例,導管上皮の顆粒の減少が250 mg/kg群の雌雄全例に認められた.
舌下腺の腺房萎縮が250 mg/kg群の雌雄全例で認められた.
肝臓の肝細胞萎縮が250 mg/kg群の雄4例,髄外造血が250 mg/kg群の雌3例に認められた.
膵臓のびまん性の腺房萎縮が50 mg/kg群の雌1例と250 mg/kg群の雄5例および雌6例で認められた.
腎臓では,好塩基性尿細管が対照群,10,50および250 mg/kg群の順に雄で7,6,7,10例で認められ,50および250 mg/kg群の雄で中等度以上の変化を示す例が多かった.皮質遠位尿細管上皮の肥大が250 mg/kg群の雄7例と雌全例に認められた.また,髄質外帯の遠位尿細管上皮の腫大が50 mg/kg群の雄3例と250 mg/kg群の雌雄全例に認められた.この変化は尿細管上皮の空胞化ないしは淡明,大型化した尿細管上皮が再生像とともに認められるものであった.腎盂内結晶物が50 mg/kg群の雄3例と250 mg/kg群の雄5例,腎盂粘膜上皮の過形成が50 mg/kg群の雄5例と250 mg/kg群の雄7例で認められた.両変化は併発するものが多く,腎盂内結晶物がみられない例でも腎盂粘膜上皮の過形成領域には微小な肉芽腫様の構造がみられ,異物の存在が示唆された.また,腎盂炎あるいは腎盂腎炎が50 mg/kg群の雄2例と250 mg/kg群の雄5例(1例は両変化が併発)で認められた.これらの腎盂病変が観察された動物の多くは,膀胱結石あるいは腎盂内顆粒状物(腎結石)を有していた.また250 mg/kg群の雌1例でも雄と同様の肉芽腫様の構造を伴う中等度の腎盂粘膜上皮の過形成が認められ,この例では同時に腎盂炎が認められた.なお,10 mg/kg群の雌1例でも腎盂粘膜上皮の過形成と腎盂炎が認められたが,片側性の変化であることや,病変部には肉芽腫様の構造がみられず50 mg/kg群の雄と250 mg/kg群の雌雄でみられた変化と形態が異なることから,偶発変化と判断した.
尿管の拡張が50 mg/kg群の雄3例と250 mg/kg群の雄2例,粘膜上皮の過形成が50 mg/kg群の雄5例と250 mg/kg群の雄6例で認められた.なお,偶発変化と考えられる尿管の拡張が対照群の雌1例と50 mg/kg群の雌1例で認められた.
膀胱のびまん性の粘膜移行上皮の過形成が50 mg/kg群の雄7例と250 mg/kg群の雄8例,粘膜の出血が250 mg/kg群の雄1例で認められた.
精巣のびまん性の精細管萎縮が250 mg/kg群の2例,限局性の精細管萎縮が250 mg/kg群の6例,精子低形成を伴う精細管拡張が250 mg/kg群の2例で認められた.精巣上体の精子の減数が250 mg/kg群の全例で認められた.なお,50 mg/kg群の1例でもびまん性の精細管萎縮と精巣上体の精子の減数が認められたが,片側のみの変化であり対側の精巣および精巣上体は正常であることから偶発的変化と判断した.
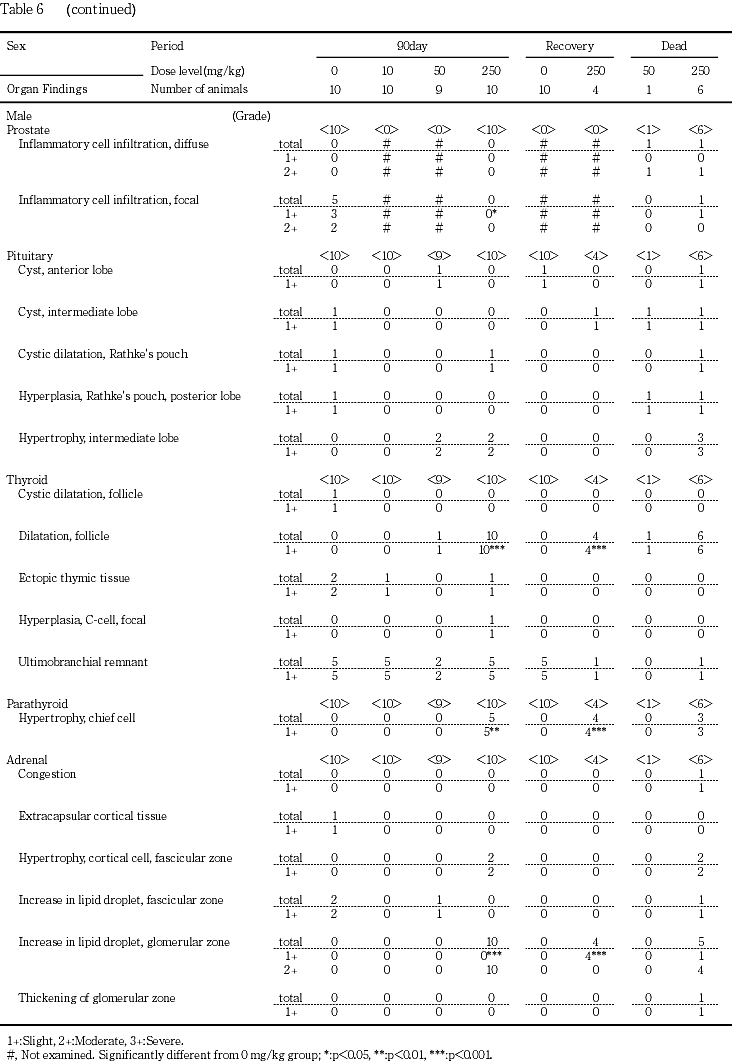
下垂体の中間葉細胞の肥大が50 mg/kg群の雄2例と250 mg/kg群の雄2例および雌全例で認められた.
甲状腺の濾胞拡張が対照群,10,50および250 mg/kg群の順に雄で0,0,1,10例,雌では同順に2,1,1,10例で認められ,250 mg/kg群の雌雄で発現頻度が高かった.拡張した濾胞の濾胞上皮は扁平化し,濾胞内にコロイドが貯留していた.
上皮小体の主細胞の肥大が250 mg/kg群の雄5例と雌6例で認められた.上皮小体の組織全体の明らかな増大はみられなかったが,淡明核と明るい胞体を有する大型の細胞で構成されていた.
副腎の髄外造血が250 mg/kg群の雌2例,束状帯細胞の肥大が250 mg/kg群の雄2例と雌4例,球状帯細胞の脂肪滴の増加が50 mg/kg群の雌4例と250 mg/kg群の雌雄全例で認められた.
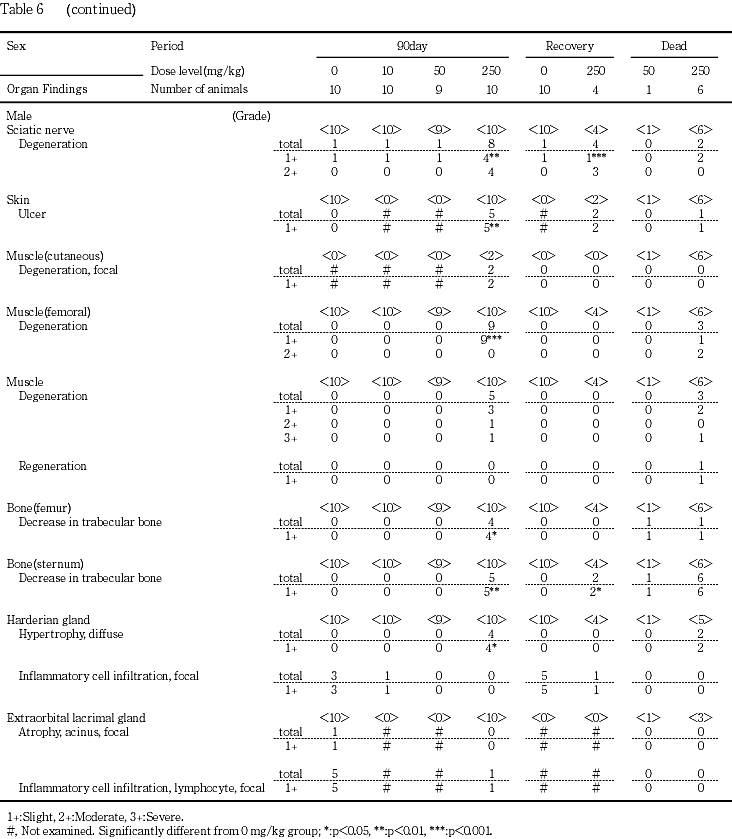
坐骨神経の変性が対照群,10,50および250 mg/kg群の順に雄で1,1,1,8例,雌では同順に0,0,1,4例で認められ,250 mg/kg群の雌雄で発現頻度が高かった.多くの例では髄鞘の崩壊像が散発的に観察される軽度の変化であったが,250 mg/kg群の雄4例ではマクロファージの浸潤を伴う程度の強い中等度の変化がみられた.
皮膚の潰瘍が250 mg/kg群の雄5例と雌6例,痂皮,びらんおよび限局性の炎症性細胞浸潤がそれぞれ250 mg/kg群の雌1例で認められた.これらの変化は口角部,鼻周囲,頸背部あるいは頭部など肉眼的に痂皮あるいはびらんとして観察された部位の変化であった.
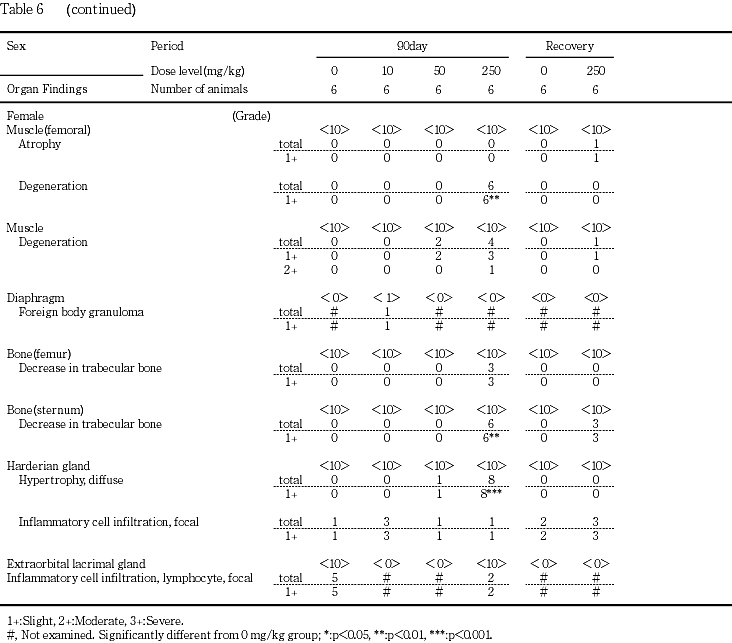
大腿筋の変性が250 mg/kg群の雄9例と雌6例,外肋間筋の変性が50 mg/kg群の雌2例と250 mg/kg群の雄5例および雌4例で認められた.これらの変化は筋線維単位で不規則に発現し,凝固壊死や単核細胞浸潤も散見された.その他,腹部皮膚(定常検査部位)に付随する皮筋の変性が250 mg/kg群の雄2例で認められた.
大腿骨の骨梁の減少が250 mg/kg群の雄4例と雌3例,胸骨の骨梁の減少が250 mg/kg群の雄5例と雌6例で認められた.この変化には,破骨細胞や骨芽細胞の増生像は認められなかった.
ハーダー腺の腺房細胞のびまん性肥大が50 mg/kg群の雌1例と250 mg/kg群の雄4例および雌8例で認められた.ハーダー腺の腺細胞は,通常微細な脂肪滴を多数有しているが,肥大した腺細胞では脂肪滴が減少していた.
その他,被験物質投与群で偶発変化と思われる種々の変化が散見された.
その他,被験物質投与群で偶発変化と思われる種々の変化が散見された.







被験物質投与により250 mg/kg群の雄4例が死亡し,50 mg/kg群の雄1例と250 mg/kg群の雄2例を瀕死期解剖した.250 mg/kg群の死亡・瀕死期解剖動物では痙攣,体温低下,円背位,自発運動の減少等の症状や,膀胱結石とそれに伴うと考えられる膀胱および腎臓等の泌尿器系器官に病理変化が認められた.また,50 mg/kg群の瀕死期解剖動物では赤色尿,自発運動の減少,体温低下等の症状や,膀胱結石は確認できなかったが泌尿器系器官で250 mg/kg群と同様の病理変化が認められた.これらのことから死亡あるいは衰弱の主な要因として,膀胱結石に伴う尿路障害が考えられる.
一般状態観察では,痙攣が250 mg/kg群の雌雄,易刺激性が50および250 mg/kg群の雌雄で認められた.さらに洗顔行動とそれに伴うと考えられる顔面部を中心とした痂皮形成やびらん・潰瘍,ならびに反応性変化と考えられる下顎リンパ節の形質細胞増生が250 mg/kg群の雌雄で認められた.また,一過性の自発運動の亢進が250 mg/kg群の雌で認められた.これらの神経症状発現の原因として,神経伝導に重要な役割をもつカリウムの減少や泌尿器系障害に起因すると思われる尿素窒素やクレアチニン等の窒素化合物の蓄積が考えられる.また,被験物質に含まれるセシウムは主に筋肉や腎臓等の軟部組織の細胞内に存在し,細胞膜を自由に通ることができるとともに,必須元素であるカリウムに代わりうることが知られている(参考文献4)より抜粋).また,セシウムと同様に生体内に存在し,カリウムに類似した挙動を示すルビジウムを低カリウム食給餌ラットに過剰投与すると,神経と筋肉の被刺激性の亢進による激しい痙攣が起こることが報告されている(参考文献4)より抜粋).これらのことから過剰なセシウム投与により,同様の現象が生じた可能性も考えられる.
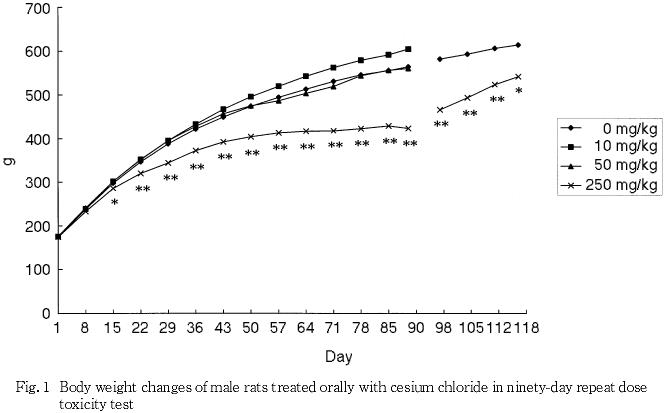
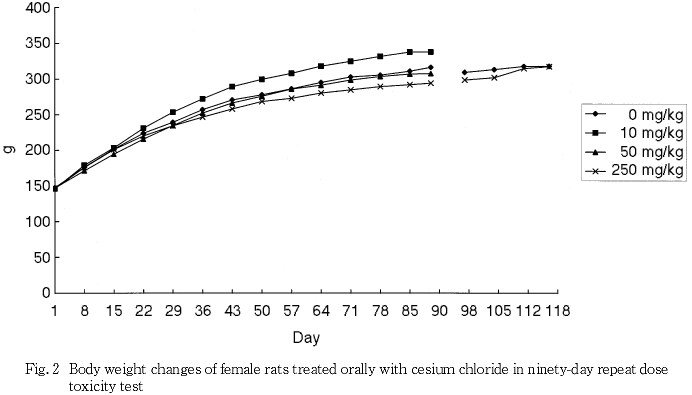
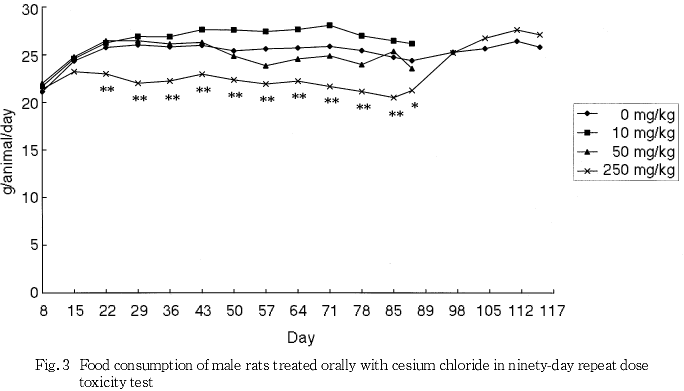
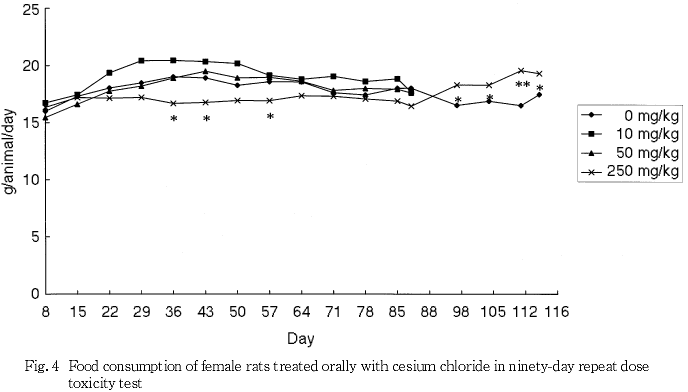
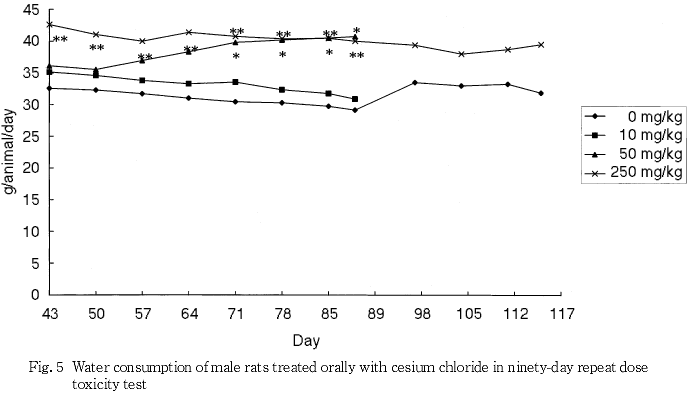
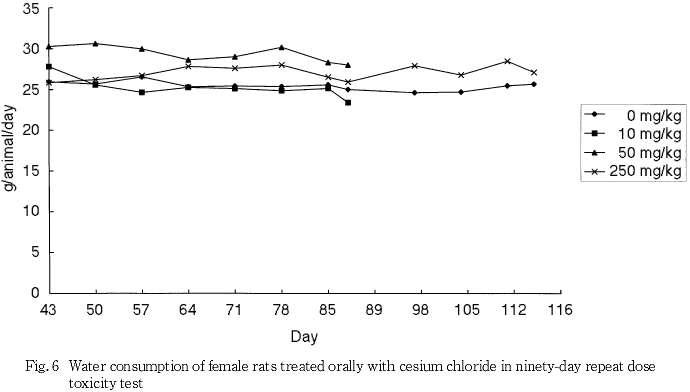
摂餌量の減少に伴うと思われる体重と体重増加量の低値が250 mg/kg群の雄で認められ,摂餌量の減少は250 mg/kg群の雌でも認められた.また,泌尿器系障害に伴うと考えられる摂水量の高値が50および250 mg/kg群の雄で認められた.
血液学的検査で赤血球数,ヘモグロビン濃度,ヘマトクリット値あるいは平均赤血球血色素濃度の低値が250 mg/kg群の雌雄,網赤血球率の高値が50 mg/kg群の雄と250 mg/kg群の雌雄で認められた.また,血小板数の高値とプロトロンビン時間の延長が250 mg/kg群の雌で認められた.これらの赤血球系および凝固系パラメータの変動は,尿検査で潜血陽性反応や沈渣中の赤血球増加あるいは皮膚の潰瘍等の出血性変化が認められることから,出血に伴う変化と考えられる.一方,分葉核好中球の増加による白血球数の高値が250 mg/kg群の雌雄で認められたが,これらの白血球系パラメータの変動は諸臓器にみられた炎症性変化に対する反応性変化と考えられる.また,赤血球系および白血球系パラメータの変動に関連する変化として,肝臓と脾臓の髄外造血が250 mg/kg群の雌,骨髄の顆粒球系造血の亢進が50 mg/kg群の雄と250 mg/kg群の雌雄で認められた.その他,活性化部分トロンボプラスチン時間の短縮が250 mg/kg群の雄で認められたが,その毒性学的意義は不明である.
血液生化学的検査でAST(GOT)とALT(GPT)の高値が250 mg/kg群の雌雄で認められ,特にASAT(GOT)の上昇が顕著であった.肝臓にはこれらの逸脱酵素の上昇に関連する変化がないことや,心筋あるいは骨格筋に変性が認められることから,これらの逸脱酵素は主に心筋あるいは骨格筋由来と考えられる.カリウムの低値が50および250 mg/kgの雌雄で認められた.本変化は遠位尿細管の障害に関連した変化と思われるが,前述のようにセシウムはカリウムと類似した挙動を示すことから,体内に摂取されたセシウムがカリウムの体内バランスに影響を及ぼした可能性も考えられる.その他,腎障害に起因すると思われる尿素窒素とクレアチニンの高値が50 mg/kg群の雄と250 mg/kg群の雌雄,ナトリウムの高値とクロールの低値が250 mg/kg群の雄あるいは雌で認められた.カルシウムあるいは無機リンの高値が250 mg/kg群の雌雄で認められた.これらの無機物の変動は,後述の上皮小体,骨あるいは腎臓の病理組織学的変化との関連が疑われる.ALPの高値が250 mg/kg群の雌で認められた.病理組織学的検査で胆道疾患や骨芽細胞増生がみられず,十二指腸に粘膜上皮の過形成がみられることから,ALPの上昇は十二指腸の変化に付随したものかもしれない.グルコースとアルブミンおよびA/G比の低値が250 mg/kg群の雌雄で認められた.これら変化は,摂餌量の減少に伴う低栄養性の変化と考えられるが,アルブミンの変化は腎障害との関連性も考えられる.その他,総ビリルビンの高値が250 mg/kg群の雄で認められたが,軽微な変化であり毒性学的には意義の乏しい変化と考えられる.
尿検査では,ナトリウムあるいはカリウムの低値が250mg/kg群の雌雄で認められた.また,電解質イオンの変動の他に泌尿器系の器質傷害に起因すると思われる尿沈渣中の白血球と小円形上皮細胞の増加と,有意ではないが尿潜血陽性反応の増強あるいは尿沈渣中の赤血球の増加が50および250 mg/kg群の雌雄で認められた.また,尿沈渣中の六角板状結晶の出現が50 mg/kg群の雌と250 mg/kg群の雌雄で認められた.なお,塩化セシウムは立方体の結晶であり(参考文献4)より抜粋),形態的には尿沈渣中の結晶と異なっていた.その他,尿量の増加に伴うと思われる尿比重の低値が250 mg/kgの雄,精細管萎縮に伴うと思われる尿沈渣中の精子の減少が250 mg/kg群で認められた.
病理学的検査では,前述の下顎リンパ節(形質細胞増生),肝臓と脾臓(髄外造血)および骨髄(顆粒球系造血の亢進)以外に,心臓,骨格筋(大腿筋,外肋間筋),坐骨神経,腎臓,膀胱および尿管,副腎,下垂体,甲状腺,上皮小体および骨,精巣および精巣上体,胃および十二指腸,胸腺,脾臓,唾液腺,膵臓,肝臓および肺で被験物質投与との関連性が疑われる変化が認められた.
心臓の心筋変性の増強が10および50 mg/kg群の雄と250 mg/kg群の雌雄で,心筋炎が250 mg/kg群の死亡動物で認められた.自然発生性の限局性の心筋変性は単核球集簇や線維化を伴い,小型の病巣として好発部位なく散発的に発現する5).一方,被験物質投与群で認められた中等度以上の心筋変性は,病巣部に壊死や出血を伴い,左右心室壁の心内膜および心外膜に面して多発していた.心筋変性の他に大腿筋あるいは外肋間筋等の骨格筋の変性が50 mg/kg群の雌と250 mg/kg群の雌雄で認められた.これらの筋変性は筋線維単位で不規則に発現し,凝固壊死や単核細胞浸潤を伴っていた.また,髄鞘崩壊とマクロファージの反応を伴う坐骨神経の変性の増強が250 mg/kg群の雌雄で認められた.これらの変化がそれぞれ異なる原因で発現した可能性もあるが,低カリウム血症により心筋変性(hypokalemic cardiopathy),骨格筋変性(hypokalemic myopathy)および末梢神経病変が発現することが知られていることや6),50および250 mg/kg群の雌雄では血清カリウムの低値が認められることから,上記変化はカリウムの減少に起因した変化である可能性が考えられる.また,前述のようにセシウムはカリウムに類似した挙動を示すことから,体内に摂取されたセシウムが上記臓器に影響を及ぼした可能性も考えられる.
泌尿器系器官の変化として,剖検で膀胱結石と腎盂内顆粒状物(腎結石)が,病理組織学的検査で腎盂内結晶物が50および250 mg/kg群の雄で認められた.尿道結石あるいは腎盂内結晶物に付随する変化として,膀胱壁の肥厚,出血および粘膜移行上皮の過形成,尿管の拡張と粘膜上皮の増生,肉芽腫様構造を伴う腎盂粘膜上皮の過形成,腎盂炎あるいは腎盂腎炎が50および250 mg/kg群の雄で認められた.尿道結石および腎盂内結晶物の形成には,尿沈渣中にみられた六角板状結晶が関与しているものと思われる.一方,尿沈渣中の六角板状結晶は雌の50および250 mg/kg群でも出現したが,尿道結石や腎盂内結晶物は認められなかった.この性差の原因については明らかではないが,250 mg/kg群の雌1例で雄と同様の肉芽腫様構造を伴う腎盂粘膜上皮の過形成と腎盂炎が認められることから,被験物質の腎盂粘膜への影響が示唆される.
腎臓では,尿道結石や腎盂内結晶物に起因すると考えられる上記変化の他に,好塩基性尿細管の増強,皮質の遠位尿細管上皮の肥大と髄質外帯の遠位尿細管上皮の腫大が50および250 mg/kg群の雌雄で認められた.特に髄質外帯の変化は,空胞化ないしは淡明,大型化した尿細管上皮が再生像とともに認められるものであった.先に実施した塩化セシウムの28日間反復投与予備試験で,尿細管上皮の変性や壊死が500 mg/kg以上の用量群で認められることから,好塩基性尿細管の増強はこれらの障害性変化に対する修復性の変化と考えられる.なお,低カリウム血症で近位尿細管上皮の変性が起こることが知られている6).一方,ナトリウムやカリウム等の電解質平衡を司る場である遠位尿細管の変化は,セシウムが電解質バランスに影響を及ぼした結果生じた細胞障害性変化と思われる.また,副腎皮質の球状帯細胞の脂肪滴増加が50 mg/kg群の雌と250 mg/kg群の雌雄で認められたが,本変化も電解質バランスの異常に関連した変化と思われる.
下垂体の中間葉細胞の肥大が50 mg/kg群の雄と250 mg/kg群の雌雄で認められた.局所皮膚刺激性試験で,皮膚に重度の炎症や潰瘍が生じると下垂体の中間葉細胞の肥大が起こり,その原因として慢性ストレスによる中間葉のACTH分泌細胞刺激が考えられている7).50および250 mg/kg群では,神経症状や皮膚の潰瘍性病変あるいは膀胱結石等の変化が認められることから,本試験でみられた下垂体中間葉の変化は慢性ストレスに起因した可能性が考えられる.
甲状腺の濾胞上皮細胞の扁平化とコロイドの貯留を伴う濾胞拡張が250mg/kg群の雌雄で認められた.本変化は,甲状腺ホルモン(T4)投与により発現する変化と類似しており8),甲状腺におけるホルモン合成や分泌の低下を示唆されるが,その原因は明らかではなかった.
上皮小体の主細胞の肥大が250 mg/kg群の雌雄で認められた.本変化は上皮小体の機能亢進を示唆しているが,どのような刺激に基づく変化であるかは明らかではなかった.また,大腿骨および胸骨における骨梁の減少が50 mg/kg群の雄(瀕死期解剖動物)と250 mg/kg群の雌雄で認められた.上皮小体の変化との関連性も疑われるが,骨芽細胞や破骨細胞の活性化像がないことから,骨梁の減少は低栄養による成長抑制である可能性も考えられる.
精巣の精細管萎縮と精巣上体の精子減少が250 mg/kg群で認められた.死亡・瀕死期解剖動物では精嚢あるいは前立腺の萎縮も認められた.塩化セシウムの精細胞への直接的影響も疑われるが,250 mg/kg群では体重増加抑制や摂餌量の減少が投与初期から継続してみられることから,低栄養性の二次的変化である可能性も考えられる.
胃腸管の変化として,腺胃粘膜上皮の過形成と十二指腸粘膜上皮の肥大が250 mg/kg群の雌雄で認められた.これらの変化は,プロスタグランジンE投与により発現する変化に類似していた9, 10).しかし,プロスタグランジンE投与により発現する前胃粘膜上皮の過形成10)や小腸と大腸全域に及ぶ粘膜上皮の肥大や過形成は9),本試験では認められなかった.250 mg/kg群では腺胃の膵腺房細胞様細胞の出現,腺胃粘膜のびらんや限局性の炎症細胞浸潤の増強が認められることや,塩化セシウムは刺激性あるいは腐蝕性を有することから4),腺胃および十二指腸の変化は被験物質の粘膜刺激に基づく変化である可能性が考えられる.
上記変化の他に,低栄養あるいはストレスに起因すると考えられる胸腺と赤脾髄の萎縮,下顎腺および舌下腺の腺房萎縮と下顎腺導管部の好酸性顆粒の減少,重量の低値を伴う肝臓の肝細胞萎縮,膵臓の腺房のびまん性萎縮,副腎の束状帯細胞の肥大が250 mg/kg群の雌雄で認められた.膵臓の腺房のびまん性萎縮は50 mg/kg群の雌でも認められたが,1例のみの発現であることや低栄養性の変化がみられないことから,偶発的変化と判断した.その他,毒性学的意義あるいは原因については不明であるが,ハーダー腺の脂肪滴空胞の減少を伴う腺房細胞の肥大が50 mg/kg群の雌と250 mg/kg群の雌雄,ラットで偶発性変化としてしばしば認められる肺の泡沫細胞集簇11)の増強が250 mg/kg群の雌雄で認められた.
被験物質投与に起因すると考えられる上記変化は,投与を止めることにより概ね軽減あるいは回復していたが,一部の変化については28日間の休薬期間では十分な回復性がみられなかった.
以上,10 mg/kg群の雄で心筋変性の増強,50 mg/kg群の雌で易刺激性,血清中カリウムの有意な低値,副腎球状帯細胞の脂肪滴の増加,骨格筋の変性およびハーダー腺の腺房細胞のびまん性肥大が認められた.従って,本試験条件下における塩化セシウムの無影響量(NOEL)は雄が10 mg/kg未満,雌が10 mg/kgと判断した.
| 1) | 東京化学同人社編,"生化学辞典,"第2版,東京化学同人社,東京,1990, pp. 208-209. |
| 2) | 化学工業日報社編,"1994年度版新化学インデックス,"化学工業日報社,東京,1993, p. 115. |
| 3) | 化学工業日報社編,"12093の化学商品,"化学工業日報社,東京,1993, p. 1555. |
| 4) | 石原信夫,"産業中毒便覧 増補版,"後藤稠,池田正之,原一郎編,医歯薬出版,1984, pp. 165-166. |
| 5) | 奈良間功,"毒性試験講座5,毒性病理学,"前川昭彦,林裕造(責任編),地人書館,東京,1991, pp. 58-76. |
| 6) | 鳥海純,"現代病理学大系3,代謝障害,"飯島宗一,石川栄世,景山圭三,島峰徹郎(責任編),中山書店,東京.1984, pp. 351-376. |
| 7) | W. F. MacKenzie and G. A. Boorman, "Pathology of the Fischer Rat," edited by G. A. Boorman, S. L. Eustis, M. R. Elwell, C. A. Montgomery Jr., and W. F. MacKenzie, Academic Press, San Diego, 1990, pp. 485-500. |
| 8) | Y. Kawai, T. Yamamura, H. Yuasa, T. Inui and A Okaniwa., J. Toxicol. Pathol., 2, 85(1989). |
| 9) | P. Greaves, "Histopathology of Preclinical Toxicity Studies," edited by P. Greaves, Elsevier, Amsterdam, 1990, pp. 326-349. |
| 10) | P. Greaves, "Histopathology of Preclinical Toxicity Studies," edited by P. Greaves, Elsevier, Amsterdam, 1990, pp. 300-326. |
| 11) | P. Greaves, "Histopathology of Preclinical Toxicity Studies," edited by P. Greaves, Elsevier, Amsterdam, 1990, pp. 193-220. |
| 連絡先 | |||
| 試験責任者: | 須藤雅人 | ||
| 試験担当者: | 岡部恵美,土谷 稔,岡崎欣正,豊田直人,高野克代,水嶋亜弥子,井澤 修,鈴木美江 | ||
| (株)三菱化学安全科学研究所 鹿島研究所 | |||
| 〒314-0255 茨城県鹿島郡波崎町砂山14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence | ||||
| Authors: | Masato Sudo(Study director) Emi Okabe, Minoru Tsuchitani, Yoshimasa Okazaki, Naoto Toyota, Katsuyo Takano, Ayako Mizushima, Osamu Izawa, Yoshie Suzuki | |||
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory | ||||
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-0255, Japan. | ||||
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | |||