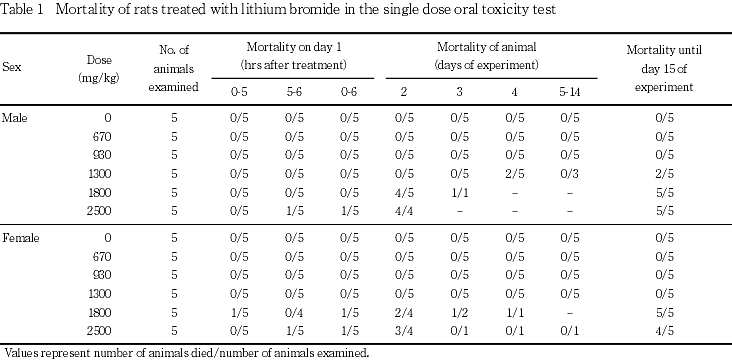
死亡は,雄では,1300 mg/kg以上の投与群において投与後6時間から観察第4日の間に認められ,また,雌では,1800 mg/kg以上の投与群において投与後5時間から観察第4日までに認められた.これらの例では,死亡前に自発運動の減少,鎮静あるいは受動性などが認められ,チアノーゼ,体表温の低下および半眼を示す例もあった.また,鼻汁の大量滴下を示した例あるいは流涙を認める例もあった.
投与後の毒性変化としては,雄では臭化リチウム投与群のほぼ全例,ならびに雌では930 mg/kg以上の投与群の全例に自発運動の減少が認められ,投与直後に常同行動を示す例もあった.さらに,投与後の時間経過に伴い,鎮静に至る例,あるいは半眼および歩行異常などを示す例があった.また,雌雄ともに臭化リチウム投与群のほぼ全例に,投与後,軟便,粘液便,下痢などの糞便の性状変化が観察され,投与後日時を経過した後,排便量の減少が観察された.これらの他に,紅涙,立毛,流涎などが観察されたが,2500 mg/kg投与群の生存例が剖検まで腹部膨満を示した他には,いずれも観察第5日までに回復した.
体重増加は雌雄ともに,930 mg/kg以上の投与群において抑制された.しかし,2500 mg/kg投与群の生存例は,臭化リチウム各投与群で観察された一般状態の異常が回復した後は,むしろ亢進して,観察第15日には生存動物中最高の値を示した.
死亡動物の剖検では,1300 mg/kg投与群の雄に脾臓の淡色化および小型化が認められた他に,異常は認められなかった.生存動物の剖検でも,異常は観察されなかった.
以上の結果から,臭化リチウムの経口投与によるLD50値は,雄では1383 mg/kg,雌では1600 mg/kgと算出された.
投与検体は,入手物質を秤量して,媒体である日局注射用水(光製薬(株),製造番号:9912ST)で希釈し,最高濃度の投与検体を調製した.さらに,これを媒体で希釈していずれの用量においても投与液量が5 mL/kg体重になるように各濃度の投与検体を調製した.調製に先立ち,8日間の安定性を確認したので,投与時まで冷蔵,密封条件下で保存し,調製翌日に使用した.投与検体中に含まれる被験物質の含量は,秦野研究所において確認した.
動物は,許容温湿度各21.0〜25.0 ℃および40.0〜75.0 %,換気回数約15回/時間,照明12時間(7〜19時点灯)に制御された飼育室で,金属製金網床ケージに個別に収容し,固型飼料(CE-2,日本クレア(株))および飲料水(水道水,秦野市水道局給水)を自由に摂取させて飼育した.
投与容量は体重1 kg当たり5 mLとし,動物を投与前日の16時より絶食させた後,投与直前に測定した体重を基に投与液量を算出し,ラット用胃管を用いて強制的に単回経口投与した.給餌は投与後約3時間に行った.
LD50値は,雌雄ともにBehrens法により算出した.
雄では,930 mg/kg以下の投与群に死亡は認められなかった.1300 mg/kg投与群では,観察第3日まで死亡は認められなかったが,観察第4日に5例中2例が死亡した.残りの3例は観察第15日まで生存した.1800 mg/kg投与群では,観察第2日に5例中4例が死亡し,残りの1例も観察第3日に死亡した.2500 mg/kg投与群では,投与5〜6時間に5例中1例が死亡し,残りの4例は観察第2日に死亡が発見された.
雌では,1300 mg/kg以下の投与群に死亡は認められなかった.1800 mg/kg投与群では,投与後4〜5時間に5例中1例が死亡し,観察第2日に2例,観察第3および4日に各1例が死亡し,観察第4日までに全例が死亡した.2500 mg/kg投与群では,投与後5〜6時間に5例中1例が死亡し,観察第2日に3例が死亡していたが,残りの1例は観察第15日まで生存した.
LD50値は雄では1383 mg/kg,雌では1600 mg/kgと算出された.

雌においても670 mg/kg以上の投与群に,雄と同様の糞便の性状変化が観察された.670 mg/kg投与群では,これらの変化は投与後6時間には認められなくなった.また,670 mg/kg投与群では,観察第4日に餌こぼしが増加している例が例認められたものの観察第5日以降に異常は観察されなかった.雌では,自発運動の減少が930 mg/kg以上の投与群において認められた.930 mg/kg投与群では,雄にみられたのと同様の常同行動や半眼も認められたが回復した.観察第2日にも自発運動の減少あるいは常同行動を認める例があった.930 mg/kg投与群における糞便の性状変化は,観察第2日に認められなくなったが,代わって排便量の減少,あるいは排便の廃絶が認められた.観察第2日にはこれらの他に,立毛,異常呼吸音,被毛汚染,紅涙,流涙,歩行異常あるいは音に対する過敏性が認められた.また,1例には餌こぼしが認められず,摂食行動がなかったものと判断された.この例は観察第3日に排便量の減少が認められたが,この日から餌こぼしは増加していた.また,紅涙も認められる様になった.しかし,観察第5日以降に異常は観察されず,その他の動物は観察第3日以降に既に異常は認められなくなった.1300 mg/kg投与群では自発運動の減少が進行して一過性に鎮静に至る例の他に観察第2日に初めて自発運動の減少が観察された例があった.この他1300 mg/kg投与群では,投与後時間が経過した後に半眼を示す例があった.また,観察第2日に排便量の減少,あるいは排便の廃絶,紅涙,歩行異常,あるいは異常呼吸音を認める例があった.観察第3および4日にも被毛汚染,紅涙および餌こぼしの増加を認める例があったが,観察第5日以降に異常は観察されなかった.1800 mg/kg投与群では,投与から時間を経過した後に鎮静を示し,観察第2日に至って鎮静を示す例もあった.しかし,いずれの例も,死亡するまで鎮静が回復することはなかった.投与日に死亡した例では,投与後3時間に給餌しても餌こぼしが認められず,摂食行動がなかったものと判断され,さらに半眼,鼻汁および歩行異常を示して死亡した.観察第2日に死亡しているのが発見された例も,投与日には給餌後の摂食行動がないと判断され,半眼および歩行異常が観察された.観察第2日に死亡した例では,投与直後に常同行動が認められ,紅涙および半眼が認められたが,給餌後に餌こぼしが認められた.観察第2日に半眼は回復したが,紅涙は認められた.その後,餌こぼしが認められなくなり,摂食行動がなくなったものと判断された.さらに,排便も廃絶して受動性を示し,体表温が低下して死亡した.観察第3日に死亡しているのが発見された例では,投与日には前述した自発運動の減少および糞便の性状変化以外に異常は認められなかったが,観察第2日に鎮静,立毛,体表温の低下,排便の廃絶および流涙が認められ,餌こぼしも認められなくなり摂食行動がなくなったものと判断された.観察第4日に死亡しているのが発見された例では,投与日には前述の例と同様に自発運動の減少および糞便の性状変化が認められ,また,投与直後に流涎および常同行動が一過性に認められた他に異常は観察されなかった.しかし,観察第2日にも自発運動の減少が観察され,さらに鎮静に至った.また,観察第2日に排便の廃絶が認められ,餌こぼしが認められず摂食行動の廃絶と判断された.翌日は餌こぼしが認められていたことから摂食行動があったものと判断され,量が減少したものの排便が認められたが,その性状は変化していた.この例では紅涙が観察第2日から認められ,観察第3日には,呼吸音の異常および被毛汚染も観察された.2500 mg/kg投与群では,投与日に死亡した1例は,投与直後から鎮静が認められ,回復することなく死亡した.また,半眼が観察され,投与後3時間に給餌しても餌こぼしが認められなかった.さらに,投与後の時間が経過した後にチアノーゼおよび体表温の低下が認められるようになり,死亡前には受動性も観察された.観察第2日に死亡しているのが発見された3例のうち1例には投与日に紅涙が認められ,その後,自発運動の減少が進行して鎮静に至った.また,給餌後の餌こぼしはなく,半眼が認められるようになった.さらに,投与後の時間が経過した後に受動性,チアノーゼ,体表温の低下,鼻汁の大量滴下および被毛汚染が認められた.別の1例は,投与直後に鎮静が認められたが,その後一旦症状が軽減した後,再び鎮静を示した.また,給餌後の餌こぼしはなく,さらに,受動性,チアノーゼおよび体表温の低下が認められた.残りの1例は,投与直後から鎮静が認められ,回復することはなかった.また,半眼が認められ,投与後の時間が経過した後に体表温の低下が認められた.観察第15日まで生存した1例は,投与日には前述の自発運動減少および糞便の性状変化の他に,一過性の鎮静および半眼が認められた.自発運動の減少は観察第3日まで継続して観察されたが,半眼は観察第2日には認められなくなった.しかし,観察第2日から排便の廃絶,鼻汁,被毛汚染,歩行異常,異常呼吸音が観察されるようになった.これらのうち,被毛汚染は観察第4日まで観察されたが,その他は観察第3日まで認められた後回復した.一方,観察第3日から腹部膨満が観察されるようになり,観察終了まで回復することはなかった.また,観察第4日に餌こぼしの増加が一過性に認められた.
雌では,1300 mg/kg以下の被験物質投与群について対照群との差を統計解析した結果,670 mg/kg投与群は,いずれの時期も対照群との間に有意差は認められなかった.930 mg/kg投与群では,観察第2日の値が,また,1300 mg/kg投与群では観察第2および4日の値が,対照群と比べて有意(p<0.05,p<0.01)に低い値を示した.死亡例があったため統計解析を行わなかった1800 mg/kg投与群では,いずれの動物も観察第2日の体重は投与日の体重と比べて減少していた.2500 mg/kg投与群では,生存した1例は観察第2日における体重が投与日の体重と比べて減少していたが,その後増加に転じ,著しく体重が増加して,観察第15日には,生存動物の中で最も重くなった.
雌では,死亡例および生存例のいずれにも肉眼的異常は観察されなかった.
死因については,1800 mg/kg以上の投与群では,死亡動物の剖検において異常は観察されず,死因を特定する変化は認められなかった.一方,投与後の一般状態をみると,1800 mg/kg以上の投与群では,死亡前に鎮静,受動性,体表温の低下あるいはチアノーゼが認められた.臭化リチウムは鎮静剤としても用いられることから2),こうした死亡動物に認められた変化は臭化リチウム中毒による中枢の抑制に起因した変化であると考えられる.これに加え,投与日の死亡例の中には,死亡前に鼻汁の大量滴下や流涙を示す例があった.これらの症状の原因については,本試験の結果から明らかではないが,体液の喪失も死因のひとつと考えられる.投与後の日数がやや経過して死亡した1300 mg/kg投与群の雄には,脾臓の淡色化および小型化が認められた.これらの動物には鎮静が認められていたが,死亡前には自発運動の減少と判断される程度まで回復していた.しかし,絶食後に給餌しても餌こぼしが認められず,摂食行動の廃絶と判断される例や糞便排泄の減少や廃絶が認められるなど,摂食障害があったことから,栄養障害なども死亡に関連しているものと考えられる.
臭化リチウムの毒性の標的としては,すべての臭化リチウム投与群に自発運動の減少および糞便の性状変化が観察されていることから,中枢神経系および消化器系であると推測される.投与直後に見られた常同行動,半眼および歩行異常なども中枢性の変化であると考えられる.また,排便量の減少は,摂食行動の減少と下痢などによる二次的変化であると考えられるが,いずれも観察第5日までに回復した.
体重は雌雄ともに930 mg/kg以上の投与群で観察第4日まで増加が抑制された.1300 mg/kg投与群の雄では,観察第2日に体重が減少したが,その後は体重が増加した.しかし,増加の程度は他の投与群と同様であったため,観察第15日における体重は,対照群の値を下回っていた.一方,雌では,体重増加抑制の認められた930 mg/kgおよび1300 mg/kg投与群は,観察第15日には対照群と同様の体重まで増加していた.さらに,2500 mg/kg投与群の生存例は,観察第4日までは低い体重で推移していたが,その後増加に転じ,体重は著しく増加して,すべての生存例の中で最も重くなった.この例には,腹部膨満が観察されたが,剖検では異常が認められなかったことから,摂食量が増えて腹部が膨満したものと推測された.このように,雄と異なり,雌では,毒性が回復した後,体重増加が亢進する傾向が認められた.リチウム投与によって体重が増加することは,ヒトあるいはラットで報告されている3).ラットでは特にその影響が雌において認められると報告されていることから,本試験の雌の生存例に認められた体重増加亢進も臭化リチウム投与による影響であると考えられる.
| 1) | A. D. Frolova, M. P. Chekunova, V. G. Vasil'kovskii, G. N. Kuz'minskaia, O. A. Teterkina, Medistina truda i promyshlennaia 37(1993)(in Russian, summary in English). |
| 2) | "The Merck Index, an encyclopedia of chemicals, drugs, and biologicals," 11, eds. by S. Budavari, M. J. O'Neil, Merck & Co., Inc., Rahway, 1989, p.870. |
| 3) | T. Baptista, L. Teneud, Q. Contreras, T. Alastre, J. L. Burguera, E. de Baptista, S. Weiss, L. Hern・dez, Pharmacopsychiat. 28, 35(1995). |
| 連絡先 | |||
| 試験責任者: | 代田眞理子 | ||
| 試験担当者: | 田子和美 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Mariko Shirota(Study director) Kazumi Tago | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||