4-メチル-1-ペンテンについて,Salmonella typhimurium TA100,TA1535,TA98,TA1537およびEscherichia coli WP2 uvrAを用いる復帰変異試験を実施した.
用量設定試験の結果に基づき,本試験ではS9 mix非存在下およびS9 mix存在下ともに,菌の生育阻害がみられない用量が4用量以上含まれるよう公比2で46.9〜3000 μg/plateの7用量を設定した.なお,被験物質には揮発性があることから,各菌株とも用量毎にパウチ袋に入れ密封し静置培養を行った.
本試験を2回実施した結果,各菌株のS9 mix非存在下およびS9 mix存在下のいずれの用量においても,陰性対照値の2倍以上となる復帰変異コロニー数の増加はみられなかった.
以上の結果より,4-メチル-1-ペンテンは変異原性を有しないと判断した.
4-メチル-1-ペンテンは沸点が54℃の無色透明の液体で,水にほとんど不溶である.被験物質は,三井化学(山口)よりロット番号3B24A(純度98.36 %)が提供され,遮光,室温,気密条件で保存した.
被験物質はジメチルスルホキシド(DMSO,同仁化学研究所)を用いて溶解ならびに希釈し調製した.被験物質調製時に,変色,発熱,発泡はみられなかった.
下記の陽性対照物質を用いた.
| 2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド | (AF-2:和光純薬工業) | |
| アジ化ナトリウム | (NaN3:和光純薬工業) | |
| 9-アミノアクリジン | (9-AA:Aldrich Chemical) | |
| 2-アミノアントラセン | (2-AA:和光純薬工業) |
AF-2,9-AAおよび2-AAはDMSOに,NaN3は日本薬局方注射用水に溶解し,-20℃以下で凍結保存したものを解凍し使用した.
Salmonella typhimurium TA100,TA1535,TA98,TA1537)およびEscherichia coli WP2 uvrA 2)の5菌株を使用した.これらの菌株は,国立衛生試験所(現 国立医薬品食品衛生研究所)より分与された.試験菌株は,-80℃で凍結保存したものを解凍し使用した.各菌株は,アミノ酸要求性,膜変異rfa特性,紫外線感受性,薬剤耐性ならびに陰性対照物質および陽性対照物質での復帰変異コロニー数を検査し,これらの特性が正常に保持されていることを確認した.
試験菌株は,L字型試験管にニュートリエントブロス(OXOID NUTRIENT BROTH No.2)培地 12 mLを入れ,解凍した保存菌を12 μL接種し,37℃で10時間往復振盪培養を行った.培養終了時に,菌培養液の660 nmの吸光度を比色計で測定し,生菌数が1×10^9 cells/mL以上であることを確認した.
極東製薬工業の最少グルコース寒天培地を用いた.なお,培地1 Lあたりの組成は下記の通りである.
| 硫酸マグネシウム・7水塩 | 0.2 g | |
| クエン酸・1水塩 | 2.0 g | |
| リン酸二カリウム・無水塩 | 10.0 g | |
| リン酸一アンモニウム | 1.92 g | |
| 水酸化ナトリウム | 0.66 g | |
| ブドウ糖 | 20.0 g | |
| 寒天末(OXOID AGAR No.1) | 15.0 g |
径90 mmのシャーレ1枚あたり30 mLを流して固めたものである.
下記の組成のソフトアガーおよびアミノ酸溶液を調製し,使用時に(A):(B)=10:1の容量比で混合した.S.typhimuriumにはL-ヒスチジンおよびD-ビオチンのアミノ酸溶液を,E.coliにはL-トリプトファンのアミノ酸溶液を使用した.
| Bacto Agar(DIFCO) | 0.6 w/v% | |
| 塩化ナトリウム | 0.5 w/v% | |
| L-ヒスチジンおよびD-ビオチン溶液 | 各々0.5 mmol/L | |
| L-トリプトファン溶液 | 0.5 mmol/L |
S9 mixは,S9(キッコーマン),S9 mix用Cofactor(オリエンタル酵母工業)および日本薬局方注射用水を用いて用時調製した.S9は,購入後-80℃以下で保存し,製造日より6カ月以内に使用した.このS9は,フェノバルビタールおよび5,6-ベンゾフラボンの腹腔内投与で酵素誘導したSprague-Dawley系ラットの肝ホモジネートより調製された.
S9 mixの1 mL中の組成は次表の通りである.
| S9 | 0.1 mL | |
| 塩化マグネシウム | 8 μmol | |
| 塩化カリウム | 33 μmo | |
| グルコース-6-リン酸 | 5 μmol | |
| NADPH | 4 μmol | |
| NADH | 4 μmol | |
| リン酸ナトリウム緩衝液,pH 7.4 |
100 μmol |
試験は,プレインキュベーション法によりS9 mix非存在下および存在下で行った.
容量5 mLの小プラスチックチューブを用いて,被験物質調製液あるいは対照物質調製液0.1 mLを,S9 mix非存在下の場合は0.1 mol/L Na-リン酸緩衝液(pH 7.4) 0.5 mLと,S9 mix存在下の場合はS9 mix 0.5 mLと混合した.その混合液に菌培養液0.1 mL を加え,37℃,振幅40 mm,振盪速度100回/分に設定した振盪恒温槽で20分間振盪培養(プレインキュベーション)した.プレインキュベーション終了後,重層用培地を2 mL加えて混和し,最少グルコース寒天培地に重層した.平坦な場所で重層用培地を固化させた後,各菌株の各系列の用量毎にパウチ袋に入れ密封し静置培養を行った.37℃に設定したインキュベーターで48時間の静置培養を行った.
静置培養終了後,各プレートについて被験物質の析出の有無を目視確認し,生育阻害の有無を実体顕微鏡で確認した後,復帰変異コロニー数をコロニーカウンターあるいは実体顕微鏡を用いた目視により計数した.プレート数は,用量設定試験では用量毎に1枚,本試験では用量毎に3枚とし復帰変異コロニー数の平均値±標準偏差をもとめた.
被験物質処理群の復帰変異コロニー数の平均値が陰性対照群の2倍以上となり,かつ用量の増加にともなうコロニー数の増加が認められ,その結果に再現性が認められる場合を陽性とした.
用量設定試験を,被験物質の溶媒に対する溶解性に基づき300 μg/plate を最高用量に公比3の7用量(4.12〜3000 μg/plate)で実施した.その結果,生育阻害がS9 mix非存在下および存在下ともに各菌株の1000 μg/plate以上あるいは3000 μg/plateの用量で観察された.また,被験物質の寒天プレート表面での油膜状の析出が全ての用量で観察された.
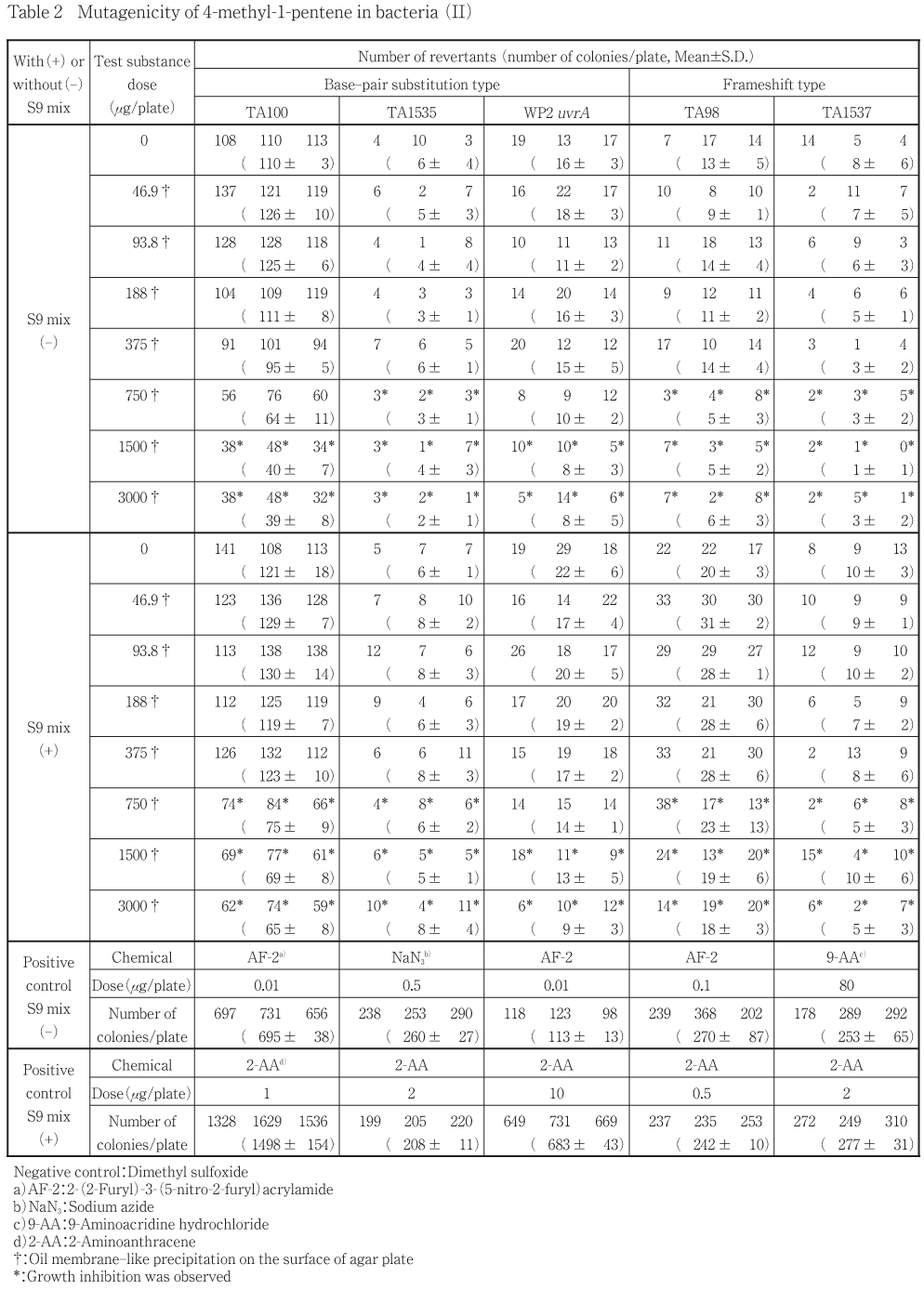
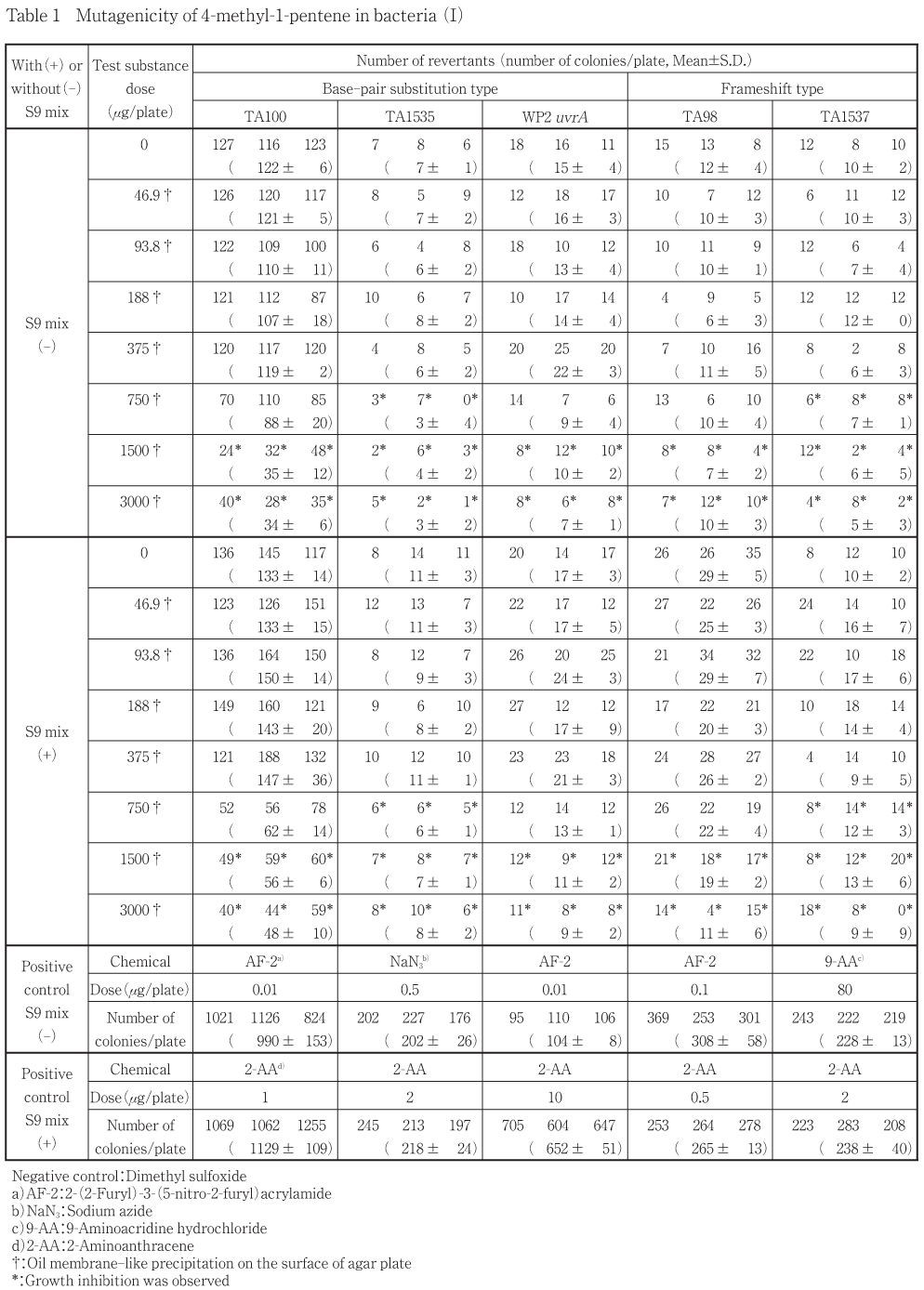
本試験は,用量設定試験結果に基づき,各菌株のS9 mix非存在下および存在下とも3000 μg/plate を最高用量に公比2で7用量(46.9〜3000 μg/plate)を設定し,2回実施した.その結果(Table 1および2),各菌株のS9 mix非存在下および存在下の被験物質処理群の復帰変異コロニー数の平均値は陰性対照群の2倍未満であり,用量の増加に伴う復帰変異コロニーの増加もみられなかった.生育阻害が,S9 mix非存在下および存在下ともに各菌株の750 μg/plate以上の用量あるいは1500 μg/plate以上の用量で観察された.また,被験物質の寒天プレート表面での油膜状の析出が全ての用量で観察された.
陰性対照群の復帰変異コロニー数の平均値は,試験施設の背景データの管理値の範囲内であった.また,陽性対照群の復帰変異コロニー数の平均値は全て陰性対照群の値の2倍以上であった.
以上の結果から,4-メチル-1-ペンテンは,当該試験条件下において試験菌株に対する変異原性を有しないと判断した.
| 1) | Maron DM, Ames BN:Revised methods for the Salmonella mutagenicity test. Mutation Res, 113: 173-215(1983). |
| 2) | Green MH, Muriel WJ: Mutagen testing using TRP+ reversion in Escherichia Coli. Mutation Res, 38: 3-32(1978). |
| 連絡先 | |||
| 試験責任者: | 河村公太郎 | ||
| 試験担当者: | 二平佳苗,小森絵美 | ||
| (株)化合物安全性研究所 | |||
| 〒004-0839 札幌市清田区真栄363番24 | |||
| Tel 011-885-5031 | Fax 011-885-5313 | ||
| Correspondence | |||
| Authors: | Khotaro Kawamura (Study Director) Kanae Nihei, Emi Komori |
||
| Safety Research Institute for Chemical Compounds | |||
| 363-24 Shin-ei Kiyota-ku, Sapporo-shi, 004-0839, Japan | |||
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | ||