4-メチル-1-ペンテンの0,40,200および1000 mg/kgを1群雄雌各12匹のCrj:CD(SD)IGSラットに対して,雄は交配前,交配期間および交配後を含む計42日間,雌は交配前,交配および妊娠期間,ならびに哺育5日までの期間に経口投与し,反復投与による影響と生殖および新生児の発生に及ぼす影響について検討した.また,サテライト群として0(対照群)および1000 mg/kgについて,雄動物は各5匹を選抜し,雌動物は各5匹を別に設け,42日間の投与終了後14日間の休薬による回復性についても併せて検討し,以下の成績を得た.
一般状態,詳細な一般状態観察,機能検査,体重,摂餌量,尿検査および血液学検査では,各投与群の雄雌ともに被験物質投与に関連した変化は認められなかった.
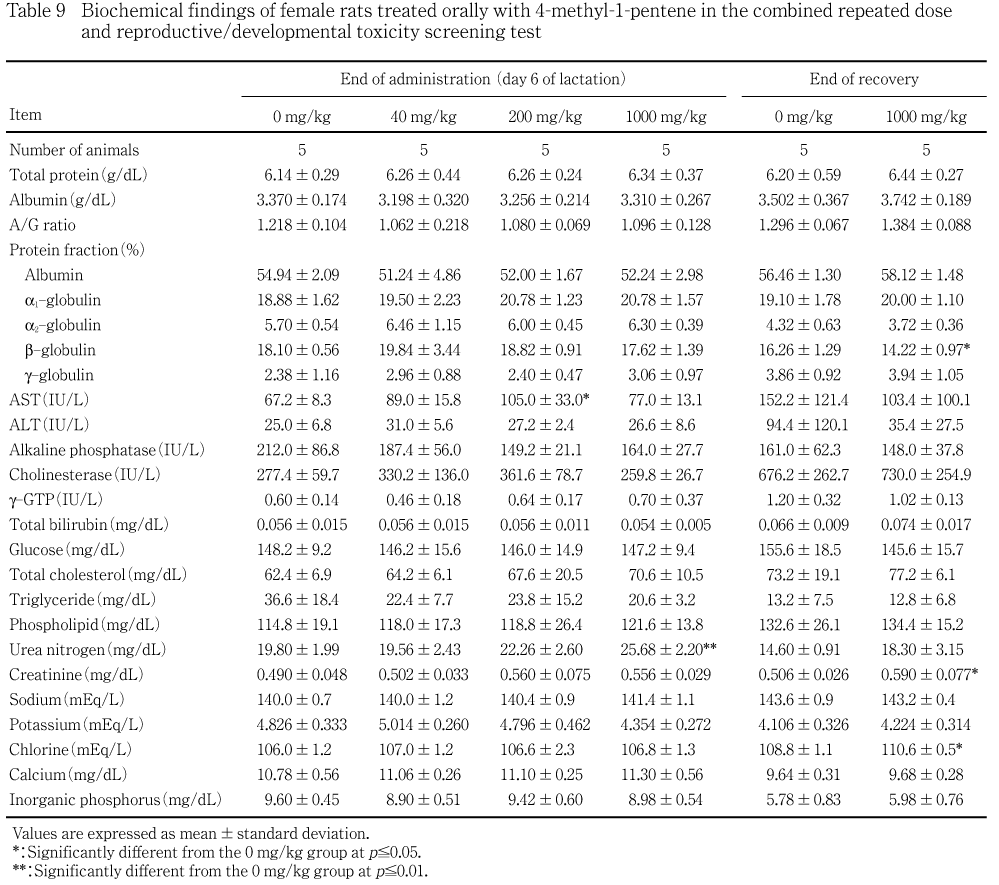
血液生化学検査では,1000 mg/kg群の雌で哺育6日に尿素窒素の高値がみられ,回復終了時にもクレアチニンおよびクロールの高値が認められた.
剖検所見,器官重量および精子形成では,各投与群の雄雌ともに被験物質投与に関連した変化は認められなかった.
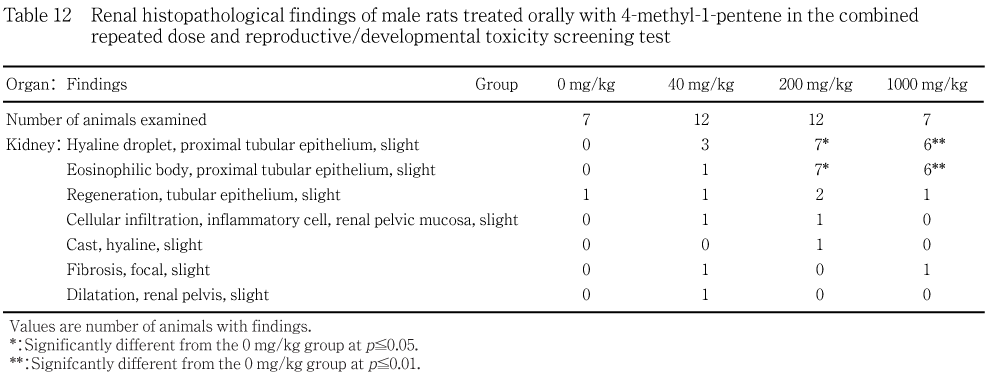
病理組織学所見では,200 mg/kg以上の群の雄で腎臓の軽度な近位尿細管上皮の硝子滴および好酸性小体の用量依存的な増加が認められた.しかし,この変化も2週間の休薬により軽減した.
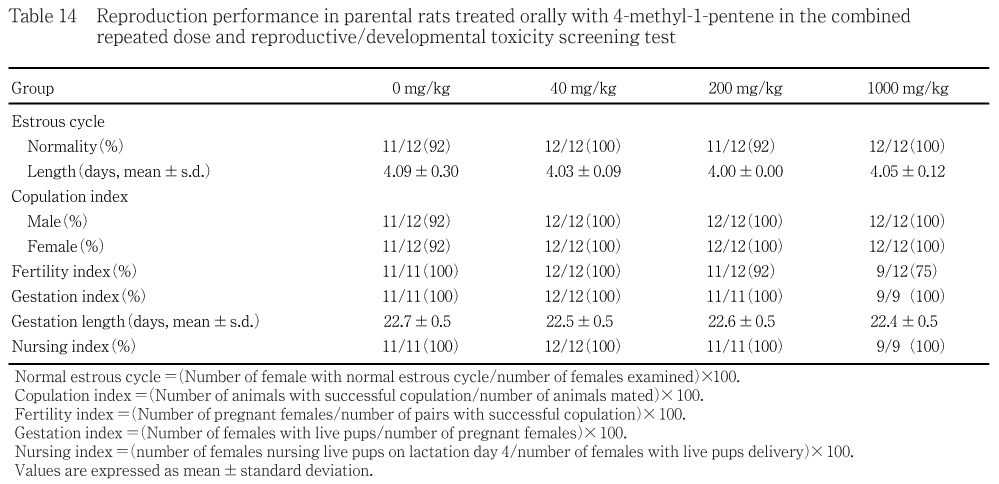
生殖能検査では,雌の性周期,雄雌の交尾率,受胎率,出産率および哺育4日の哺育率に各投与群とも被験物質投与に関連した変化は認められなかった.母動物の黄体数,着床痕数,着床率,分娩率,総出産児数,出産児の性比,哺育0日の生存児数,出生率,哺育4日の生存児数および新生児生存率には,各投与群とも被験物質投与に関連した変化は認められなかった.
新生児の体重で1000 mg/kg群に体重増加抑制傾向が認められたが,各投与群とも一般状態および剖検では,被験物質投与に関連した変化は認められなかった.
以上のことから,本試験条件下における4-メチル-1-ペンテンの反復投与による無毒性量は,雄で40 mg/kg/ day,雌で200 mg/kg/day,親動物の生殖能に対しては1000 mg/kg/day,新生児の発生に対しては200 mg/kg/ dayと考えられた.
4-メチル-1-ペンテン〔ロット番号:3B24A,純度: 98.36 %,提供者:三井化学(山口)〕は,沸点が54℃,蒸気圧が35.6 kPa(267 mmHg)/25℃,融点が-154℃,比重が0.664(20/4℃),蒸気密度が2.9(空気=1),引火点が-25℃,発火点が300℃,溶解性が水にほとんど不溶等の物理化学的性状を示す無色透明の液体である.4-メチル-1-ペンテンは強酸化剤と接触すると激しい反応が起こりうる引火性の物質であることから,受入後は直射日光を避け,火気,熱源より遠ざけて,通風をよくし,蒸気が滞留しないようにして室温,気密条件下で保存した.取り扱いは,眼,皮膚および衣服にふれないように,適切な保護具を着用して行った.4-メチル-1-ペンテンは水に不溶であることから,媒体にはトウモロコシ油を選択した.
被験物質の調製液中における安定性を分析し,室温保存で8日間安定であることを確認した.投与液は,被験物質を所定の濃度となるように媒体中に混和し,均一化させ速やかに遮光気密容器に入れ室温保存し投与に用いた.投与液の調製は,投与期間中に定期的に8回行った.投与液の各濃度を初回,中間および最終回の調製時にGC法で分析し,規定の濃度であることを確認した.
試験には,日本チャールス・リバー厚木飼育センター生産のSPF Crj:CD(SD)IGSラットの雄雌を用いた.雄54匹,雌64匹を8週齢で購入し,馴化飼育後,雄48匹および雌58匹を選抜して10週齢で試験に供した.投与前々日の体重に基づいて層化無作為抽出法により群分けを行った.
動物は温度22 ± 3℃,湿度50 ± 20 %,換気回数10〜15回/時間,照明時間8時〜20時に設定された飼育室で,ブラケット式金属製金網床ケージに,群分け前は2匹,群分け後は1匹,交配中は雄雌各1匹,妊娠期間中は1母動物,哺育期間中は1腹を収容した.なお,交尾後の雌動物については妊娠17日から哺育4日まで実験動物用床敷(日本チャールス・リバー)を使用した.飼料はg線照射固型飼料CRF-1(オリエンタル酵母工業)を金属製給餌器により,飲料水は札幌市水道水を自動給水装置により,それぞれ自由摂取させた.
トウモロコシ油に溶解させた4-メチル-1-ペンテンの0,40,200および1000 mg/kgを1群雄雌各4匹のCrj:CD(SD)IGSラットに,14日間反復経口投与して毒性の概要を検討した結果,一般状態,体重推移,摂餌量,尿検査,血液学検査,血液生化学検査,剖検所見および器官重量のいずれにおいても,各群の雄雌ともに被験物質投与に関連した変化は認められなかった.このことから,予備試験と同様に40,200および1000 mg/kgを低用量,中用量および高用量に設定し,対照を含めた雄雌各4群構成とした.42日間の投与終了後14日間の休薬による回復性について検討するため,サテライト群として対照群および1000 mg/kg投与群から雄は5匹ずつ選抜し,雌は別途に5匹ずつを設けた.
雄および雌のサテライト群については42日間,雌については交配前14日間および交尾までの交配期間,さらに交尾例は妊娠期間および哺育5日までの期間,トウモロコシ油および被験物質を1日1回,9:00から14:00の間に胃ゾンデを用いて強制的に胃内に投与した.投与容量は5 mL/kgとし,各個体の投与液量は投与日に最も近い測定日の体重に基づいて算出した.
全例について,投与開始日を投与1日として起算し投与1日から剖検日までの毎日,生死,外観,行動等を午前(投与前および投与直後)ならびに午後の1日最低3回,回復期間中は午前および午後の最低2回,剖検日は午前中に1回観察した.
全例について,投与開始前ならびに投与期間および回復期間に1回/週の頻度で,ケージ外から姿勢,眼瞼閉鎖,呼吸,振戦・痙攣,常同行動(回転・旋回),異常行動(自傷)について,ケージから取り出す時の取り出し易さ,扱い易さ,筋緊張,立毛,被毛の状態,皮膚,眼球突出,瞳孔径,可視粘膜,流涙,流涎,体温について,オープンフィールド内で痙攣,歩行,覚醒状態,排尿,排糞,常同行動(毛繕い・匂嗅ぎ),異常行動(後方突進・発声),呼吸について,それぞれあらかじめ定めたスコアリング法を用いてそのスコアを記録した.
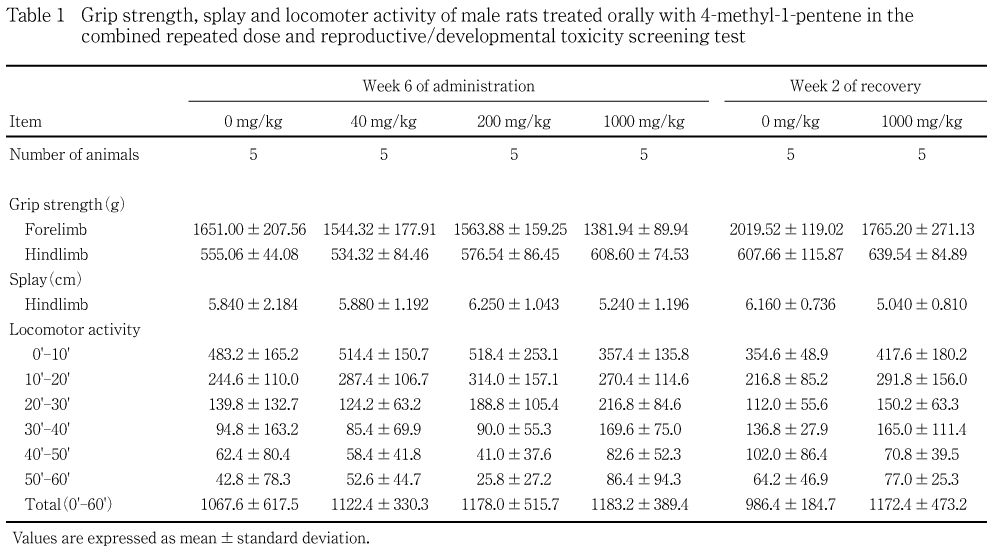
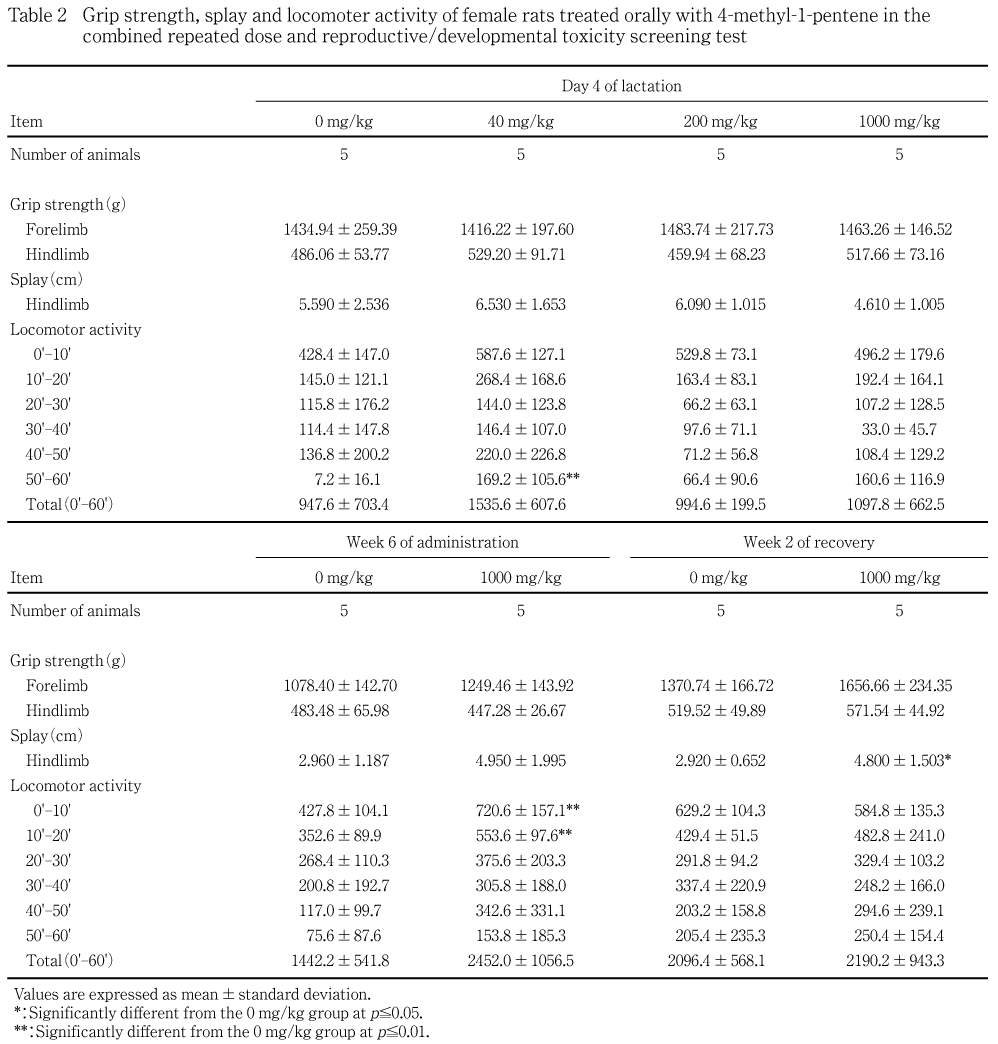
各群5例(サテライト群の動物を含む)について,投与6週および回復2週,雌は哺育4日に,作業台上で視覚(接近反応),触覚(接触反応),聴覚(音に対する反応),痛覚(尾根部を挟む),固有受容反応(強制姿勢からの復帰),空中正向反射についてあらかじめ定めたスコアリング法を用いて観察し,そのスコアを記録した.また,握力および後肢の開脚幅に続き自発運動量を測定した.握力はCPUゲージ(アイコーエンジニアリング)を用いて前肢および後肢の握力を測定し,各3回の平均値を算出した.後肢の開脚幅は後肢の足底に墨汁を塗り,胴を持って30 cm上方から床に落した時の後肢の開脚幅を測定し,2回の平均値を算出した.自発運動量は自発運動量測定システム(室町機械)を用いて測定し,データの収集間隔を10分として1時間測定した.
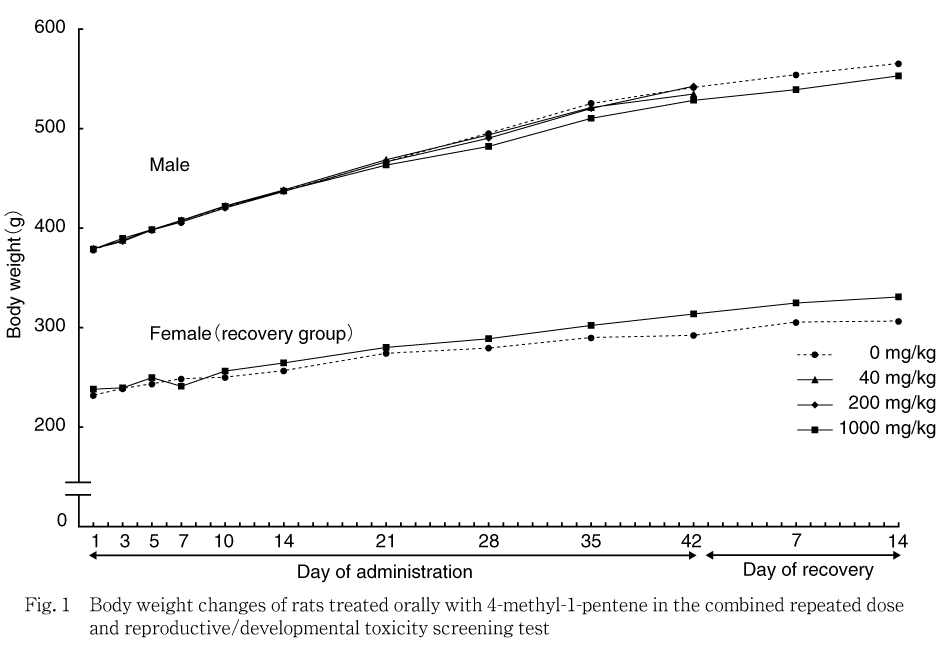
全例について,投与1,3,5,7,10,14,21,28,35および42日の投与前,回復7および14日,雌は投与1,3,5,7,10,14日の投与前,妊娠0,1,3,5,7,10,14,17および20日の投与前,哺育0,1および4日の投与前に電子式上皿天秤を用いて測定した.体重増加量および体重増加率を,雄およびサテライト群の雌については投与1から42日,投与42から回復14日,雌については投与1から14日,妊娠0から20日および哺育0から4日について算出した.
雄雌全例について,交配期間と剖検日および雌の哺育0日を除き,体重測定と同じ日に各ケージの給与量または残量を測定した.飼料消費量を給与日数で除し,各測定日間の1匹当たり1日平均摂餌量(g/day)を算出した.
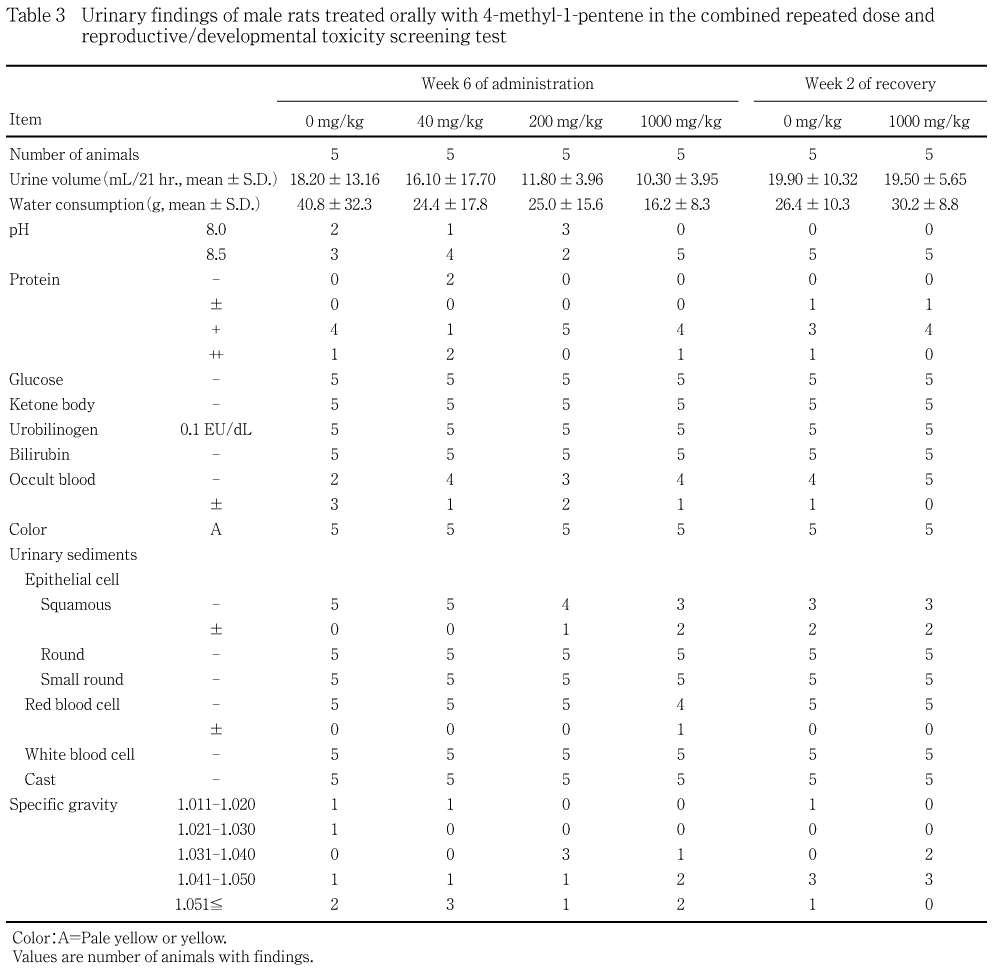
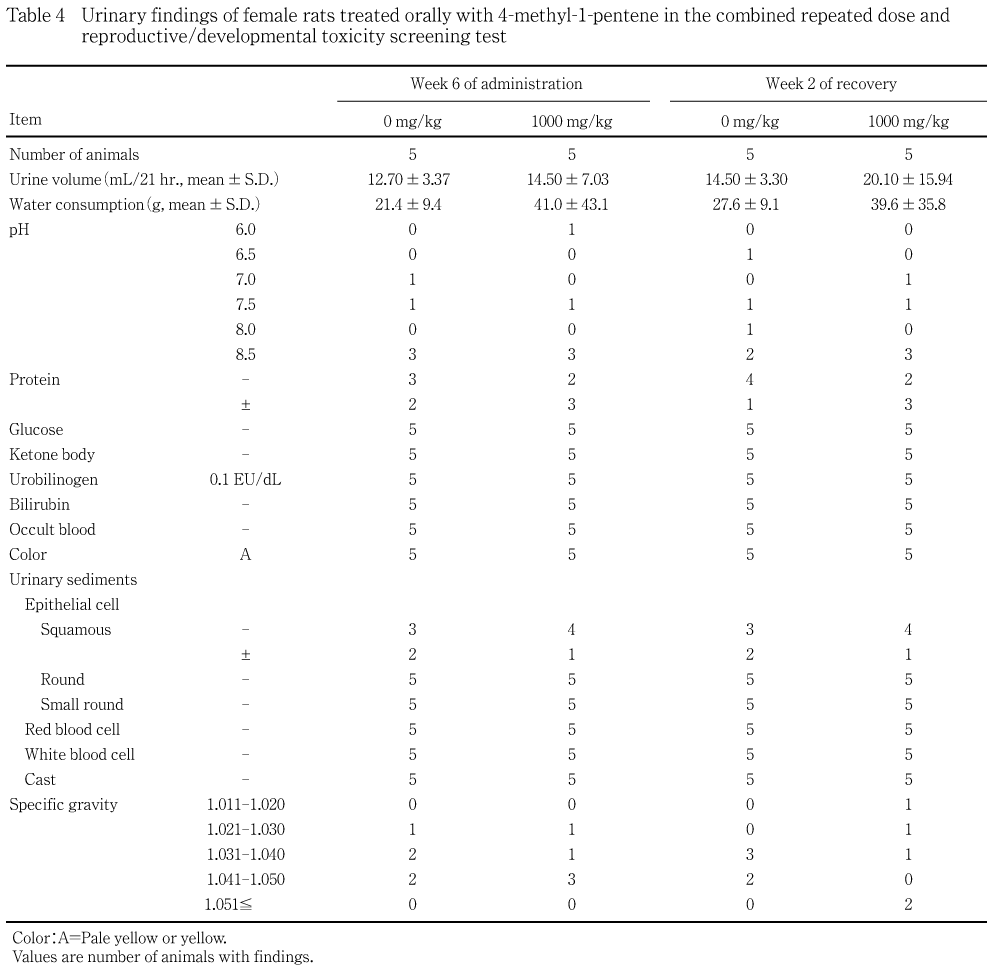
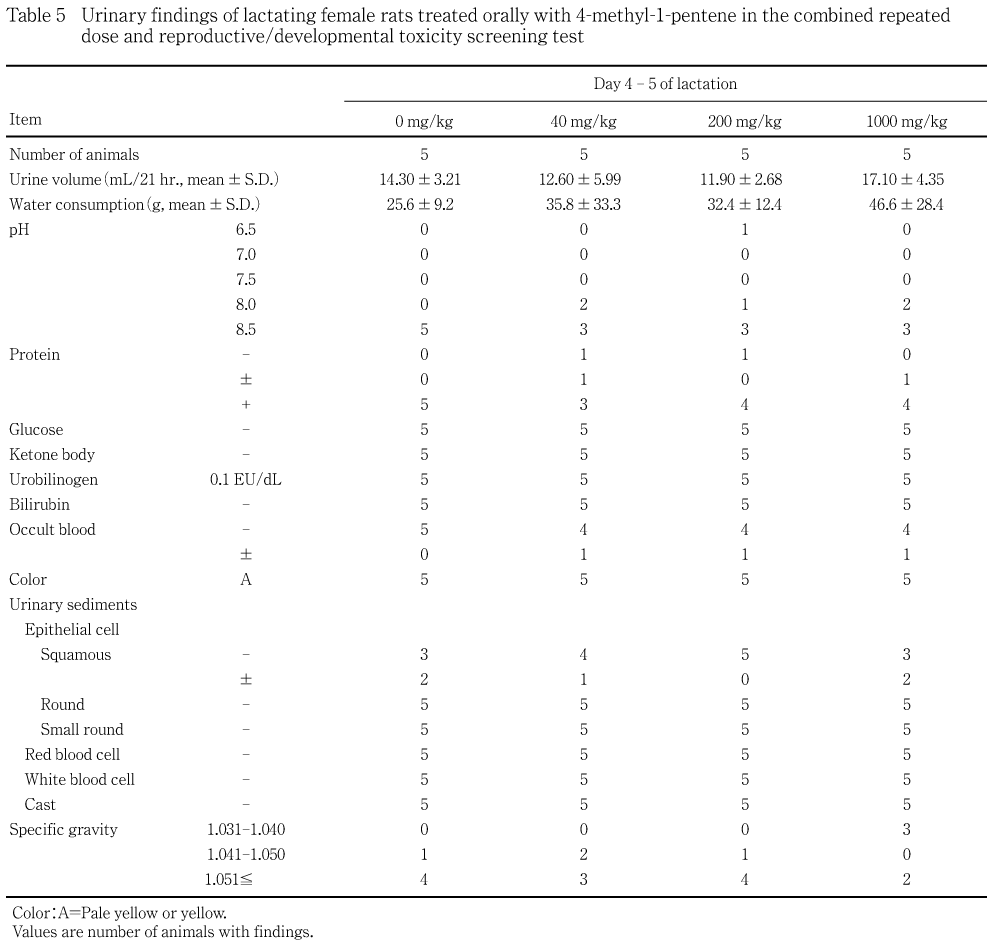
機能検査と同一の各群5例について投与6週,回復2週および哺育4〜5日に,代謝ケージに収容して非絶食下で採尿を行い,同時に採尿中の飲水量(重量)も測定した.3時間前後までに排泄した新鮮尿についてpH,蛋白,糖,ケトン体,ウロビリノーゲン,ビリルビン,潜血反応(以上,マルティスティックス,バイエル メディカル)および色調(肉眼観察)ならびに沈渣(鏡検)を検査し,約21時間の蓄尿について尿量(容量)および比重(屈折計法,アタゴ)を測定した.
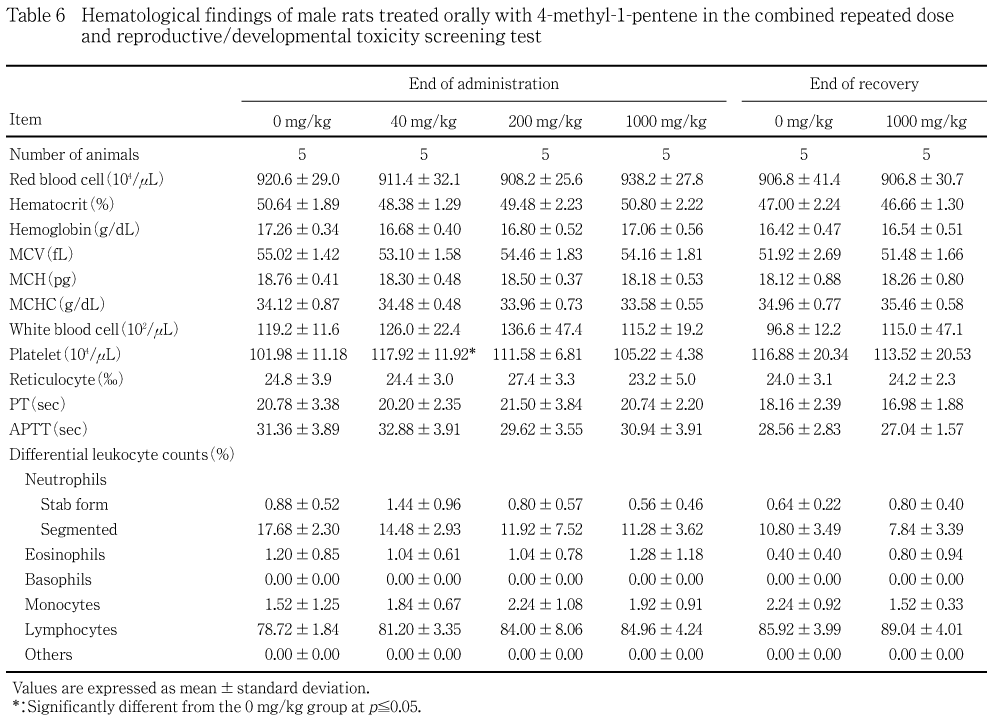
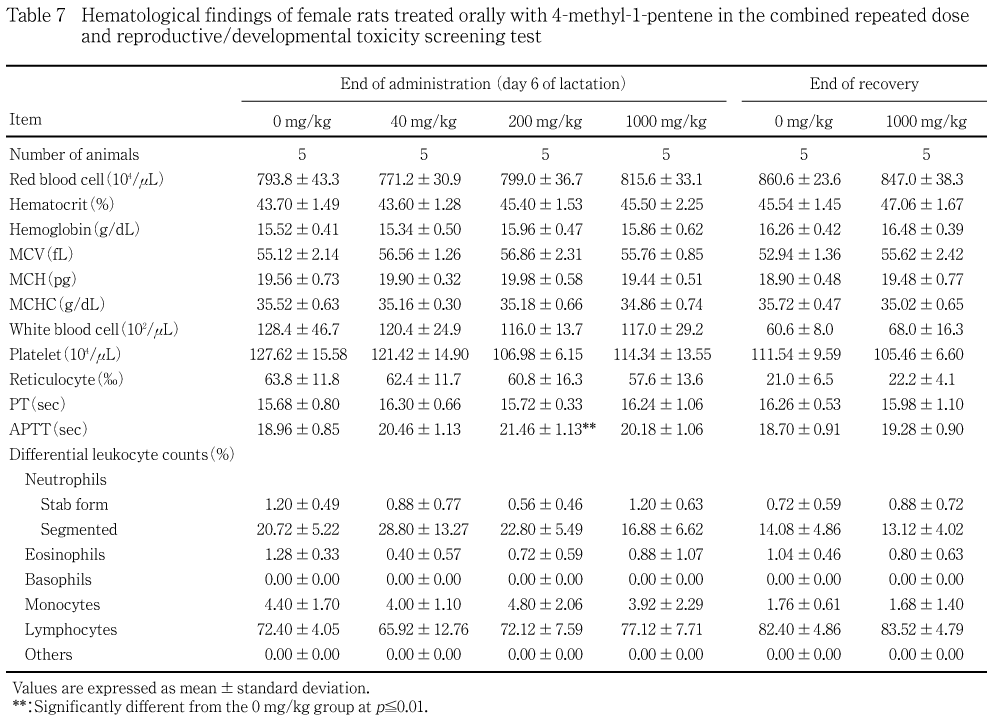
無作為に選抜した各群5例について,剖検日の前日から一晩(16〜21時間)絶食させ,剖検日にエーテル麻酔下で腹部大動脈より採血し,EDTA・2Kで処理した血液を用いて赤血球数,ヘマトクリット値,血小板数,白血球数(以上,電気抵抗法),ヘモグロビン量(シアンメトヘモグロビン法),平均赤血球容積(赤血球数,ヘマトクリット値より算出),平均赤血球ヘモグロビン量(赤血球数,ヘモグロビン量より算出),平均赤血球ヘモグロビン濃度(ヘマトクリット値,ヘモグロビン量より算出)(以上,自動血球計数装置F-820,シスメックス),網赤血球数(Brecher法)および白血球百分比(May- Gr殤wald-Giemsa染色)を測定した.また,3.8 %クエン酸ナトリウムで処理した後,3500 回転/分で10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
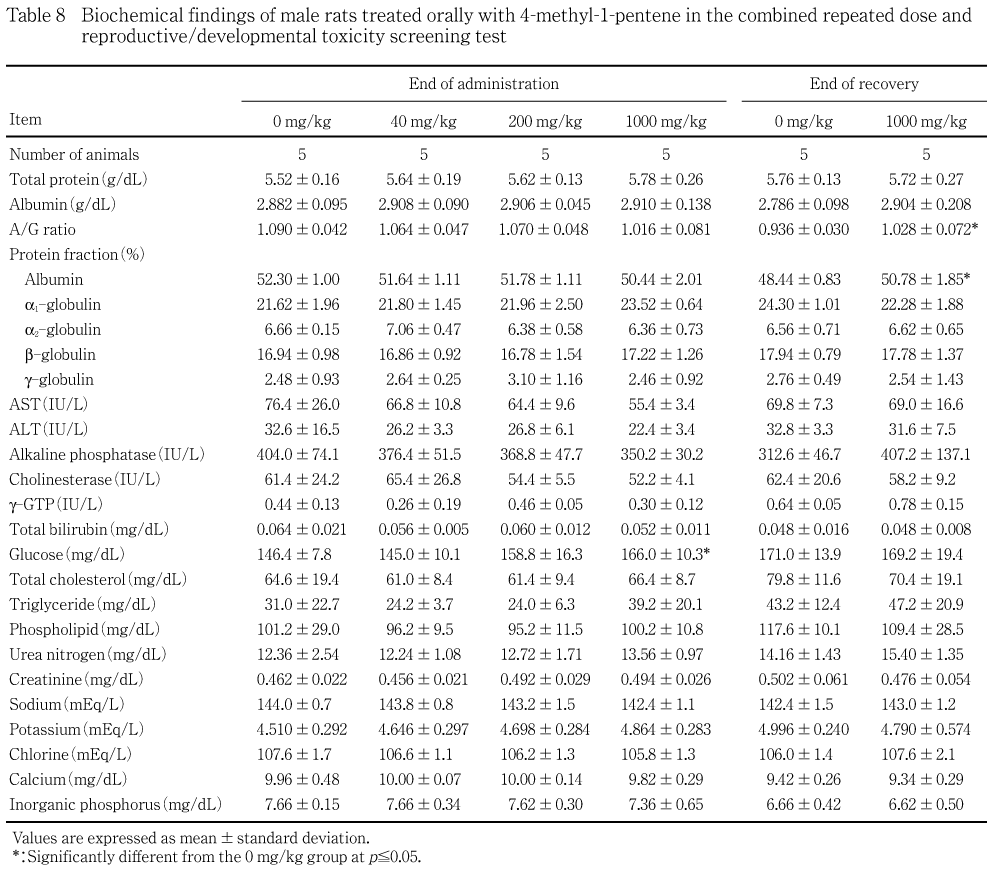
血液学検査と同時に,同一の各群5例について腹部大動脈より採血し,ヘパリン処理した後,3500 回転/分で10分間遠心分離して得られた血漿を用いてAST(JSCC法)およびグルコース(ヘキソキナーゼ法)を測定し,無処理血液を3500 回転/分で10分間遠心分離して得られた血清を用いてALTおよびアルカリホスファターゼ(JSCC法),g-GTP(L-g-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),コリンエステラーゼ(ヨウ化ブチリルチオコリン基質法),総コレステロール(酵素法),リン脂質(COD・DAOS法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・GLDH法),クレアチニン(Jaff事@),カルシウム(OCPC法),無機リン(Fiske-Subba Row法),総蛋白(ビウレット法)(以上,自動分析装置7150形,日立製作所),ナトリウム,カリウム(以上,炎光光度法,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),蛋白分画およびA/G比(以上,セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
サテライト群を除く雄は投与42日の翌日に,雌の分娩例は哺育6日に,妊娠25日まで分娩が認められない交尾例は妊娠26日に,サテライト群は雄雌とも回復14日の翌日に,体重測定後,体外表を観察し,エーテル麻酔下で腹部大動脈から放血して安楽死させ,全身の器官・組織を肉眼的に観察した.また,脳,心臓,肝臓,腎臓,脾臓,副腎,胸腺,精巣,精巣上体,卵巣の重量を測定し,絶対重量を剖検日の体重で除し100を乗じて相対重量を算出した.
全例について剖検時に固定・保存した主要器官・組織をパラフィン包埋後薄切し,ヘマトキシリン・エオジン染色標本を作製し,対照群および高用量群の5例について鏡検した.また,雄では精巣の精子形成について精査し,また雄の腎臓についてa2uグロブリン抗体を用いた免疫組織化学的染色を行った.
雌全例について,投与開始日の 10日前から交尾までの連日,ギムザ染色による膣垢塗抹標本を作製し,光学顕微鏡下で性周期段階(発情前期,発情期,発情後期および発情休止期)の判定を行い,性周期の各段階を4日から6日の間隔で2回以上繰り返すものを正常とし,発情期間隔を算出した.発情休止期が7日以上継続してみられる例は連続非発情とし異常とした.投与14日の夕方から,同試験群内の雄雌を1対1(無作為組合わせ)で同居させた.交尾の成立は,膣内または受皿上に落下した膣栓,あるいは膣垢スメア標本中の精子が確認された場合とし,いずれかが認められた日を妊娠0日とした.妊娠成立の確認を,分娩の有無および剖検時に子宮内の着床痕の有無を調べることによって行った.交尾率〔(交尾した雄雌対の数/同居させた雄雌対の数)×100〕および受胎率〔(受胎した雌数/交尾した雄雌対の数)×100〕を算出した.
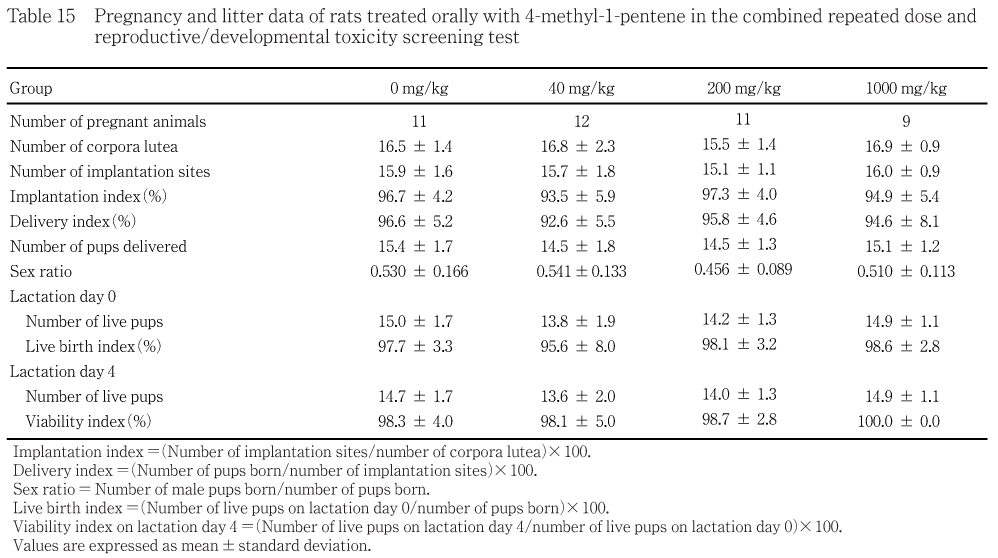
交尾した雌動物は全例自然分娩させた.分娩状態を,妊娠21日から25日まで観察した.9:00に母動物が児を巣の中に集めて腹の下に抱え込んでいる場合に分娩終了とし,その日を哺育0日とした.剖検時に各雌の卵巣の黄体数および子宮内の着床痕の数を肉眼的に数えて記録した.これらの結果から,妊娠期間〔妊娠0日から哺育0日までの日数〕,出産率〔(生児出産雌数/妊娠雌数)×100〕,着床率〔(着床痕数/黄体数)×100〕,分娩率〔(出産児数/着床痕数)×100〕および哺育率〔(哺育4日に哺育児を持つ雌数/生児出産雌数)×100〕を算出した.
哺育0日に,腹毎に生存児数および死亡児数を数え,哺育状態,出産児の性別および外表を観察した.生存児数および死亡児数の合計を出産児数とした.児動物の性は,肛門と生殖突起の間の長さで判定した.哺育1日から哺育4日までは,1日1回,哺育児の生存および死亡を確認し,一般状態および外表について観察した.これらの観察結果から,出生率〔(出産時生児数/出産児数)× 100〕,性比〔雄出産児数/(雄出産児数+雌出産児数)〕および新生児生存率〔(哺育4日生児数/出産生児数)×100〕を1腹単位で算出した.ただし,喰殺あるいは行方不明となった新生児は死亡例として扱った.
全例について,哺育0,1および4日に個体毎に測定し,腹毎に雄雌別の平均体重を算出した.体重増加量および体重増加率を,哺育0から4日について算出した.
死亡例は発見後速やかに剖検した.生存例については,哺育4日に体外表(口腔内を含む)を観察後,二酸化炭素吸入法により安楽死させ,全身の器官・組織を肉眼的に観察した.
性周期の異常の発現率,交尾率,受胎率,出産率,哺育4日の哺育率,ならびに病理組織学検査のうち1段階のグレードが認められた所見については多試料χ2検定を行い,その結果,有意差がみられた場合は2試料χ2検定で解析した.ただし,これらの検定に不適合の場合は Fisherの正確確率検定法を用いた.
詳細な一般状態観察,検査台上の機能検査,尿検査の定性的項目および尿比重の成績,ならびに病理組織学検査のうち2段階以上のグレードが認められた所見についてはKruskal-Wallisの検定法で解析し,有意差がみられた場合は,Mann-WhitneyのU-検定法を用いて解析した.
その他の項目について,Bartlettの検定法によって等分散性を解析し,等分散の場合は,一元配置分散分析法で解析し,有意差がみられた場合は,Dunnettの検定法により解析した.不等分散の場合は,Kruskal-Wallis法で解析し,有意差がみられた場合は,Mann-WhitneyのU-検定法を用いて解析した.なお,新生児の出生率,性比,新生児生存率および雄雌別体重は,1腹を標本単位として処理した.
これら対照群と被験物質投与群との間の検定においては,いずれも有意水準を5 %とした.
対照群,40,200および1000 mg/kg群のいずれにも投与期間中に異常は認められなかった.回復期間中に対照群の1例に眼球の小型および暗赤色化がみられ,病理組織学的にも水晶体の萎縮や脈絡膜,虹彩と毛様体の重度な線維化,軽度なヘモジデリン沈着がみられたが,対照群での所見であり,偶発的な発現と考えられた.
各投与群の雄雌ともに対照群と比較して有意な変化は認められなかった.
サテライト群の1000 mg/kg群の雌で,投与6週に自発運動量の測定開始後0-20分のみの有意な増加がみられ,回復2週にも後肢の開脚幅に有意な高値が認められた.しかし,このような変化は,雄にはなく,同用量群の雄雌ともにその他の機能検査や握力等に変化がみられていないことから,被験物質投与と関連性のない変化と判断された.40 mg/kg群の哺育4日の母動物で,自発運動量の測定開始後50-60分にのみ有意な高値がみられたが,この変化も用量依存性がないことから,被験物質投与との関連性がない変化と判断された.
各投与群の雄雌ともに対照群と比較して有意な差は認められなかった.

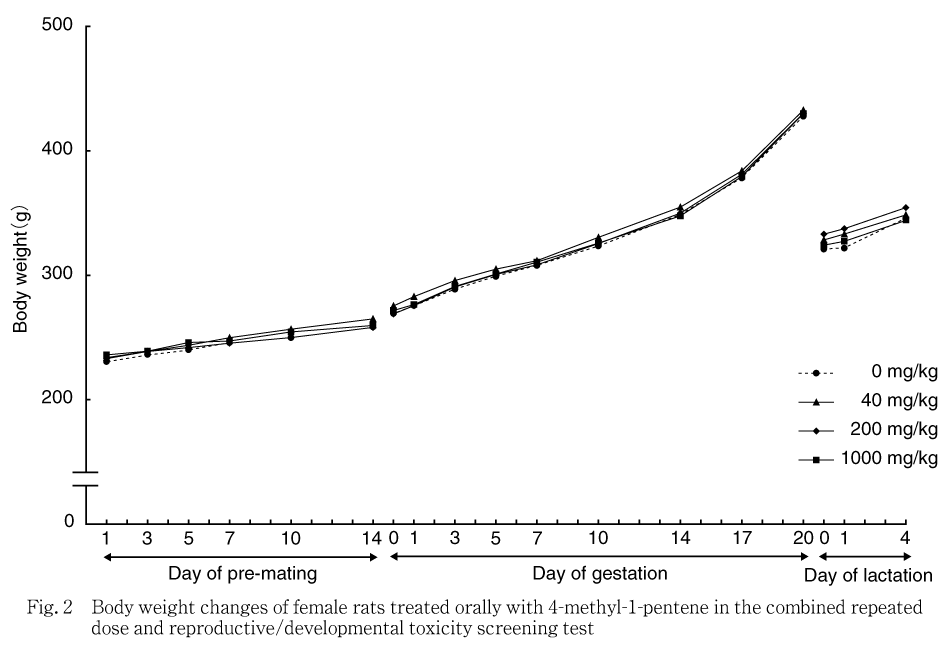
各投与群の雄雌ともに対照群と比較して有意な差は認められなかった.
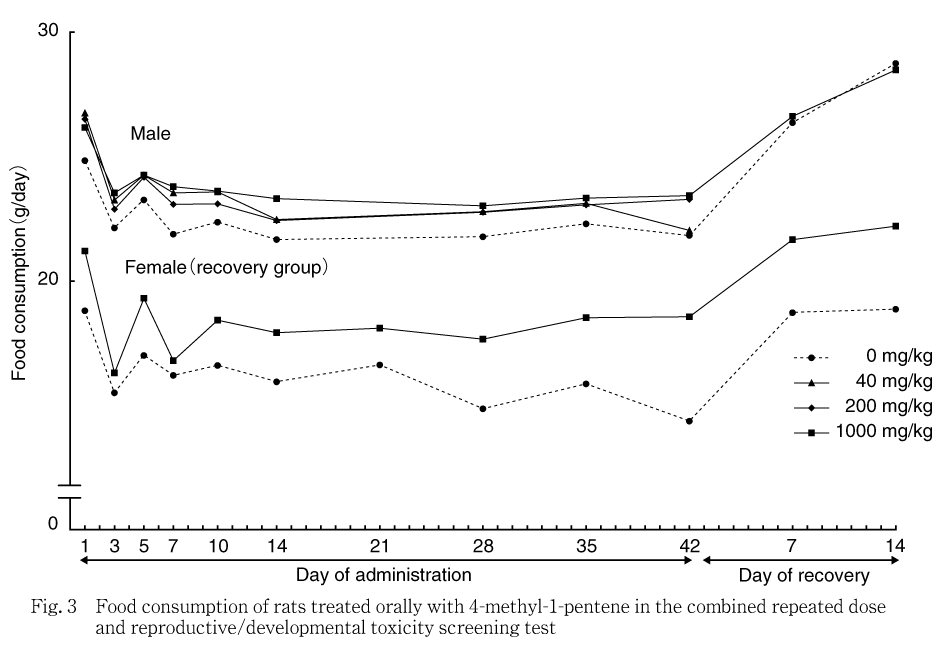
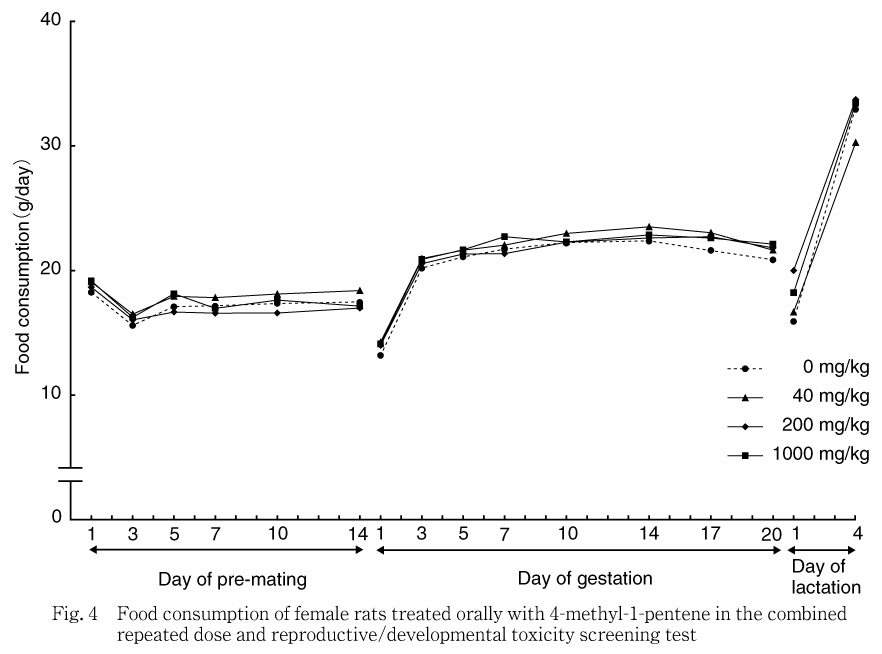
各投与群の雄雌ともに対照群と比較して有意な差は認められなかった.
投与終了時に40 mg/kg群の雄で血小板数の対照群と比較して有意な高値,哺育6日に200 mg/kg群の雌で活性化部分トロンボプラスチン時間の有意な延長がみられたが,いずれも用量依存性がないことから,被験物質投与に関連した変化ではないと判断された.
40および200 mg/kg群ではいずれの検査項目にも対照群と比較して有意な変化は認められなかった.1000 mg/kg群の雌で哺育6日に尿素窒素の対照群と比較して有意な高値がみられ,回復終了時にもクレアチニンおよびクロールの有意な高値が認められた.
なお,1000 mg/kg群の雄で投与終了時にグルコースの有意な高値,回復終了時にアルブミン分画比とA/G比の有意な高値,1000 mg/kg群の雌でb-グロブリン分画比の有意な低値がみられたが,総蛋白質,脂質系,凝固系や酵素系などの肝機能検査値や肝臓の病理組織学検査でこれらの変化と関連する異常はみられなかった.また,200 mg/kg群の雌で哺育6日にASTの有意な高値がみられたが,用量依存性はなく,これらは被験物質投与と関連性のない変化と判断された.
各投与群の雄雌とも被験物質投与に関連した変化は認められなかった.
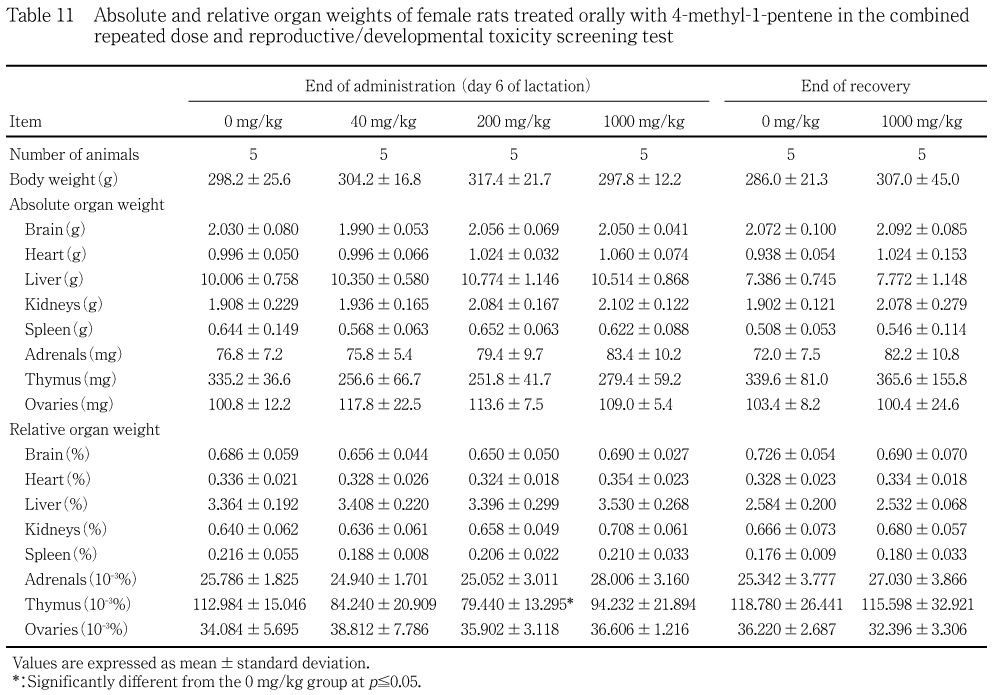
哺育6日に200 mg/kg群の雌に胸腺の相対重量に有意な低値が認められたが,この変化には用量依存性がなく,被験物質投与との関連性はないと判断された.
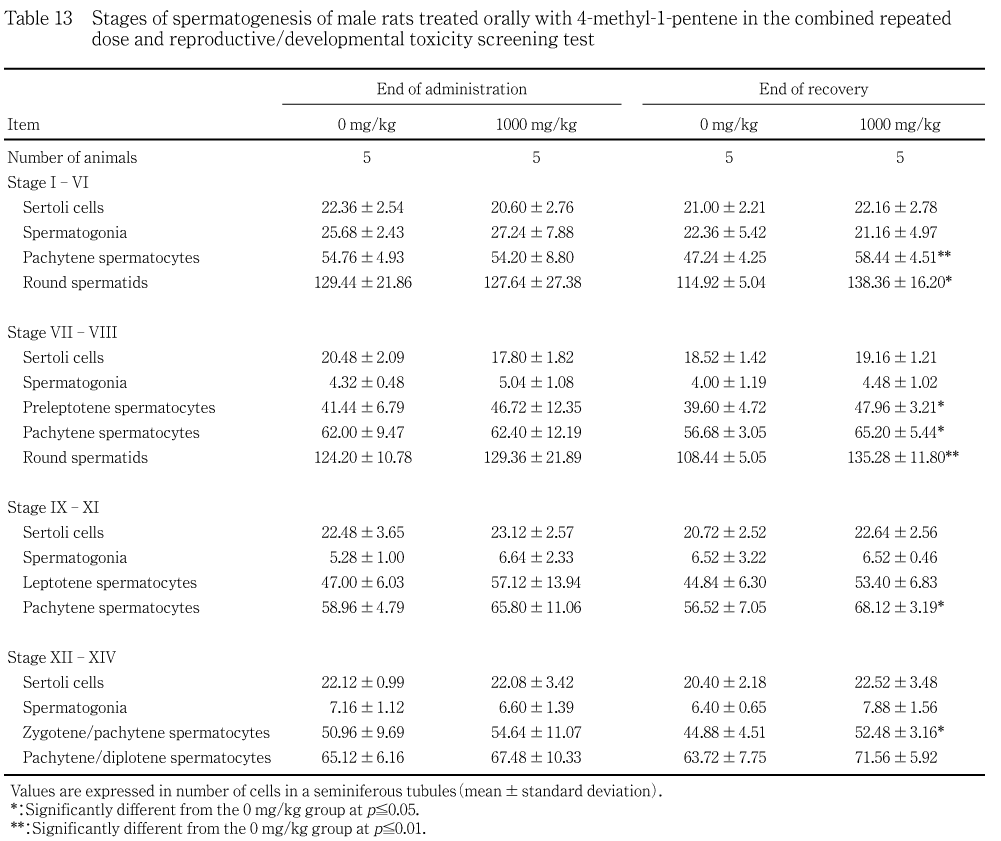
雄で腎臓に軽度な近位尿細管上皮の硝子滴が40 mg/kg群で3例,200 mg/kg群で7例,1000 mg/kg群で6例に,また軽度な近位尿細管上皮の好酸性小体が40 mg/kg群で1例,200 mg/kg群で7例,1000 mg/kg群で6例にみられ,いずれの所見も200 mg/kg以上の群に対照群と比較して有意な差が認められた.なお,免疫組織学検査でa2uグロブリンの陽性反応が認められた.他には,被験物質投与に関連した所見あるいは発現頻度の増加を示す所見は雌雄ともに認められなかった.精巣の精子形成では,回復終了時に1000 mg/kg群で複数のステージにおいて精母細胞と精子細胞の有意な高値がみられたが,投与終了時には変化が認められていないことや生殖能にも異常がないことから,これらは被験物質投与と関連性のない変化と判断された.
正常性周期を示す雌の出現率,発情期間隔,交尾率,受胎率,出産率,妊娠期間および哺育4日時哺育率には各投与群とも対照群と比較して有意な差は認められなかった.
黄体数,着床数,着床率,分娩率,総出産児数,出産児の性比,哺育0日の生存児数,出生率,哺育4日の生存児数および新生児生存率には,各投与群とも対照群と比較して有意な差は認められなかった.
分娩終了確認時の死亡児あるいは不明例が対照群の雄で3例と雌に1例,40 mg/kg群の雄で6例と雌に2例,200 mg/kg群の雄で1例と雌に2例,1000 mg/kg群の雌で2例みられた.哺育4日までの期間の死亡児は対照群の雄で2例と雌に1例,40 mg/kg群の雄で1例と雌に2例,200 mg/kg群の雌で2例みられた.死亡児および生存児ともミルクバンドのみられない例が各投与群に散見されたが,他には異常は認められなかった.
40および200 mg/kg群では,生後0,1および4日のいずれも雄雌とも対照群と比較して有意な差は認められなかった.1000 mg/kg群では,雄で生後1日にのみ有意な低値が認められた.
死亡児では,対照群の雄雌各1例,40 mg/kg群の雄1例および200 mg/kg群の雌1例に自己融解が認められたが,他の例に異常は認められなかった.哺育4日の生存児では,40 mg/kg群の雄で大脳の脳室拡張と胸郭の変形が各1例に,1000 mg/kg群の雄1例で肝臓の外側左葉に黄色部がみられたが,その他の例には異常は認められなかった.
血液生化学検査において,1000 mg/kg群の雌で哺育6日に尿素窒素の有意な高値が認められ,回復終了時にもクレアチニンおよびクロールの有意な高値が認められた.しかし,雌の腎臓に病理組織学所見はみられず,その発現機序については明らかでなかった.
病理組織学検査では,投与終了時に200 mg/kg以上の群の雄で腎臓に軽度な近位尿細管上皮の硝子滴および好酸性小体の有意な増加が認められた.この変化には用量依存的に増加する傾向がみられ,被験物質投与に関連した変化と考えられたが,免疫組織学検査によりa2uグロブリンの陽性反応が確認されたこと,ラットの雄ではa2uグロブリンの増加により慢性腎症が発生すること,また,a2uグロブリンによる変化は種特異性が強いこと等を考慮すると,この変化はラットの雄に特有の変化であると考えられた.
一般状態,詳細な一般状態観察,機能検査,体重推移,摂餌量,尿検査,血液学検査,剖検所見および器官重量では,いずれも被験物質投与に関連した変化は認められなかった.
雄雌の生殖能検査や母動物の妊娠,分娩,哺育状態等については,各投与群とも被験物質投与に関連した変化は認められなかった.
新生児では,出生後の体重に雄雌とも低値傾向がみられ,生後1日の雄の体重では1000 mg/kg群で有意な差もみられ,被験物質投与との関連性が考えられた.しかし,出生児の生後4日の体重には有意な差が認められないことから,哺育あるいは出生児の成長については被験物質投与による影響は極く軽微なものと推察された.
以上のように,被験物質の反復投与に関連した変化として,雄では200 mg/kg以上の群で腎臓の軽度な近位尿細管上皮の硝子滴および好酸性小体の用量依存的な増加,雌では哺育6日に1000 mg/kg群で尿素窒素の有意な高値が認められ,腎臓に対する影響が示唆された.回復終了時の雄には同様の変化がみられないことから休薬による回復性が示唆されたが,雌ではクレアチニンやクロールの有意な高値がみられていることから,回復にはより長期間が必要と考えられた.一方,親動物の生殖能ついては各投与群ともに被験物質に関連した変化は認められなかったが,新生児の発生については1000 mg/kg投与群で体重増加抑制傾向が認められた.
したがって,本試験条件下における4-メチル-1-ペンテンの反復投与による無毒性量は雄で40 mg/kg/day,雌で200 mg/kg/day,親動物の生殖能に対しては1000 mg/kg/day,新生児の発生に対しては200 mg/kg/dayと考えられた.
| 連絡先 | |||
| 試験責任者: | 須永昌男 | ||
| 試験担当者: | 木口雅夫,平田輝仁,笠原みゆき, 牧野宏美,平田真理子,古川正敏 | ||
| (株)化合物安全性研究所 | |||
| 〒004-0839 札幌市清田区真栄363番24 | |||
| Tel 011-885-5031 | Fax 011-885-5313 | ||
| Correspondence | |||
| Authors: | Masao Sunaga (Study director) Masao Kiguchi, Teruhito Hirata, Miyuki Kasahara, Hiromi Makino, Mariko Hirata, Masatoshi Furukawa |
||
| Safety Research Institute for Chemical Compounds Co., Ltd. | |||
| 363-24 Shin-ei, Kiyota-ku, Sapporo, Hokkaido, 004-0839, Japan | |||
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | ||