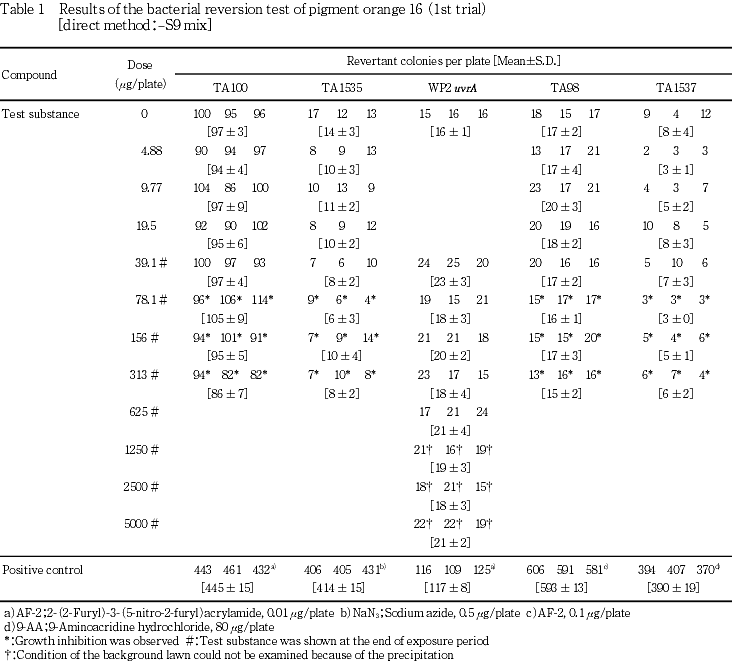
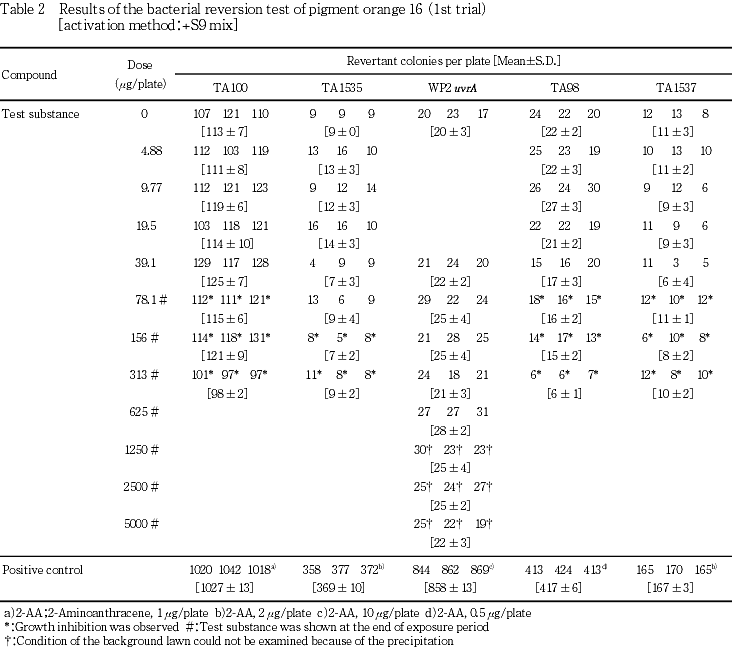
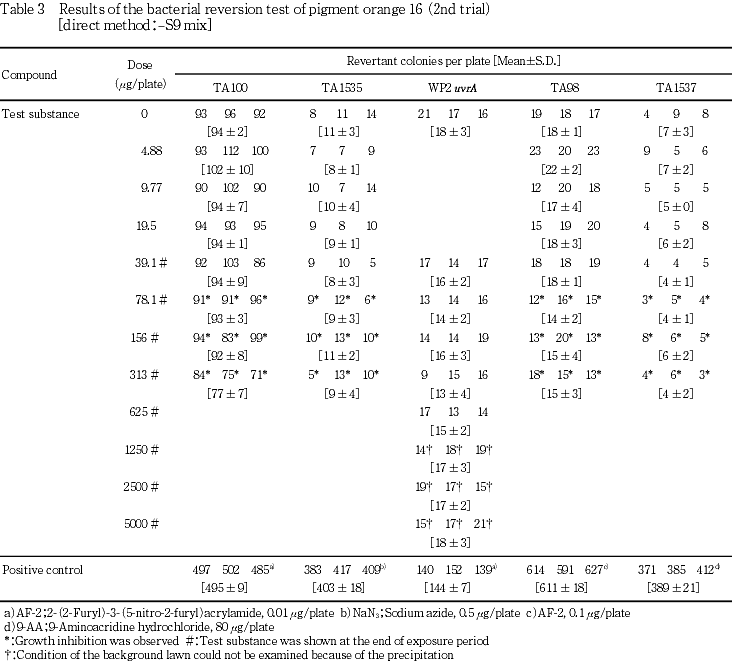
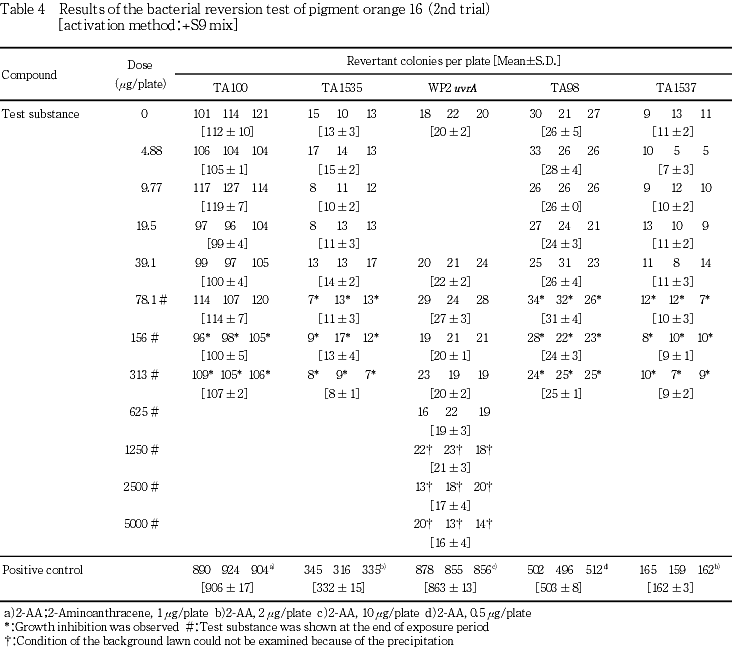
検定菌として,Salmonella typhimurium(TA100,TA98,TA1535,TA1537)およびEscherichia coli(WP2 uvrA)の5菌株を用いた.試験は2回繰り返して実施し,S9 mix無添加群および添加群のTA100,TA1535,TA98ならびにTA1537で4.88〜313 μg/plateの7用量,S9 mix無添加群および添加群のWP2 uvrAで39.1〜5000 μg/plateの8用量で試験を実施した.
その結果,S9 mix無添加群および添加群のいずれにおいても,溶媒対照に比べ復帰突然変異コロニー数の明確な増加は認められなかった.
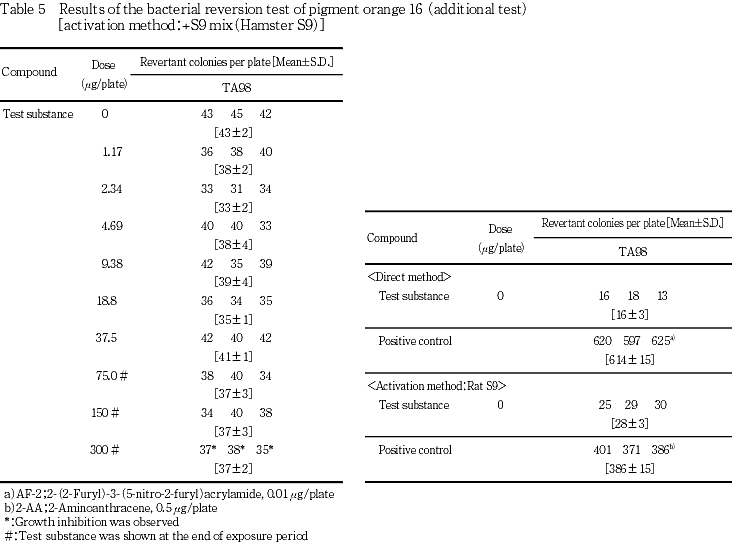
しかしながら,ピグメントオレンジ16のアゾ基の還元により生成されるo-ジアニシジンについてAmes試験陽性との報告があることから,アゾ基の還元を促進する代謝活性化系を用い,TA98のみの追加試験を実施した.1.17〜300 μg/plateの9用量でピグメントオレンジ16の処理を実施した結果,復帰突然変異コロニー数の増加は認められなかった.
以上の結果より,本試験条件下ではピグメントオレンジ16は,変異原性を有しない(陰性)と結論した.
ネズミチフス菌は昭和58年9月9日にカリフォルニア大学のB. N. Ames教授から,また,大腸菌については昭和58年3月16日に国立衛生試験所(現:国立医薬品食品衛生研究所)から分与を受けた.平成11年6月29日ならびに平成11年9月28日に菌株の特性検査を実施し,本試験に用いた菌株が規定の特性を保持していることを確認した.
各菌株の菌懸濁液はジメチルスルホキシド(DMSO:MERCK KGaA)を添加した後,凍結保存用チューブに0.2 mLずつ分注した.これを液体窒素を用いて凍結し,超低温フリーザーに-80 ℃で保存した.
製造後6ヵ月以内のキッコーマン(株)製S9 mixを試験に使用した.S9 mix中のS9は誘導剤としてフェノバルビタールおよび5,6-ベンゾフラボンを投与したSprague-Dawley系雄ラットの肝臓から調製されたものである.S9 mixの組成を次に示す.
| 成 分 | S9 mix 1 mL中の量 |
| S9 | 0.1 mL |
| MgCl2 | 8 μmol |
| KCl | 33 μmol |
| G-6-P | 5 μmol |
| NADPH | 4 μmol |
| NADH | 4 μmol |
| Na-リン酸緩衝液(pH 7.4) | 100 μmol |
| 精製水 | 残 量 |
(ハムスター)
製造後6ヵ月以内のオリエンタル酵母工業(株)製S9を試験に使用した.S9 mix中のS9は無誘導のSyrian系雄ハムスターの肝臓から調製されたものである.S9 mixの組成を以下に示す.
| 成 分 | S9 mix 1 mL中の量 |
| S9 | 0.3 mL |
| MgCl2 | 8 μmol |
| KCl | 33 μmol |
| G-6-P | 20 μmol |
| G-6-P脱水素酵素 | 2.8 unit |
| NADH | 2 μmol |
| NADP | 4 μmol |
| FMN | 2 μmol |
| Na-リン酸緩衝液(pH 7.4) | 100 μmol |
| 精製水 | 残 量 |
従って,本試験においてはS9 mix無添加群ならびに添加群のTA100,TA1535,TA98およびTA1537で313 μg/plate,WP2 uvrAで5000 μg/plateを最高用量とし,それぞれ7〜8用量(公比2)を設定した.また,追加試験においては,本試験の結果を参考に300 μg/plateを最高用量とし,9用量(公比2)を設定した.
なお,統計学的手法を用いた検定は実施しなかった.
一方,陽性対照物質はそれぞれの試験菌株において,溶媒対照群の2倍以上の復帰突然変異コロニーを誘発した.なお,コロニー計数時,ラットS9 mix無添加群の9.77 μg/plate以上,ラットS9 mix添加群の19.5 μg/plate以上および追加試験の37.1 μg/plate以上でプレート表面がオレンジ色を呈していた.また,ラットS9 mix無添加群の39.1 μg/plate以上で膜状の析出物が認められた.さらに,被験物質液の懸濁処理のためラットS9 mix無添加群では156 μg/plate以上,同S9 mix添加群では78.1 μg/plate以上,追加試験では75.0 μg/plate以上の用量で被験物質の残存が認められた.
なお,ピグメントオレンジ16と類似構造を示す3,3'-ジクロロベンジジンの誘導体であるピグメントイエロー12については,アゾ基の還元を促進する代謝活性化系を用いたAmes試験で陰性との報告5)があった.ピグメントイエロー12の特徴は,水やあらゆる有機溶媒に対して不溶であり,ピグメントオレンジ16も同様の溶解性を示した.従って,アゾ化合物の不溶性が,アゾ基の還元の妨害になっているものと推察される.また,ピグメントイエロー12を経口投与されたラットおよびマウスは,発ガンしなかったとの報告5)もあることから,不溶性アゾ化合物は,生体内においても十分なアゾ基の還元が行われないものと思われる.
以上の試験結果から,本試験条件下において,ピグメントオレンジ16の微生物に対する遺伝子突然変異に関し,陰性と判定した.

| 1) | D. M. Maron and B. N. Ames, Mutat. Res., 113, 173(1983). |
| 2) | M. H. L. Green and W. J. Muriel, Mutat. Res., 38, 3(1976). |
| 3) | 労働省労働基準局安全衛生部化学物質調査課監修,“労働安全衛生法有害性調査制度に基づく既存化学物質変異原性試験データ集,”日本化学物質安全・情報センター,東京,1996, p.184. |
| 4) | Z. You, M. D. Brezzell, S. K. Das, M. C. Espadas-Torre, B. H. Hooberman and J. E. Sinsheimer, Mutat. Res., 319(1), 19(1993). |
| 5) | M. J. Prival, S. J. Bell, V. D. Mitchell, M. D. Peiperl and V. L. Vaughan, Mutat. Res., 136, 33(1984). |
| 連絡先 | |||
| 試験責任者: | 益森勝志 | ||
| 試験担当者: | 植田ゆみ子,北澤倫世 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田郡福田町塩新田582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | ||||
| Authors: | Shoji Masumori(Study Director) Yumiko Ueta, Michiyo Kitazawa | |||
| Biosafety Research Center, Foods, Drugs and Pesticides(An-pyo Center) | ||||
| 582-2 Shioshinden , Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan | ||||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |||