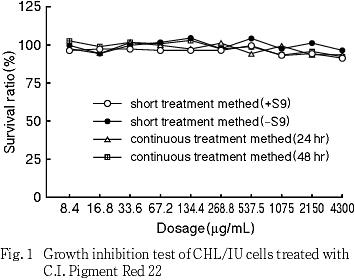
染色体異常試験に用いる濃度を決定するため,4300 μg/mL(10mM相当)を最高濃度として細胞増殖抑制試験を行った結果,連続処理法(24および48時間)と,短時間処理法(6時間,S9 mix添加および無添加)とも最高濃度において細胞毒性は認められなかったが,いずれの処理群も268.8 μg/mL以上の濃度において,処理終了時に被験物質の析出物が認められた.このことから試験濃度は,いずれの処理群も析出物が認められる濃度が2濃度以上含まれるように37.5〜600 μg/mLの5濃度設定した.また,媒体として無水エタノールを用いたため,無処置対照を設け,試験系に及ぼす無水エタノールの影響を検討した.
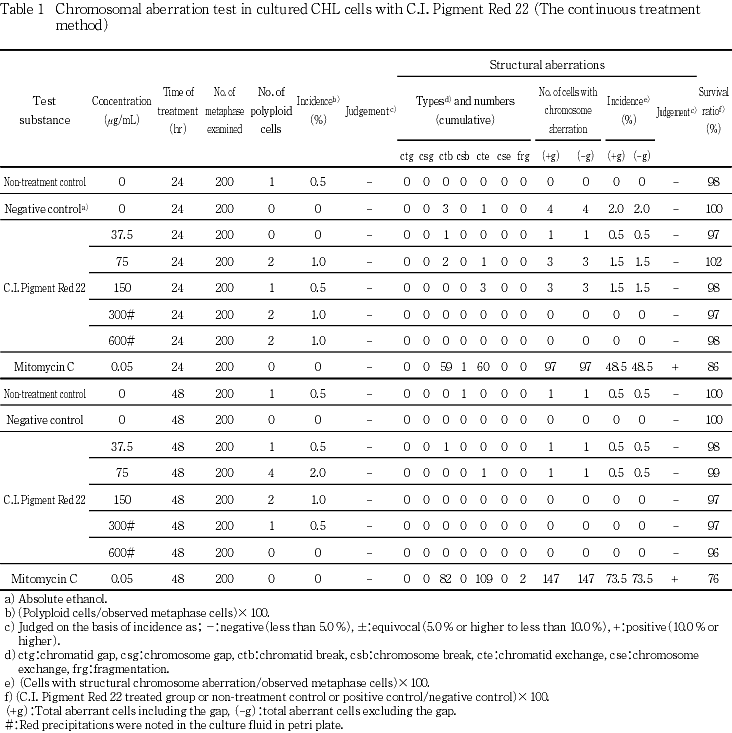
試験の結果,連続処理法ならびに短時間処理法のいずれの処理群においても,染色体の構造異常,倍数性細胞の誘発作用は認められなかった.また,媒体として用いた無水エタノールは無処置対照群と同様な値を示し,試験系に及ぼす影響は認められなかった.
以上の結果より,C.I.ピグメントレッド22は,上記の試験条件下で染色体異常を誘発しない(陰性)と判定する.
連続処理法では,細胞播種3日後に被験物質を加え,24および48時間処理した.また,短時間処理法では,細胞播種3日後に被験物質を加え,S9 mix添加および無添加で6時間処理し,処理終了後,新鮮な培養液でさらに18時間培養した.
その結果,連続処理法(24および48時間処理)および短時間処理法(S9 mix添加および無添加)とも最高濃度の4300 μg/mL(10 mM相当)において細胞の増殖抑制は認められなかったが,268.8 μg/mL以上の濃度において,いずれの処理群も処理終了時に被験物質の析出が認められた(Fig. 1).

陽性対照として,連続処理法には,マイトマイシンC(MMC,協和醗酵工業(株))を0.05 μg/mL,短時間処理法のS9 mix添加には,ジメチルニトロサミン(DMN,和光純薬工業(株))を500 μg/mL,S9 mix無添加には,MMCを0.1 μg/mLの濃度で用いた.なお,代謝活性化の妥当性を保証するため,S9 mix無添加においてDMN(500 μg/mL)を設けた.
いずれの処理群も,各濃度3枚のディッシュに処理し,2枚を染色体標本作製,1枚を細胞増殖計測用に用いた.
なお,構造異常はギャップのみを有する細胞を含めない(-gap)場合について判定した.
また,統計学的手法を用いた検定は実施しなかった.
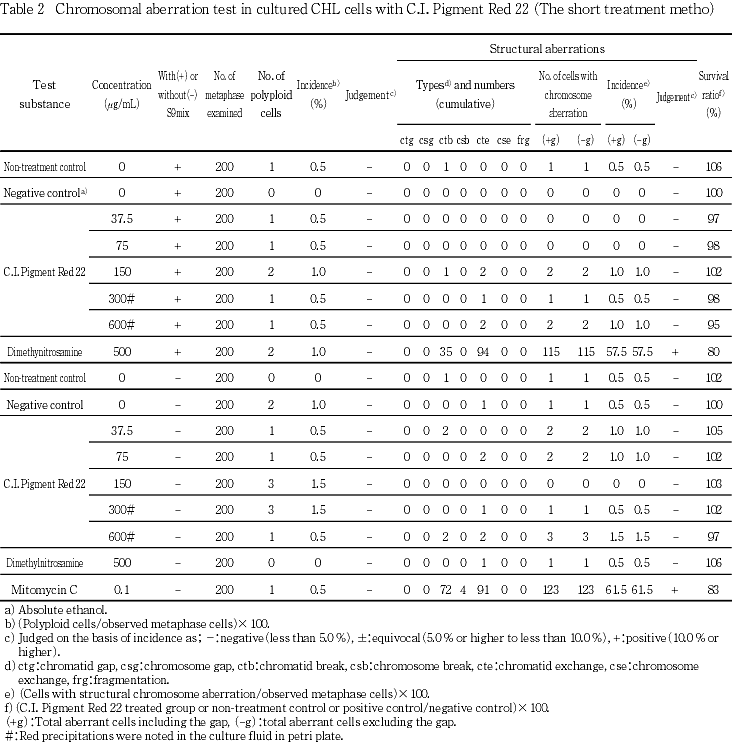
短時間処理法による試験結果をTable 2に示した.C.I.ピグメントレッド22をS9 mix添加および無添加で6時間処理したいずれの処理群とも,染色体の構造異常および数的異常の誘発性は認められなかった.また,被験物質処理による細胞増殖抑制作用はいずれの濃度においても認められなかった.S9 mix添加における陽性対照のDMN処理およびS9 mix無添加における陽性対照のMMC処理では,いずれの処理群とも染色体構造異常の顕著な誘発が認められた.なお,S9 mix無添加におけるDMN処理では陰性の結果を示したことから,代謝活性化の妥当性が保証された.
媒体として用いた無水エタノールは,無処置対照群と同様な結果を示し,試験系に及ぼす影響は認められなかった.
なお,連続処理法および短時間処理法とも,いずれの処理群も処理終了時に300および600 μg/mLにおいて被験物質の析出が認められた.
以上の結果から,C.I.ピグメントレッド22は本試験条件下において,染色体異常誘発性はない(陰性)と判定する.
| 1) | 日本環境変異原学会・哺乳動物試験分科会編,"化学物質による染色体異常アトラス,"朝倉書店,東京,1988, pp.16-37. |
| 2) | 石館基監修,"<改定>染色体異常試験データー集,"エル・アイ・シー社,東京,1987. |
| 連絡先 | |||
| 試験責任者: | 三輪芳久 | ||
| 試験担当者: | 小林梨沙 | ||
| (株)日本バイオリサーチセンター 羽島研究所 | |||
| 〒501-6251 岐阜県羽島市福寿町間島6-104 | |||
| Tel 058-392-6222 | Fax 058-392-1284 | ||
| Correspondence | ||||
| Authors: | Yoshihisa Miwa(Study director) Risa Kobayashi | |||
| Hashima Laboratory, Nihon Bioresearch Inc. | ||||
| 104, 6-chome, Majima, Fukuju-cho, Hashima, Gifu, 501-6251, Japan | ||||
| Tel +81-58-392-6222 | Fax +81-58-392-1284 | |||