フマル酸ジエチルのラットを用いる単回経口投与毒性試験
Single Dose Oral Toxicity Test of Diethyl Fumarate in Rats
要約
フマル酸ジエチル(CAS No.623-91-6)の910,1180,1540,2000,2600および3380mg/kgをラットに経口単回投与し,その毒性について試験を実施して,以下の知見を得た.
死亡例は雄で1540mg/kg以上の群に,雌で1180mg/kg以上の群に認められ,LD50値は雄で1540mg/kgと2000mg/kgとの間,雌で1367.45mg/kg(95%信頼限界1100.03〜1675.51mg/kg)であると推察された.
被験物質投与による症状として,自発運動の減少,流涎,腹臥,体温低下,呼吸緩徐,下痢および被毛汚染が認められた.体重は,被験物質投与群で対照群よりも有意に低く推移し,観察期間の早期には投与日体重よりも減少していた.また、被験物質の直接刺激によると考えられる所見として,死亡例では,前胃における壁の菲薄化や粘膜剥離がほぼ全例に認められ,病理組織学的には,粘膜上皮の壊死および粘膜下織の水腫,潰瘍および粘膜下織の肉芽増殖などが認められた.生存例では前胃粘膜の肥厚がほぼ全例に認められ,病理組織学的には粘膜下織の肉芽増殖および粘膜層の肥厚,過角化および潰瘍が認められた.
その他,死亡例で腎臓に皮髄境界部の尿細管上皮の壊死,血栓形成,尿細管の拡張および尿細管上皮の萎縮,肝臓に小葉中心性の肝細胞の巣状壊死,脾臓に実質の壊死および萎縮,肺に肺胞内水腫および肺胞の拡張,胸腺の萎縮,生存例で腎臓に尿細管上皮の再生および線維化,脾臓に髄外造血の増加が認められた.
方法
1.動物および飼育条件
生後4週齢のCrj:CD(SD)系のSPFラットを,日本チャールス・リバーより受け入れ,7日間の馴化飼育後,順調な発育を示した動物を試験に用いた.
動物は,温度23±3℃,湿度55±10%,換気回数10〜15回/時間および照明時間午前8時〜午後8時に設定された飼育室において,ブラケット式金属製金網床ケージに収容して飼育した.飼料は固型飼料(CRF-1、オリエンタル酵母工業)を,飲料水は水道水をそれぞれ自由摂取させた.飼料の混入物質および飲料水の水質について検査を実施し,異常のみられないことを確認した.
2.被験物質
フマル酸ジエチル(Lot No.:0158,純度:約98%,製造者:黒金化成)は樹脂改質共重合に使用され,特有の刺激臭を有する無色透明の液体(比重1.053)である.被験物質は密栓し,遮光,室温の条件下で保管し,投与には原液をそのまま使用した.
3.試験群の設定
本被験物質の2000,1000および500mg/kgを1群雌雄各5匹のラットに投与し,投与後5日間観察した結果,2000mg/kg群で雌雄各2例が投与後1〜4日に死亡したが,1000mg/kg以下の群では死亡は認められず,また,1000および2000mg/kg群では自発運動の減少,流涎などの症状,体重増加抑制,前胃および腎臓への影響が認められたが,500mg/kg群では異常は認められなかった.これらのことから,本試験ではLD50値の算出が可能となるようにフマル酸ジエチルの3380,2600,2000,1540,1180および910mg/kg群,さらに日本薬局方精製水を投与する対照群の計7群を設定した.1群の動物数は雌雄各5匹とし,投与前日に各群の体重が均一になるように体重別層化無作為抽出法により群分けした.
4.投与方法
投与経路は経口とし,投与は動物を約17〜20時間絶食させた後,胃ゾンデを用いて強制的に胃内に1回行った.投与容量は,体重1kg当たり0.864,1.121,1.462,1.899,2.469および3.210mlとして投与日に測定した体重に基づいて算出した.なお,対照物質の投与容量は3.210ml/kgとした.投与時の週齢は雌雄ともに5週齢で,平均体重(体重範囲)は雄で115.5g(110〜121g),雌で103.3g(96〜110g)であった.
5.観察,測定および検査項目
(1)一般状態観察および体重測定
一般状態は,投与日は投与後6時間までは頻繁に,投与後1日以降は1日1回以上の頻度で投与後14日まで観察した.体重は,投与日,投与後1,3,5,7,10および14日に測定した.
(2)剖検および病理組織学的検査
死亡例は発見後直ちに,生存例は投与後14日にエーテル麻酔下で放血致死させた後,剖検した.病理組織学的検査は,死亡例は1180mg/kg群の雌1例,1540,2000,2600および3380mg/kg群の雌雄各2例,生存例は対照群,910および1180mg/kg群の雌雄各2例,1540mg/kg群の雄2例,2000mg/kg群の雌1例について,肝臓,腎臓,脾臓,心臓,肺,脳(大脳・小脳),胃(前胃・腺胃),十二指腸,空腸,回腸,盲腸,結腸および直腸を10%中性緩衝ホルマリン液で固定し,パラフィン包埋後薄切し,ヘマトキシリン・エオジン染色あるいは死亡例のうち代表例の腎臓および肝臓についてPTAH・エオジン重染色またはOil red O標本を作製し,病理組織学的検査を実施した.また,異常所見部位(胸腺,副腎および膵臓)についても同様に検査した.
6.統計処理
死亡率から,プロビット法によりLD50値およびその95%信頼限界を算出した.体重についてBartlettの検定法によって分散を検定した.その結果,等分散(P>0.05)を示した場合は一元配置分散分析法によって解析し,有意な場合(P<0.10)には,Dunnettの検定法(各試料の大きさが違う場合は有効反復数を用いた)により対照群と被験物質投与群との比較を行った.不等分散(P<0.05)を示した場合はKruskal-Wallis法により解析し,有意な場合(P<0.10)には,Mann-WhitneyのU-検定法により対照群と被験物質投与群との比較を行った.なお,対照群との検定は危険率5%以下を統計学的に有意とした.
結果
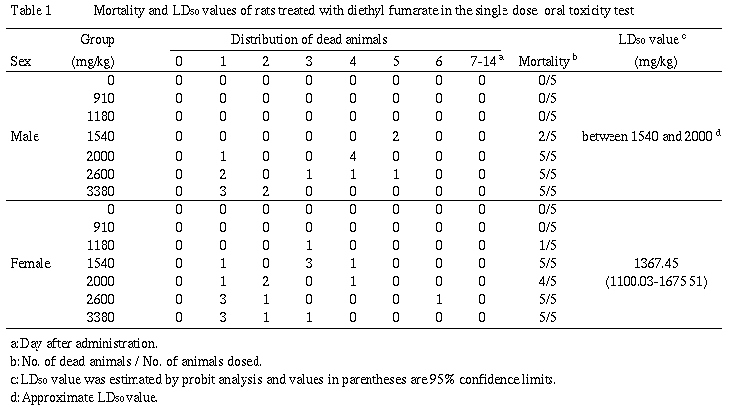
1.死亡例およびLD50値(Table 1)
雄では,1540mg/kg以上の群で死亡が認められ,LD50値は1540mg/kgと2000mg/kgの間にあると推察された.雌では,1180mg/kg以上の群で死亡が認められ,LD50値は1367.45mg/kg(95%信頼限界1100.03〜1675.51mg/kg)と算出された.死亡時期は,投与後1〜6日の間であり,高用量群ほど早期に死亡する傾向が認められた.
2.一般状態
死亡例では,雌雄ともに投与後約1時間以内に自発運動の減少および流涎が,その後自発運動の減少が死亡日まで断続して認められた.また,死亡前に腹臥,体温低下および呼吸緩徐が観察される例も認められた.その他に下痢,口周囲,鼻周囲,腹部および後腹部,外尿道口周囲および肛門周囲の被毛汚染が認められた.
生存例では,投与日に自発運動の減少が1180mg/kg以上の群で,流涎が910mg/kg以上の群で認められた.投与後1日以降は,2000mg/kg群の雌1例に自発運動の減少が投与後5日まで断続して認められたが,その他の例では症状が消失した.その他に,被験物質投与群で下痢および口周囲の被毛汚染が認められた.
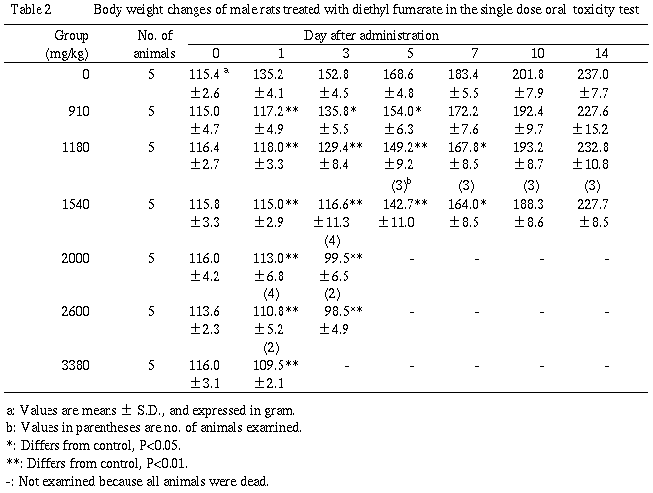
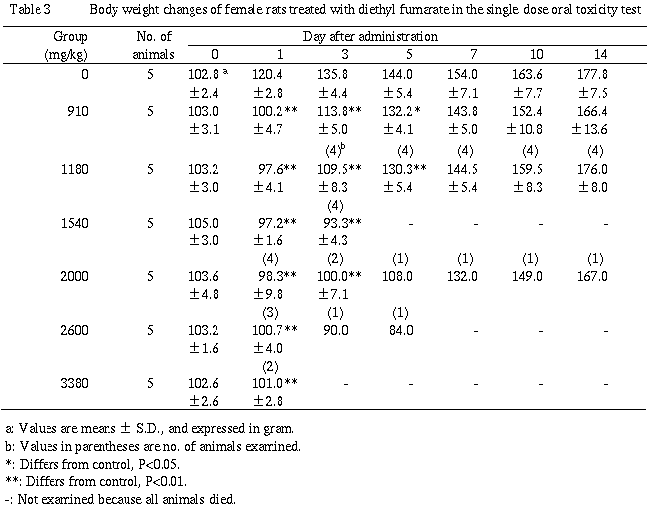
3.体重(Table 2,3)
雌雄ともに被験物質投与群では低く推移し,雄で投与後1〜7日,雌で投与後1〜5日に有意な差が認められた.なお,雄の1540mg/kg以上の群および雌の被験物質投与群の投与後1〜5日には投与日体重を下回る体重値も認められたが,生存例では投与後14日には対照群とほぼ同程度にまで回復した.
4.剖検
(1)投与後1〜3日死亡例
胃では膨満,前胃壁の菲薄化,前胃粘膜の剥離あるいは暗赤色斑,腺胃粘膜の暗赤色化などが,盲腸では粘膜の一部暗赤色化が,肝臓では一部暗赤色化あるいは白色斑が,脾臓では萎縮,変形,一部黒色化,褪色あるいは一部白色化などが,肺では暗赤色化,含気した膨化などが,外表では被毛汚染がそれぞれ認められた.
(2)投与後4〜6日死亡例
胃では膵臓,脾臓,左腎臓および左副腎との癒着,前胃粘膜の剥離,暗赤色斑などが,腎臓では腫大が,脾臓では萎縮,変形および一部白色化あるいは一部黒色化が,肺では暗赤色化などが,胸腺では萎縮および暗赤色化が,外表では被毛汚染がそれぞれ認められた.
(3)生存例
胃では前胃粘膜の一部肥厚,一部白色隆起などが,腎臓では腫大および褪色が,脾臓では一部白色化がそれぞれ認められた.
5.病理組織学的検査
(1)投与後1〜3日死亡例
前胃では粘膜上皮の壊死,粘膜下織の水腫,潰瘍あるいは粘膜下織のうっ血が,腺胃では粘膜固有層のうっ血が,盲腸では粘膜固有層のうっ血が,肝臓では小葉中心性の肝細胞の巣状壊死あるいはうっ血が,腎臓では皮髄境界部の尿細管上皮の壊死,近位尿細管上皮の脂肪化,遠位を主とした尿細管の拡張あるいは尿細管上皮の萎縮が,脾臓では実質の壊死および出血,萎縮が,肺ではうっ血,肺胞内水腫あるいは肺胞の拡張がそれぞれ認められた.
(2)投与後4〜6日死亡例
前胃では粘膜上皮の壊死および粘膜下織の水腫,潰瘍,浸出性炎および胃壁の壊死,粘膜下織のうっ血および肉芽増殖,粘膜層の肥厚および過角化,肝臓ではうっ血が,腎臓では血栓形成,皮髄境界部における尿細管上皮の壊死,遠位を主とした尿細管の拡張,尿細管上皮の萎縮,胃との炎症性癒着および浸出性炎,腎盂腎炎が,脾臓では実質の壊死,胃との炎症性癒着および浸出性炎,萎縮が,肺ではうっ血あるいは肺胞内水腫が,胸腺では萎縮が,副腎および膵臓では胃との炎症性癒着および浸出性炎がそれぞれ認められた.
(3)生存例
前胃では潰瘍,粘膜下織における肉芽増殖,粘膜層の肥厚あるいは過角化が,腎臓では尿細管上皮の再生および線維化が,脾臓では萎縮,髄外造血の増加がそれぞれ認められた.
考察
死亡例は,雄で1540mg/kg以上の群に,雌で1180mg/kg以上の群に認められ,LD50値は雄で1540mg/kgと2000mg/kgとの間,雌で1367.45mg/kg(95%信頼限界1100.03〜1675.51mg/kg)であると推察された.死亡時期は投与後1〜6日の間であり,高用量群ほど早期に死亡する傾向が認められた.
被験物質投与による症状として,自発運動の減少が,死亡例では投与日および投与後1日以降断続的に,観察期間終了時まで生存した例では1180mg/kg以上の群で投与日にそれぞれ認められた.その他に流涎,腹臥,体温低下,呼吸緩徐,下痢および被毛汚染が被験物質投与群で認められた.また,体重は被験物質投与群で対照群よりも有意に低く推移し,また,観察期間の早期には投与日体重よりも減少するなど,被験物質単回投与による影響が認められた.
被験物質の直接刺激によると考えられる所見として,観察期間の早期の死亡例では,前胃において壁の菲薄化がほぼ全例に認められ,病理組織学的には粘膜上皮の壊死および粘膜下織の水腫などが認められたが,投与後日数を経過して死亡した例では,前胃に粘膜剥離がほぼ全例に認められ,病理組織学的には潰瘍および粘膜下織の肉芽増殖などが認められた.このうち,潰瘍が重度にみられた例では胃とその周囲の器官との癒着なども認められた.観察期間終了時まで生存した例では,前胃粘膜の肥厚がほぼ全例に認められ,病理組織学的には粘膜下織の肉芽増殖および粘膜層の肥厚,過角化および潰瘍が認められた.なお,腺胃では粘膜固有層にうっ血がみられる程度の変化にとどまり傷害像が認められなかったのは,前胃が重層扁平上皮で構成されているのに対し,腺胃は保護作用を有する粘液層を厚く持つためと考えられた.
また,死亡例の一部で腎臓に皮髄境界部の尿細管上皮の壊死および血栓形成,肝臓に小葉中心性の肝細胞の巣状壊死,脾臓に実質の壊死,肺に肺胞内水腫および肺胞の拡張が認められたことから,死亡例には全身性の循環障害が生じていたことが疑われ,胃に対する被験物質の刺激性に起因した二次的変化と考えられた.生存例では腎臓において前述の循環障害の修復像と考えられる尿細管上皮の再生および線維化が認められた.
その他に被験物質投与群では,生存例の雄の脾臓で髄外造血の増加が認められ,前胃における傷害に起因した変化と推察された.死亡例では,腎尿細管の拡張および尿細管上皮の萎縮や脾臓および胸腺の萎縮が死亡時期の遅い例ほど重く認められる傾向があり,死亡に至る時間経過に伴い全身的な衰弱が強くなったものと考えられた.
| 連絡先 |
| 試験責任者: | 釜田 悟 |
| 試験担当者: | 八幡昭子,常見邦順,小林裕幸,岡澤平一 |
| (株)化合物安全性研究所 |
| 〒004 北海道札幌市豊平区真栄363番24号 |
| Tel 011-885-5031 | Fax 011-885-5313 | |
| Correspondence |
| Authors: | Satoru Kamada (Study director),
Akiko Yahata,Kuninori Tsunemi,
Hiroyuki Kobayashi,Heiichi Okazawa |
| Safety Research Institute for Chemical Compounds Co., Ltd. |
|
363-24 Shin-ei, Toyohira-ku,Sapporo,Hokkaido, 004, Japan |
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | |



