1,4-ジシアノベンゼンのラットを用いる
28日間反復経口投与毒性試験
Twenty-eight-day Repeat Dose Oral Toxicity Test of 1,4-dicyanobenzene in Rats
要約
1,4-ジシアノベンゼンの1.25,5,20および80 mg/kg/dayをSD系雌雄ラットに28日間経口反復投与し,その毒性および投与後14日間休薬した際の回復性を検討した.
体重の増加抑制および摂餌量の減少が80 mg/kg群の雌雄で認められた.肝臓に対する影響として,体重重量比の増加が80 mg/kg群の雌雄で,小葉中心性の肝細胞肥大および小葉中心帯に滑面小胞体の増加が80 mg/kg群の雄で認められた.また,血中のトリグリセリド,リン脂質あるいは総コレステロールの増加が20 mg/kg以上の群の雌雄で,γ-GTPの増加傾向が80 mg/kg群の雄で認められた.甲状腺に対する影響として,体重重量比の増加が80 mg/kg群の雌雄で,ろ胞の不整形化が80 mg/kg群の雄で,コロイドの減少が20 mg/kg以上の群の雄で認められた.腎臓に対する影響として,褪色が5 mg/kg以上の群の雄で認められ,組織学的に近位尿細管を主とする尿細管上皮の硝子滴沈着が対照群よりも多数例に認められ,その程度は用量相関的に重くなる傾向が認められた.また,尿比重の低下および尿中電解質の減少が80 mg/kg群の雌雄で,血中のクロールの減少が20 mg/kg以上の群の雄および80 mg/kg群の雌で,血中のカルシウムの増加および無機リンの減少が80 mg/kg群の雌雄で認められた.
これらの変化はその多くが14日間の休薬により消失し,回復傾向はあるものと考えられた.
以上のことから,本試験条件下における1,4-ジシアノベンゼン投与による無影響量(NOEL)は雄で1.25 mg/kg/day,雌で5 mg/kg/dayであると考えられた.
材料および方法
1. 被験物質
1,4-ジシアノベンゼンは燻蒸剤として使用される殺菌・殺虫用化学物質であり,油溶性(水溶解度:0.03 g/100 g)の白色結晶である.本試験では昭和電工(株)より提供されたロット番号930825(純度99%以上)のものを使用した.被験物質は試験期間中安定であることを確認した.投与液の調製は用時とし,0.05,0.2および0.8 w/v%の濃度は被験物質を1%メチルセルロース溶液(MC:品名 メトロース,SM-15,信越化学工業(株);日本薬局方精製水:ヤクハン製薬(株))で懸濁して調製した.0.0125%は0.05%調製液を1%メチルセルロース溶液で希釈して調製した.
2. 試験動物および飼育条件
生後4週齢の雌雄のCrj:CD(SD)系SPFラットを日本チャールス・リバー(株)より受け入れ,1週間の馴化飼育を行い,異常がなく順調な発育を示した動物を試験に用いた.
動物は,温度23±3℃,湿度55±10%,換気回数10〜15回/時および照明12時間/日に設定したバリアシステムの飼育室において,ブラケット式金属製金網床ケージに群分け前は5匹以内,群分け後は1匹を収容した.飼料は固型飼料(CRF-1,オリエンタル酵母工業(株)),飲料水は水道水(札幌市水道水)をそれぞれ自由に摂取させた.飼料の混入物質および飲料水の水質を検査し,異常がないことを確認した.
3. 試験群の設定
試験群は,本試験に先立って実施した1,4-ジシアノベンゼンの14日間反復投与経口毒性試験の成績を参考に設定した.すなわち,500 mg/kg群では雌3例の死亡が認められ,100 mg/kg群では体重増加抑制,摂餌量の減少,血中トリグリセリドの増加,肝細胞の腫大,肝細胞内好酸性封入体,脳のグリア細胞の増殖などが認められ,死亡する可能性も考えられた.また,20 mg/kg群では血中トリグリセリドの増加,肝細胞内好酸性封入体などが認められた.これらのことから,20 mg/kg/dayを中間用量とし,高用量を100 mg/kg/dayよりも小さくかつ確実に影響の現れる量と考えられる80 mg/kg/day,低用量を公比4で5 mg/kg/day,また,20 mg/kg群でみられた変化が5 mg/kg/day投与で出現する可能性も勘案し,最低用量を無影響量と推測される1.25 mg/kg/dayとし,さらに1%メチルセルロース溶液を投与する対照を加えて計5群とした.動物数は対照群で雌雄各14匹,1.25,5および20 mg/kg群で雌雄各7匹,80 mg/kg群で雌雄各14匹とし,このうち回復性試験のために対照群および80 mg/kg群の雌雄各7匹をあてた.群分けは馴化期間の最終日に体重別層化無作為抽出法により行った.
4. 投与方法
投与は胃ゾンデを用いた強制経口投与とし,1日1回連続28回行った.回復性試験の日数は14日間とした.投与容量は,体重1 kg当たり10 mlとして投与日に最も近い日に測定した体重に基づいて算出した.投与は5週齢から開始し,投与開始時の平均体重(体重範囲)は雄で139.8 g(130〜151 g),雌で129.0 g(117〜142 g)であった.
5. 観察,測定および検査項目
1) 一般状態観察
投与期間および回復期間中,全例について1日1回以上の頻度で観察した.
2) 体重,摂餌量および飲水量測定
全例について,体重を投与1日(投与前),投与2,7,14,21および28日(投与終了日),回復1,2,7および14日,剖検日に測定した.摂餌量および飲水量測定は剖検日を除いて体重測定と同じ日に測定した.また,投与1から28日および回復1から14日の体重増加量および体重増加率を算出した.
3) 尿検査
投与期間の最終週(投与23〜24日)および回復期間の最終週(回復12〜13日)に全例を代謝ケージに収容して非絶食下で採尿を行った.約3時間の蓄尿についてpH,蛋白,糖,ケトン体,潜血反応(以上,試験紙マルティスティックス;マイルス・三共)および沈渣(鏡検)を検査し,21時間蓄尿について尿量,比重(アタゴ製屈折計ユリコン),ナトリウム,カリウム(以上,炎光法:コーニング480型炎光光度計)およびクロール(電量滴定法:平沼CL-6M型クロライドカウンター)を測定した.
4) 血液学的検査
剖検時に全例について約16時間絶食させた後,エーテル麻酔下で大腿静脈より採血し,EDTA・2Kで処理した血液を用いて赤血球数,平均赤血球容積,血小板数,白血球数(以上,電気抵抗法),血色素量(シアンメトヘモグロビン法)(以上,コールターカウンターT660型),ヘマトクリット値(RBC,MCV値より算出),平均赤血球ヘモグロビン量(RBC,Hb値より算出),平均赤血球ヘモグロビン濃度(Ht,Hb値より算出),網状赤血球数(Brecher法)および白血球型別百分率(鏡検)を測定した.また,無処理血液を用いて,凝固時間(流体粘度変化による空気圧測定法:グライナー社製マイクロコアグロメータ)を測定した.さらに,腹部大動脈より採血しクエン酸ナトリウムで処理した後,3000 rpmで10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,AMELUNG KC-10A バクスターKK)を測定した.
5) 血液生化学検査
剖検時に全例について腹部大動脈より採血し,3000 rpmで10分間遠心分離して得られた血清を用いてGOT,GPT(以上,IFCC法),γ-GTP(包接L-γ-グルタミル-p-ニトロアニリド基質法),アルカリフォスファターゼ(ベッセィ・ローリー法),乳酸脱水素酵素(ロブレスキー・ラ・デュー法),血糖(ヘキソキナーゼ法),総コレステロール,リン脂質(以上,酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(ヤッフェ法),カルシウム(OCPC法),無機リン(フィスケ・サバロー法),総蛋白(ビウレット法),アルブミン(BCG法),クレアチンフォスフォキナーゼ(GSCC法)(以上,日立7150形自動分析装置),ナトリウム,カリウム(以上,炎光法:コーニング480型炎光光度計),クロール(電量滴定法:平沼CL-6M型クロライドカウンター),A/G比(TP,Alb値より算出)および蛋白分画(セルロースアセテート膜電気泳動法)を測定した.
6) 剖検および器官重量測定
投与期間および回復期間終了の翌日に全例について,体外表を観察し,エーテル麻酔下で採血後放血致死させ剖検した.また,脳,下垂体,甲状腺,肺,心臓,肝臓,腎臓,脾臓,副腎,胸腺,精巣および卵巣の重量を測定し,器官体重重量比を算出した.
7) 病理組織学的検査
全例について肝臓,腎臓,脾臓,心臓,肺,脳(大脳・小脳),下垂体,副腎,甲状腺,上皮小体,胸腺,腸間膜リンパ節,膵臓,舌,下顎リンパ節,顎下腺,舌下腺,耳下腺,乳腺,皮膚,胸骨および大腿骨(骨髄を含む),脊髄(頸部),骨格筋(外側広筋),胸部大動脈,喉頭,気管,気管支,食道,胃(前胃・腺胃),十二指腸,空腸,回腸,盲腸,結腸,直腸,膀胱,精巣,精巣上体,精嚢(凝固腺を含む),前立腺,卵巣,子宮,腟および坐骨神経を10%中性緩衝ホルマリン液,眼球およびハーダー腺をデビッドソン液で固定し,常法に従いパラフィン切片を作製し,ヘマトキシリン・エオジン染色あるいは特殊染色(GFAP免疫染色,ルクソール・ファースト青−ボディアン重染色および鉄(ベルリン青)染色)標本を作製し,病理組織学的検査を行った.
8) 電子顕微鏡検査
投与期間終了時解剖例および回復期間終了時解剖例のうち対照群および80 mg/kg群の雌雄各2例について肝臓の一部を採取し,グルタールアルデヒドとオスミウム酸で二重固定し,常法に従い超薄切切片を作製し,酢酸ウラニルとクエン酸鉛の二重染色を行い,電子顕微鏡(JEM-T8,日本電子(株))を用いて観察した.
6. 統計処理
Bartlettの等分散検定の後,一元配置分散分析法あるいはKruskal-Wallis法により解析し,有意な場合,Dunnettの検定法あるいはMann-WhitneyのU-検定法により対照群と1,4-ジシアノベンゼン投与各群との比較を行った.なお,対照群との検定については,危険率5%以下を統計学的に有意とした.
成績
1. 一般状態観察
頸部に外傷,痂皮あるいは脱毛が5および80 mg/kg群の雄各1例で投与9〜28日あるいは15〜28日に認められた.
回復期間では,雌雄ともに異常は認められなかった.
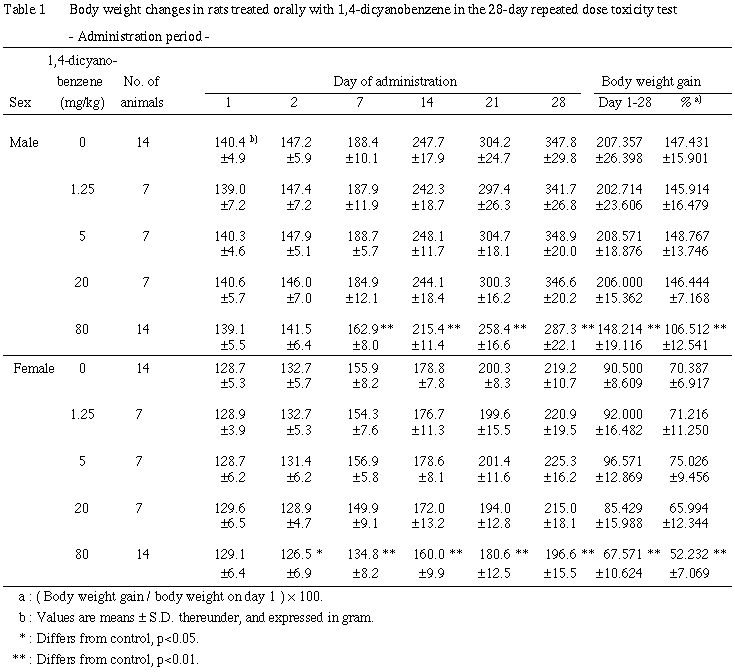
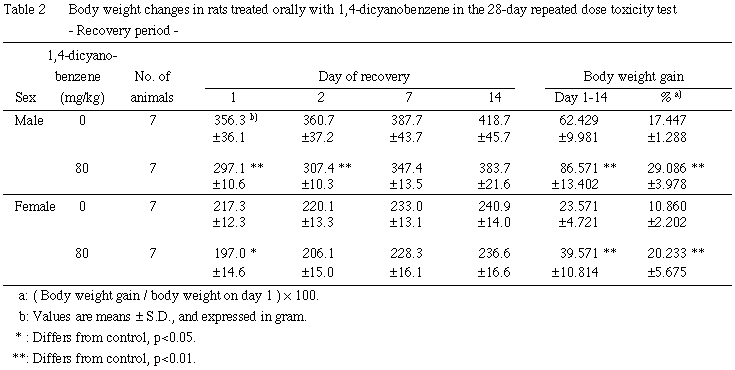
2. 体重推移(Table 1, 2)
投与期間では,雌雄ともに80 mg/kg群で投与7あるいは2日以降に体重の減少が,投与期間中の体重増加量および増加率の減少が認められた.
回復期間では,雌雄ともに80 mg/kg群で回復1あるいは2日に体重の減少が,回復期間中の体重増加量および増加率の増加が認められた.
3. 摂餌量
投与期間では,80 mg/kg群の雄で投与2〜28日に,同群の雌で投与2および7日に摂餌量の減少が認められた.
回復期間では,80 mg/kg群の雄で回復1日に摂餌量の減少が,同群の雌で回復2日に摂餌量の増加が認められた.
4. 飲水量
投与期間では,雌雄ともに対照群と比較して有意な差は認められなかった.
回復期間では,雌の80 mg/kg群で回復2日に飲水量の増加が認められた.
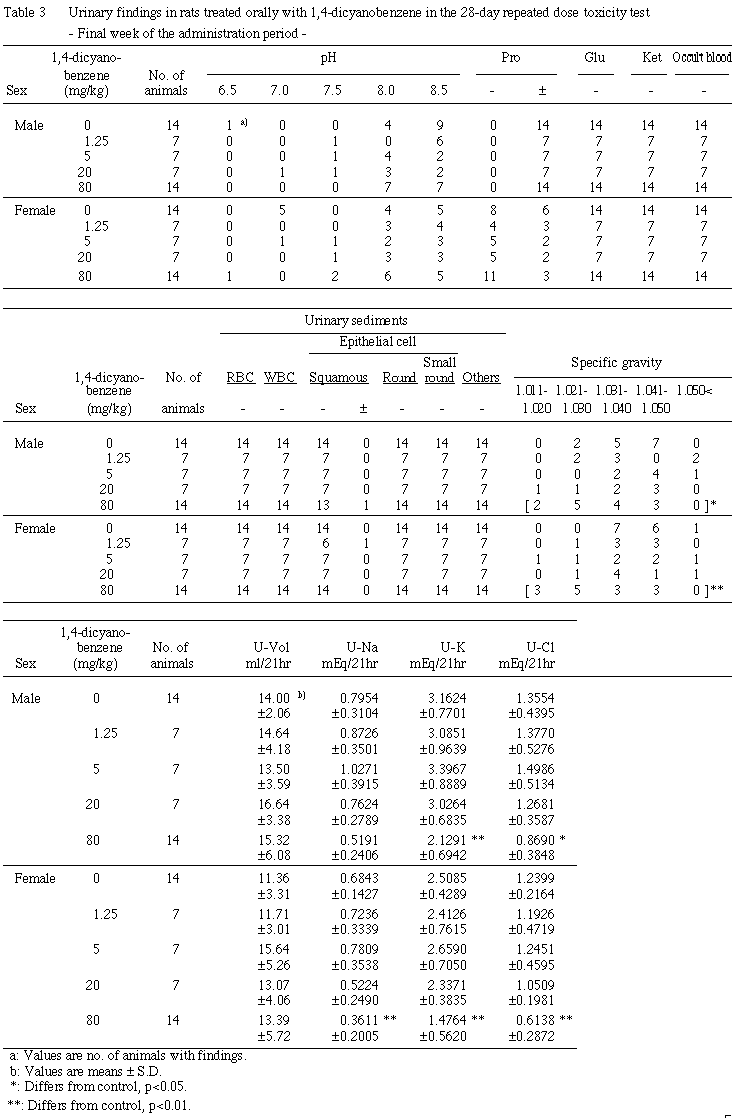
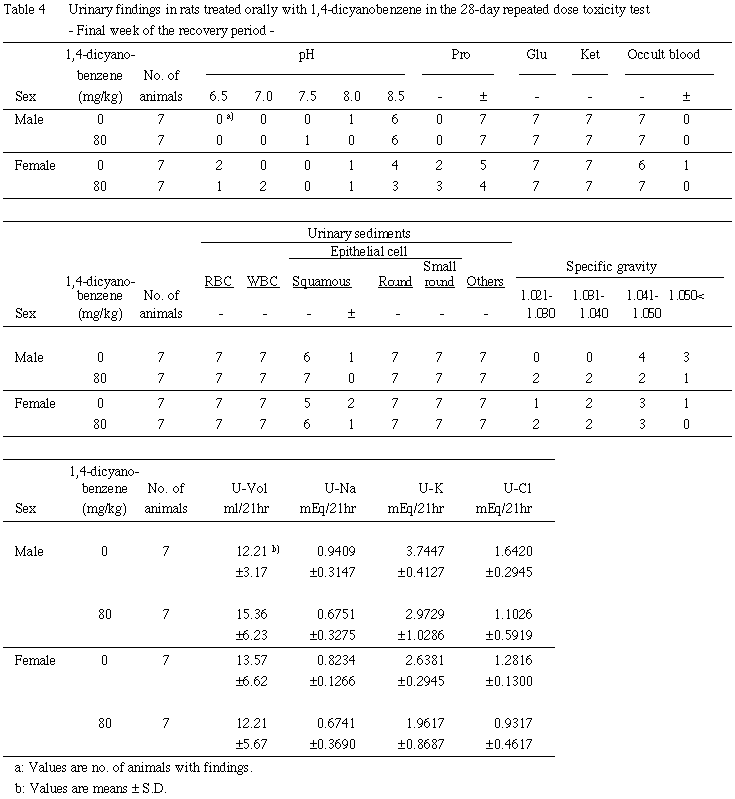
5. 尿検査(Table 3, 4)
投与期間最終週には,80 mg/kg群の雄で尿比重の低下,カリウムおよびクロールの減少が認められ,また,統計学的に有意な差ではないもののナトリウムの減少傾向が認められた.同群の雌では尿比重の低下,ナトリウム,カリウムおよびクロールの減少が認められた.
回復期間最終週には,雌雄ともに対照群と比較して有意な差は認められなかった.
6. 血液学的検査
投与期間終了時には,80 mg/kg群の雄で分節好中球率の上昇が,同群の雌で網状赤血球数の上昇が認められた.
回復期間終了時には,80 mg/kg群の雄で分節好中球率の上昇およびリンパ球率の低下が,同群の雌で網状赤血球数および分節好中球率の上昇,リンパ球率の低下が認められた.
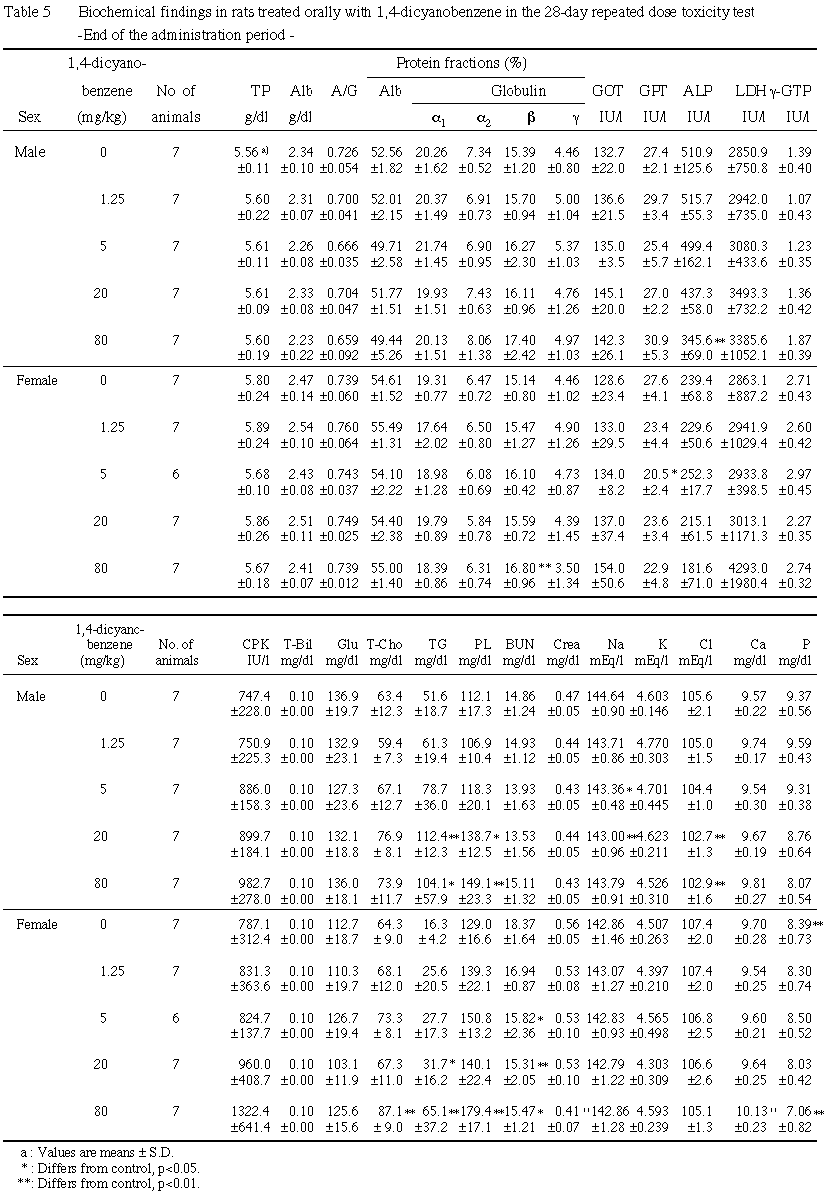
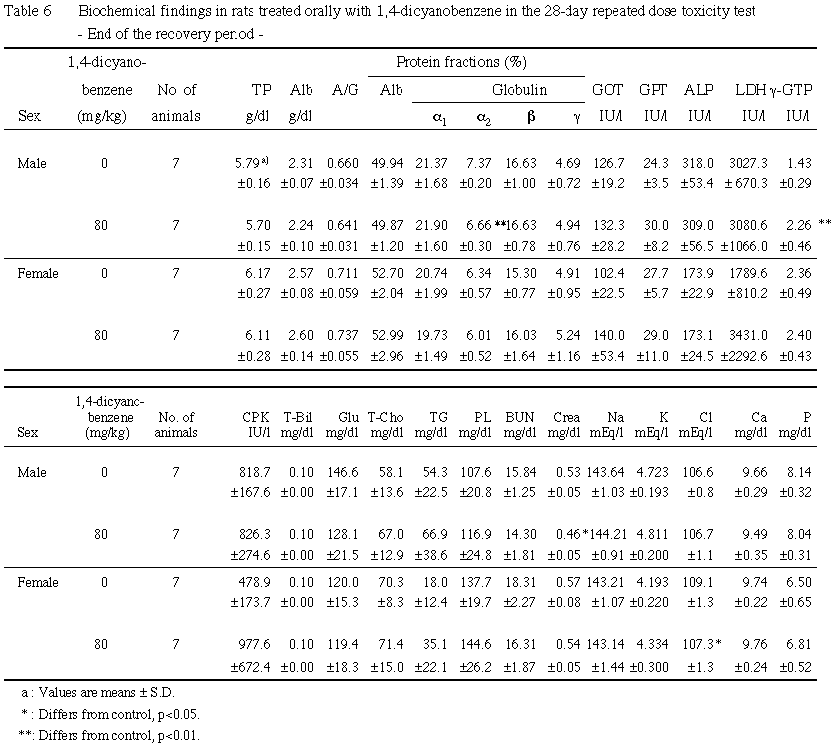
7. 血液生化学検査(Table 5, 6)
投与期間終了時には,雄では20および80 mg/kg群でトリグリセリドおよびリン脂質の増加ならびにクロールの減少が,さらに80 mg/kg群でアルカリフォスファターゼおよび無機リンの減少が認められた.また,統計学的に有意な差ではないものの,80 mg/kg群でγ-GTPおよびカルシウムの増加傾向が認められた.雌では,5 mg/kg以上の群で尿素窒素の減少が,20および80 mg/kg群にトリグリセリドの増加が,さらに80 mg/kg群でβ-グロブリン分画の上昇,総コレステロールおよびリン脂質の増加,クレアチニンの減少,カルシウムの増加および無機リンの減少が認められた.また,統計学的に有意な差ではないものの,80 mg/kg群でクロールの減少傾向が認められた.
回復期間終了時には,80 mg/kg群の雄でγ-GTPの増加およびクレアチニンの減少が,同群の雌でクロールの減少が認められた.
その他,1,4-ジシアノベンゼン投与による異常は認められなかった.
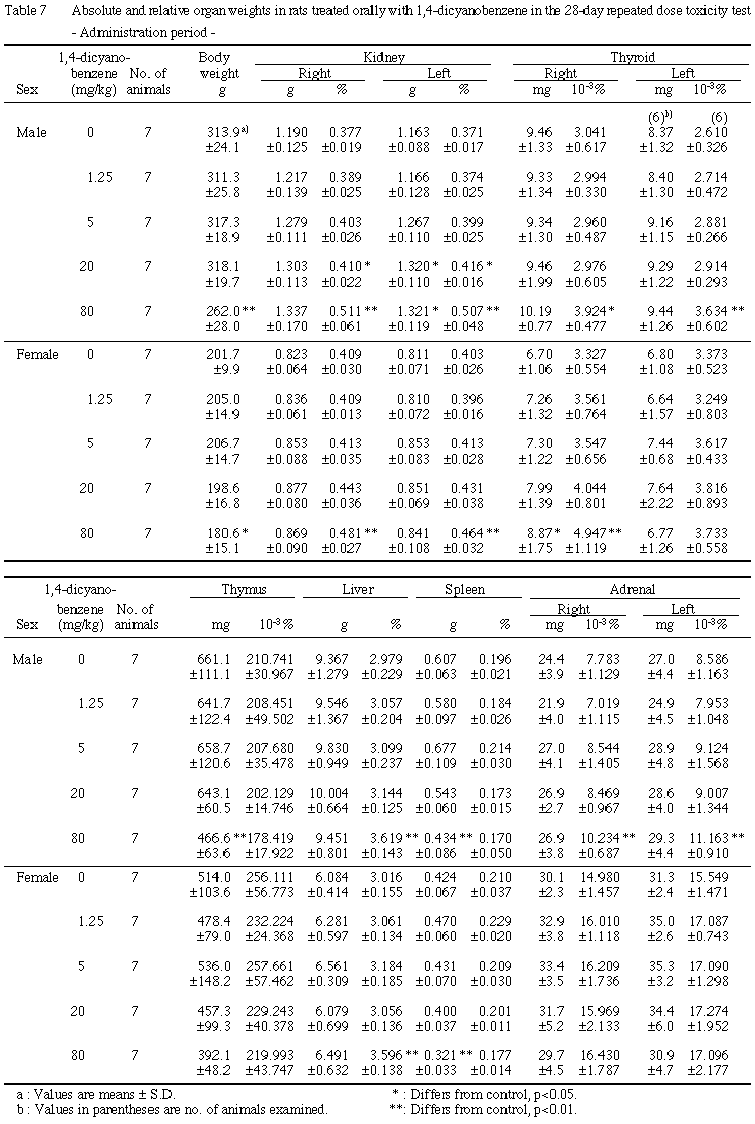
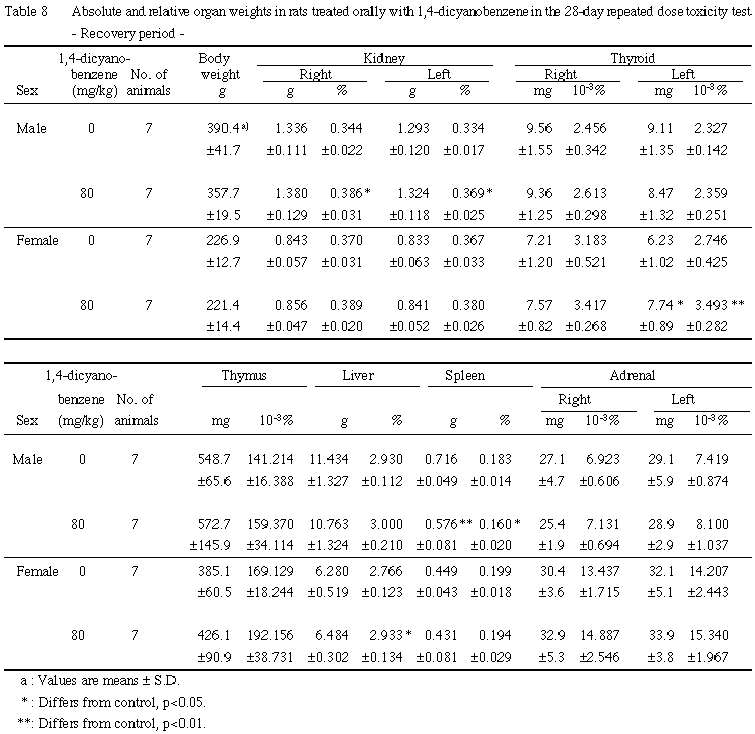
8. 器官重量(Table 7, 8)
投与期間終了時には,雄では20および80 mg/kg群で腎臓の重量および体重重量比の増加が,80 mg/kg群で甲状腺の体重重量比の増加,胸腺重量の減少,肝臓の体重重量比の増加,脾臓重量の減少および副腎の体重重量比の増加が認められた.雌では,80 mg/kg群で腎臓の体重重量比の増加,甲状腺の重量および体重重量比の増加,肝臓の体重重量比の増加および脾臓重量の減少が認められた.
回復期間終了時には,雄では80 mg/kg群で腎臓の体重重量比の増加,脾臓の重量および体重重量比の減少が認められた.雌では,80 mg/kg群で甲状腺の重量および体重重量比の増加ならびに肝臓の体重重量比の増加が認められた.
9. 剖検
投与期間終了時には,腎臓の褪色が5 mg/kg以上の群の雄に認められた.また,5および80 mg/kg群の雄各1例に下顎リンパ節の腫大が認められた.両例は,一般状態で頸部に外傷や脱毛などがみられた例であった.
回復期間終了時には,雌雄ともに異常は認められなかった.
10. 病理組織学的検査(Table 9, 10)
投与期間終了時には,肝臓では小葉中心性の肝細胞肥大が80 mg/kg群の雄に認められた.腎臓では近位尿細管を主とする尿細管上皮の硝子滴沈着が対照群および5 mg/kg以上の群の雄で認められ,その出現例数は1,4-ジシアノベンゼン投与群で多く,程度は用量相関的に重くなる傾向が認められた.この硝子滴は自然発生でみられるものと同様であるものの,20 mg/kg以上の群ではほぼ全ての近位尿細管上皮にみられ,80 mg/kg群では滴が大型化し,滴の癒合も認められた.さらに,硝子滴沈着が認められた例のうち80 mg/kg群の雄2例では遠位を主とする尿細管の拡張および尿細管上皮の萎縮が伴って認められた.脾臓では軽度のリンパろ胞の萎縮が80 mg/kg群の雄に認められた.甲状腺では軽度のろ胞の不整形化が80 mg/kg群の雄,軽度のコロイドの減少が20および80 mg/kg群の雄に認められた.なお,頸部に外傷などが認められた5および80 mg/kg群の雄各1例では,下顎リンパ節における髄索内形質細胞の増加,頸部皮膚における膿瘍,細胞浸潤,潰瘍,痂皮および水腫などが軽度あるいは中等度に認められ,さらに80 mg/kg群の雄1例では,胸骨および大腿骨における軽度の顆粒球系細胞の増加が認められた.
回復期間終了時には,腎臓に近位尿細管を主とする尿細管上皮の硝子滴沈着および限局性の尿細管上皮の再生が対照群および80 mg/kg群の雄に認められた.


11. 電子顕微鏡検査
投与期間終了時には,肝臓の小葉中心帯における滑面小胞体の増加が80 mg/kg群の雄に認められた.
回復期間終了時には,雌雄ともに異常は認められなかった.
考察
体重の増加抑制および摂餌量の減少が80 mg/kg群の雌雄で認められ,1,4-ジシアノベンゼン投与による影響と考えられた.
肝臓に対する影響として,体重重量比の増加が80 mg/kg群の雌雄で,小葉中心性の肝細胞肥大および小葉中心帯に滑面小胞体の増加が80 mg/kg群の雄で認められ,1,4-ジシアノベンゼン投与による薬物代謝酵素誘導 1, 2) が示唆された.また,血中のトリグリセリド,リン脂質あるいは総コレステロールの増加が20 mg/kg以上の群の雌雄で,γ-GTPの増加傾向およびアルカリフォスファターゼの減少が80 mg/kg群の雄で,β-グロブリン分画の上昇が80 mg/kg群の雌で認められ,1,4-ジシアノベンゼンの肝臓・胆道系への影響が示唆された.
甲状腺に対する影響として,体重重量比の増加が80 mg/kg群の雌雄で,ろ胞の不整形化が80 mg/kg群の雄で,コロイドの減少が20 mg/kg以上の群の雄で認められた.外来物質によって引き起こされた酵素誘導は体内の性ホルモンや甲状腺ホルモンなどの分解を促進する場合があると報告されており2) ,本試験でも肝臓の酵素誘導により甲状腺ホルモンレベルが低下し,TSHの作用によって甲状腺の機能が亢進し,二次的に増生性の変化が生じたもの3) と考えられた.
腎臓に対する影響として,肉眼的に褪色が5 mg/kg以上の群の雄で認められた.組織学的には近位尿細管を主とする尿細管上皮の硝子滴沈着が認められ,その出現例数は5 mg/kg以上の群で対照群よりも多く,程度は用量相関的に重くなる傾向が認められた.また,14日間の休薬により80 mg/kg群でみられた硝子滴は自然発生と同じ程度にまで回復したものの,尿細管上皮に限局性の再生像が対照群よりも多数例に認められた.薬物がライソソーム内に蓄積したりライソソーム酵素を阻害することにより尿細管上皮への硝子滴の蓄積が生じるといわれている2)が,1,4-ジシアノベンゼンも同様の機序により腎臓に障害を与えたと考えられた.腎機能の低下を示唆する所見としては,尿比重の低下,尿中電解質の減少,血中のカルシウムの増加および無機リンの減少などが80 mg/kg群の雌雄で,血中のクロールの減少が20 mg/kg以上の群の雄および80 mg/kg群の雌で認められた.このうち,カルシウムの変動については,大量の甲状腺ホルモン投与によって骨組織中の蛋白質の異化が促進され,血中のカルシウムが増加すること4) から,1,4-ジシアノベンゼンの甲状腺への影響との関連も考えられた.なお,雌では血中尿素窒素の減少が5 mg/kg以上の群で,血中クレアチニンの減少が80 mg/kg群で認められたが,いずれも背景データ範囲内のわずかな変動であることから,1,4-ジシアノベンゼン投与との関連はないと考えられた.
その他に,網状赤血球数の上昇が80 mg/kg群の雌で認められ,1,4-ジシアノベンゼン投与により赤血球の生成亢進状態であったことが示唆されたが,赤血球数には変化は認められなかった.また,分節好中球率の上昇が80 mg/kg群の雄で認められた.同変化は100 mg/kgの14日間投与でも認められており,1,4-ジシアノベンゼン投与による影響と考えられたが,その機序については不明であった.前述以外の器官では,脾臓に重量の減少およびリンパろ胞の萎縮,胸腺に重量の減少,副腎に体重重量比の上昇が80 mg/kg群で認められ,体重増加抑制が同群で認められていることを考慮すると,これらの変化は1,4-ジシアノベンゼン投与による全身的な影響を示唆するものと考えられた.また,5および80 mg/kg群の雄で頸部皮膚に潰瘍や水腫などが認められたが,投与操作時に被験物質が付着したため生じた1,4-ジシアノベンゼンの刺激に対する反応性の変化と考えられた.なお,単回投与試験では500 mg/kg以上の群で1,4-ジシアノベンゼンの刺激による変化が前胃に認められたが,本試験では80 mg/kgの28日間反復投与でも異常は認められなかった.
上述の変化はその多くが14日間の休薬により消失し,回復傾向はあるものと考えられた. 以上,雄では5 mg/kg群で腎臓の褪色および尿細管上皮の硝子滴沈着が,雌では20 mg/kg群で血中トリグリセリドの増加が認められたことから,本試験条件下における1,4-ジシアノベンゼン投与による無影響量(NOEL)は雄で1.25 mg/kg/day,雌で5 mg/kg/dayであると考えられた.
参考文献
| 1) | 長瀬すみら, "実験動物の臨床生化学データー − 病理組織像との関連," ソフトサイエンス社, 東京, 1976, pp. 345-352. |
| 2) | J.R. Glaister, "Principles of Toxicological Pathology," Taylor & Francis, London, 1986. [高橋道人監訳, "毒性病理学の基礎", ソフトサイエンス社, 東京, 1992, p. 260] |
| 3) | S. Hosokawa et al., J. Toxicol. Sci., 17, 155-166 (1992). |
| 4) | 中野 昭一ら, "主要疾患の病態生理," 南山堂, 東京, 1981, pp. 337-338. |
| 連絡先 |
| 試験責任者: | 八幡 昭子 |
| 試験担当者: | 山田 高士,長谷 淳一,
小林 裕幸 |
| 運営管理者: | 井本 精一 |
| (株)化合物安全性研究所 |
| 〒004 北海道札幌市豊平区真栄363番24号 |
| Tel 011-885-5031 | Fax 011-885-5313 | |
| Correspondence |
| Authors: | Akiko Yahata (Study director)
Takashi Yamada, Jun-ichi Nagaya,
Hiroyuki Kobayashi,
Seiichi Imoto (Management) |
| Safety Research Institute for Chemical
Compounds Co., Ltd. |
| 363-24 Shin-ei, Toyohira-ku, Sapporo, Hokkaido, 004, Japan |
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | |










