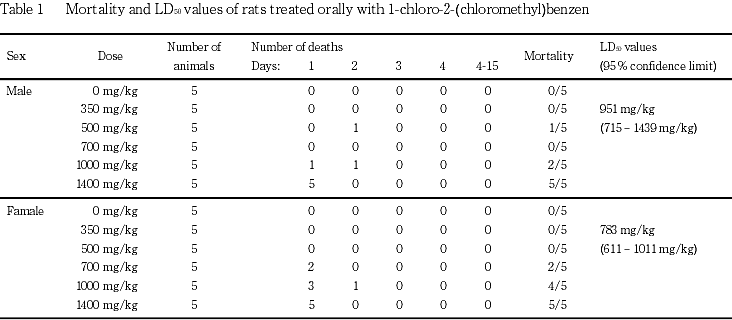
投与の結果,雄で500 mg/kg以上,雌で700 mg/kg以上の用量群で死亡例がみられた.死亡動物では,500 mg/kg以上の用量群で流涎,流涙,潮紅,自発運動の低下および軟便,700 mg/kg以上の用量群で歩行異常,1000および1400 mg/kg群で腹臥位,呼吸不整,体温低下,眼瞼下垂,1400 mg/kg群で自発運動の亢進がみられた.剖検では,腺胃のびらん/潰瘍が,病理組織学的検査で前胃の粘膜下織の水腫および腺胃のびらんが認められた.
生存動物では,350 mg/kg以上の用量群で潮紅,流涙,流涎,軟便,700および1000 mg/kg群で自発運動の低下および歩行異常がみられた.体重は試験期間を通して全被験物質投与群で対照群を下まわった.剖検では,350 mg/kg以上の用量群で前胃壁の肥厚,前胃のびらん/潰瘍,700および1000 mg/kg群で腹腔内臓器の癒着がみられた.病理組織学的検査では,前胃の潰瘍,扁平上皮の増生,炎症性細胞浸潤および肉芽組織の形成がみられ,前胃の漿膜面には,病変の波及による腹膜炎の像がみられた.
1-クロロ-2-(クロロメチル)ベンゼンの半数致死量(LD50値)は,雄が951 mg/kg(95 %信頼限界:715〜1439 mg/kg),雌が783 mg/kg(95 %信頼限界:611〜1011 mg/kg)であった.
検疫・馴化期間を含む全飼育期間を通して,温度22±2℃,相対湿度55±15 %,換気約12回/時,照明12時間/日(7:00-19:00)に自動調節した飼育室を使用した.
動物は実験動物用床敷(ベータチップ,日本チャールス・リバー(株))を敷いたポリカーボネート製ケージに5匹(同性)収容し,飼育した.動物には,実験動物用固型飼料(MF,オリエンタル酵母工業(株))と,5 μmのフィルター濾過後,紫外線照射した水道水を自由に摂取させた.
投与用量は,予備検討の結果(用量:2000,1000,500,250 mg/kg,動物数:1用量あたり雌雄各3匹),2000 mg/kgの用量で雌雄全例,1000 mg/kgの用量で雄2例,雌全例が死亡した.500および250 mg/kgの用量では死亡例はみられなかったが,500 mg/kg群の雄では腹腔内臓器の癒着がみられた.このことから,本試験では1400 mg/kgを高用量とし,以下公比約1.4で1000,700,500,350 mg/kgの5用量を設定した.この他に溶媒(0.1 % Tween80水溶液)のみを投与する対照群を設けた.投与液量は10 mL/kgとし,投与直前の体重に基づいて算出した.被験物質をTween80 (DIFCO)の0.1 %水溶液に乳化した.投与前に投与液中の被験物質の均一性および0.4 mg/mLで3日間,200 mg/mLで8日間の安定性ついて確認した.また,各用量群の投与液を分析し,被験物質の濃度が設定通りであることを確認した.
LD50値は,雄が951 mg/kg(95 %信頼限界:715〜1439 mg/kg),雌が783 mg/kg(95 %信頼限界:611〜1011 mg/kg)であった.
生存動物では,投与日に350 mg/kg以上の用量群で潮紅,流涙,流涎,軟便あるいは下腹部の汚れがみられた.1000 mg/kg群の雌雄,700 mg/kg群の雌で自発運動の低下および歩行異常がみられた.第2日以降の症状として,1000 mg/kg群の雌雄および700 mg/kg群の雌で自発運動の低下,歩行異常,1000 mg/kg群の雌雄で下腹部の汚れがみられた.これらの症状は700および1000 mg/kg群の雌で第4日,1000 mg/kg群の雄で第6日までに消失した.
生存動物では,雌雄ともに350 mg/kg以上の用量群で前胃壁の肥厚,前胃のびらん/潰瘍,700および1000 mg/kg群で腹腔内臓器の癒着がみられた.癒着のみられた1000 mg/kg群の雌雄では脾臓の被膜の肥厚がみられ,350 mg/kg群の雄1例でも脾臓の被膜に白色斑がみられた.
その結果,1400 mg/kg群の雌雄全例,1000 mg/kg群の雄2例,雌4例,700 mg/kg群の雌2例,500 mg/kg群の雄1例が死亡した.
死亡動物では,投与日に500 mg/kg以上の用量群で流涎,流涙,潮紅,自発運動の低下および軟便,700 mg/kg以上の用量群で歩行異常,1000および1400 mg/kg群で腹臥位,呼吸不整,体温低下,眼瞼下垂,1400 mg/kg群で自発運動の亢進がみられた.剖検では,腺胃のびらん/潰瘍がみられた.胃の変化は,病理組織学的に前胃の粘膜下織の水腫および腺胃のびらんであった.
生存動物では,350 mg/kg以上の用量群で潮紅,流涙,流涎,軟便がみられ,700および1000 mg/kg群の自発運動の低下および歩行異常がみられた.体重は全被験物質投与群で対照群を下まわったが,これは第4日までの体重増加量の差によるものと思われた.剖検では,350 mg/kg以上の用量群で前胃壁の肥厚,前胃のびらん/潰瘍,700および1000 mg/kg群で腹腔内臓器の癒着がみられた.胃の変化は,病理組織学的に前胃の潰瘍,扁平上皮の増生,炎症性細胞浸潤および肉芽組織の形成が認められ,漿膜面には,病変の波及による腹膜炎の像がみられた.胃でみられた変化については,被験物質が粘膜刺激性を有する1)ことから被験物質の直接的な刺激による変化と考えられる.

| 1) | "製造安全データシート,"イハラケミカル工業,1997. |
| 連絡先 | |||
| 試験責任者: | 山下弘太郎 | ||
| 試験担当者: | 重松寛子,山岸保彦,鈴木美江,石原啓子,増田久美子 | ||
| (株)三菱化学安全科学研究所鹿島研究所 | |||
| 〒314-0255 茨城県鹿島郡波崎町砂山14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence | ||||
| Authors: | Koutarou Yamashita(Study director) Hiroko Shigematsu, Yasuhiko Yamagishi, Yoshie Suzuki, Keiko Ishihara, Kumiko Masuda | |||
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory | ||||
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-0255, Japan | ||||
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | |||