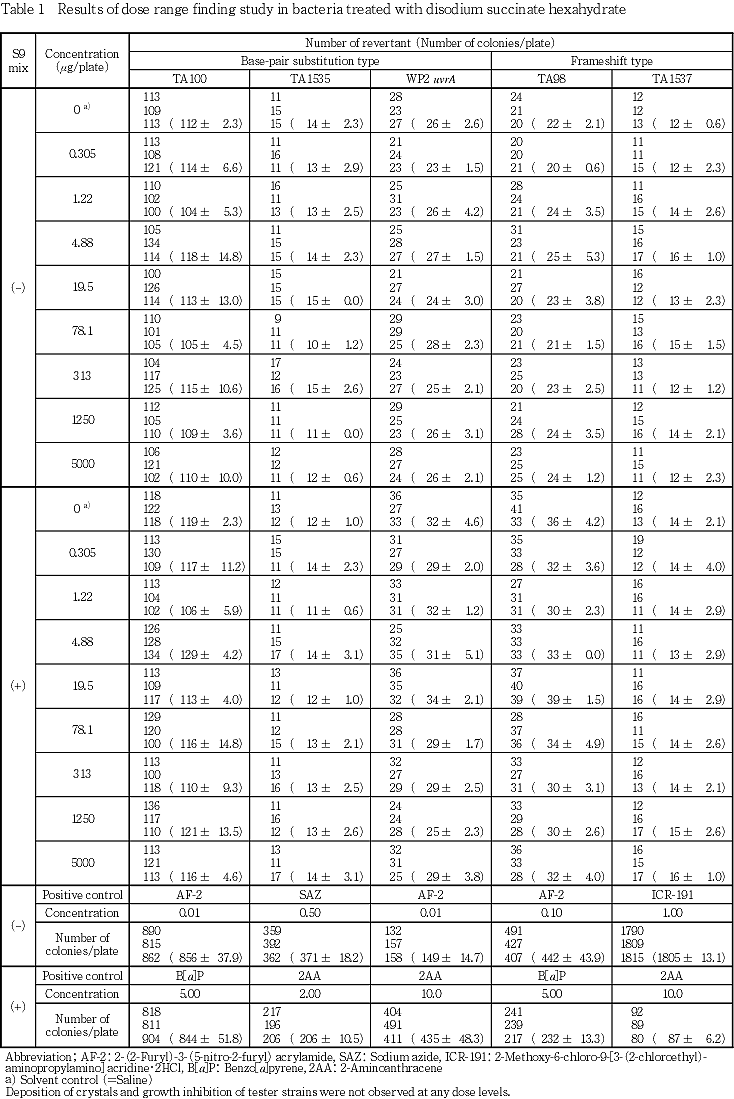
供試菌株として,ネズミチフス菌Salmonella typhimurium TA100,TA98,TA1535及びTA1537並びにEscherichia coli WP2 uvrAの5菌株を用いた.
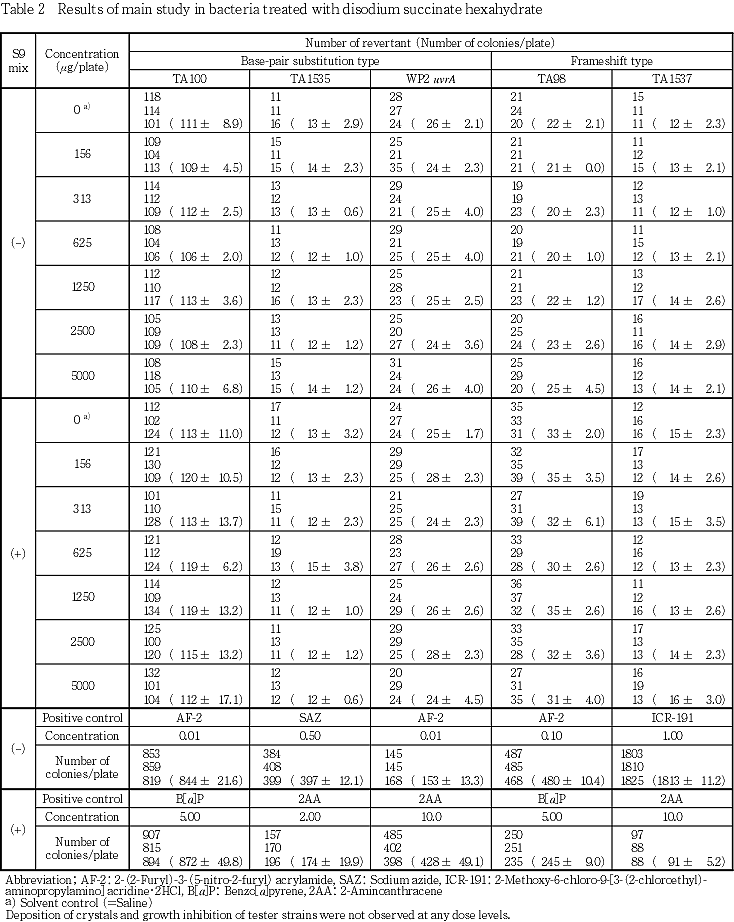
濃度設定試験及び本試験の結果,菌株及び代謝活性化の有無にかかわらず,いずれの濃度においても試験菌株に対する生育阻害及び沈殿/結晶の析出は認められなかった.また,溶媒対照と比較して2倍以上の復帰変異コロニー数の増加は認められなかった.
以上の結果より,本試験条件下においてコハク酸二ナトリウム六水和物は細菌に対して復帰突然変異誘発性を示さない(陰性)と判定した.
これらの菌株はいずれも1997年10月9日に国立医薬品食品衛生研究所・変異遺伝部から入手した.試験菌株は-80 ℃超低温フリーザで保存したものを用いた.各菌株は,アミノ酸要求性,紫外線(UV)感受性,膜変異(rfa)及びアンピシリン耐性因子pKM101(プラスミド)の有無について調べ,特性が維持されていることを確認した.
試験に際して,解凍した菌液をニュートリエントブロスNo.2(OXOID Ltd.)を入れた培養用三角フラスコに一定量を接種し,37 ℃で約8時間振盪培養したものを検定菌液とした.分光光度計を用いて660 nmの吸光度を測定し,試験菌液の増殖を確認した.
陽性対照物質として下記に示した5種類の物質を使用した.
| 2-(2-furyl)-3-(5-nitro-2-furyl)acrylamide | (AF-2,和光純薬工業(株)) |
| Sodium azide | (SAZ,和光純薬工業(株)) |
| 2-methoxy-6-chloro-9-[3-(2-chloroethyl)-amino propylamino] acridine・2HCl | (ICR-191,Polysciences, Inc.) |
| 2-aminoanthracene | (2AA,ナカライテスク) |
| Benzo[a]pyrene | (B[a]P,ナカライテスク) |
AF-2,ICR-191,2AA,B[a]Pはジメチルスルホキシド(DMSO:試薬特級,和光純薬(株))を用いて溶解し,SAZは,注射用水(日局,(株)大塚製薬工場)により溶解し,目的濃度に調製した.
濃度設定試験及び本試験の結果,菌株及び代謝活性化の有無にかかわらず,いずれの濃度においても,菌の生育阻害及び沈殿/結晶の析出は認められなかった.また,菌株及び代謝活性化の有無にかかわらず,溶媒対照と比較して2倍以上の復帰変異コロニー数の増加は認められなかった.一方,陽性対照群では各菌株の溶媒対照群に比較して2倍以上の復帰変異コロニーを誘発した.
以上の結果より,本試験条件下においてコハク酸二ナトリウム六水和物は細菌に対して復帰突然変異誘発性を示さない(陰性)と判定した.

| 1) | D. M. Maron, B. N. Ames, Mutat. Res., 113, 173(1983). |
| 2) | T. Matsushima, T. Sugimura, M. Nagao, T. Yahagi, A. Shirai, M. Sawamura, "Short-Term Test Systems for Detecting Carcinogens," eds. By K. H. Norpoth, R. C. Garner, Springer, Berlin, Heidelberg, New York, 1980, pp.273-285. |
| 連絡先 | |||
| 試験責任者: | 尾崎正康* | ||
| 試験担当者: | 伊藤加奈,高橋直紀,三浦康義,古田鮎美 | ||
| (株)ボゾリサーチセンター | |||
| 〒412-0039 静岡県御殿場市かまど1284 | |||
| Tel 0550-82-9922 | Fax 0550-82-9922 | ||
| * | 退職のため,三浦康義,望月 肇が報告書を作成した. |
| Correspondence | ||||
| Authors: | Masayasu Ozaki(Study Director) Kana Ito, Naoki Takahashi,Yasuyosi Miura, Ayumi Furuta | |||
| Bozo Research Center Inc. | ||||
| 1284 Kamado, Gotemba-shi, Shizuoka, 412-0039, Japan | ||||
| Tel +81-550-82-9922 | Fax +81-550-82-9922 | |||