1-ナフトール-4-スルホン酸ナトリウムのラットを用いる28日間反復経口投与毒性試験
Twenty-eight-day Repeat Dose Oral Toxicity Test of 1-Naphthol-4-sulfonic acid
sodium salt in Rats
要約
1-ナフトール-4-スルホン酸ナトリウムの28日間反復経口投与毒性試験(回復14日間)を雌雄のSprague-Dawley系ラットを用いて実施した.雌雄とも4群構成とし,1群には媒体である注射用水を,他の3群には被験物質を,それぞれ100,300および1000 mg/kgの用量で28日間にわたり強制経口投与した.雌雄とも回復試験に用いる動物を含む対照群および1000 mg/kg投与群は各10匹,その他の群は各5匹とした.
その結果,死亡例はいずれの群にも認められなかった.また,一般状態,体重,摂餌量,尿検査,血液学検査,血液生化学検査,病理学検査に被験物質投与によると考えられる変化は認められなかった.
以上のことから,本試験条件下における1-ナフトール-4-スルホン酸ナトリウムの無影響量は,雌雄ともに1000 mg/kg/dayであると判断された.
方法
1. 被験物質
被験物質として,スガイ化学工業(株)(和歌山)より提供された1-ナフトール-4-スルホン酸ナトリウム〔ロット番号9342,純度95.7 %(カップリング滴定法)〕を使用した.提供された物質は白色の粉末で,不純物として水3.2 %,塩化ナトリウム1.0 %を含有していた.被験物質は,使用時まで室温で保管した.なお,試験終了後,残余被験物質を提供元で再分析し,被験物質が試験期間中安定であったことを確認した.
投与検体は,10 w/v%となるように,被験物質を秤量し日局注射用水(製造番号9707SA,光製薬(株))を加えて溶解した後,同溶液から所定濃度となるように注射用水を加えて段階希釈することにより調製した.なお,初回に調製した各濃度の投与検体の含量測定を実施した結果,溶液中の被験物質の平均含量は,所定濃度の98.9〜99.7 %であった.また,動物試験に先立ち,被験物質の0.05および10 w/v%溶液について,冷蔵,遮光条件下における調製後8日間の安定性を確認した.そのため,投与検体は週に1回の割合で調製し,調製後の投与検体は使用時まで気密容器に入れ,冷蔵・遮光の条件で保管した.
2. 使用動物および飼育方法
生後4週で購入した雌雄のSprague-Dawley系ラット[Crj:CD(SD)IGS,SPF,日本チャールス・リバー(株)厚木飼育センター]を検疫と馴化を兼ねて7日間にわたり予備飼育した後,一般状態に異常の認められなかった雌雄各30匹を試験に供した.
群分けは,投与開始前日の測定体重をもとに体重別層化無作為抽出法により行った.動物数は,雌雄とも対照群および高用量群を各10匹とし,低および中用量群を各5匹とした.投与開始時の週齢は,雌雄ともに5週齢であり,体重は雄が140.1〜155.6 g,雌が117.8〜137.4 gであった.
動物は,全飼育期間を通じて,温度22 〜25 ℃,湿度50 〜65 %,換気回数約15回/時間,照明12時間(7〜19時点灯)に設定された飼育室内で,金属製金網床ケージに1匹ずつ収容し,固型飼料(CE-2,日本クレア(株))および水道水(秦野市水道局給水)を自由摂取させて飼育した.
3. 投与量の設定および投与方法
本試験の投与量は,投与量設定のための予備試験結果に基づき決定した.すなわち,0,250,500および1000 mg/kgの被験物質を7日間反復経口投与することにより,いずれの群にも被験物質投与の影響は認められなかった.このことから,1000 mg/kgは28日間の反復投与に耐えうる用量であると判断し,本試験の用量は,雌雄とも高用量を1000 mg/kgとし,以下公比約3で除して300および100 mg/kgを中用量および低用量とした.また,媒体である注射用水を投与する対照群を設けた.
投与経路は,強制経口投与とし,1日1回,28日間,ラット用胃管を用いて投与した.投与容量は10 mL/kgとし,各投与時に得られている最も近い時点の体重をもとに個体別に投与液量を算出した.なお,回復期間は14日間とした.
4. 検査項目
1) 一般検査
全例について,毎日(投与期間中は投与前および投与後)一般状態の観察を行った.また,全例の体重および摂餌量を以下の頻度で測定した.体重は,投与第1週には投与第1日の投与直前と投与第4日,投与第2週以降の投与期間および回復試験期間中は週に2回の頻度で測定した.その他,投与期間終了日,回復試験期間終了日および剖検日にも体重を測定した.摂餌量は,投与第1週では,投与第1日から2日にかけて1日あたりの摂餌量を測定し,以後回復試験期間終了週まで毎週1回の頻度で測定した.
2) 尿検査
全例について,投与期間終了週および回復試験期間終了週に動物を代謝ケージに収容して4時間尿あるいは新鮮尿を採取し,色調および混濁度を視診により,pH,潜血,蛋白,糖,ケトン体,ウロビリノーゲンおよびビリルビンを試験紙法(クリニテック200+,バイエル・三共)により検査した.
3) 血液学検査
投与期間終了時および回復試験期間終了時に解剖を行った定期解剖例全例を,採血前(屠殺剖検前)に18〜24時間絶食させた.その後,ペントバルビタールナトリウム麻酔下で,腹部後大静脈から抗凝固剤としてEDTA-3Kを用いて採血し,血液自動分析装置CELL-DYN3500SL(ダイナボット)により,赤血球数,平均赤血球容積および血小板数(以上,電気抵抗法),白血球数(フローサイトメトリー・レーザー光散乱法/電気抵抗法),白血球分類(フローサイトメトリー・レーザー光散乱法),血色素量(吸光度法)を測定し,これらをもとにヘマトクリット値,平均赤血球血色素量および平均赤血球血色素濃度を算出した.また,クエン酸ナトリウムを用いて採取した血液を分離して得た血漿を全自動血液凝固測定装置CA-1000(東亜医用電子)により,プロトロンビン時間および活性部分トロンボプラスチン時間(光散乱検出法)を測定した.
4) 血液生化学検査
血液学検査の採血に引き続き,同様の麻酔および採血部位の条件下で,全例からヘパリンを抗凝固剤として採取した血液を分離して得た血漿について,遠心方式生化学自動分析装置COBAS-FARA(ロシュ)により,総蛋白濃度(ビウレット法),アルブミン濃度(BCG法),総コレステロール濃度(COD・DAOS法),ブドウ糖濃度(グルコキナーゼG6PDH法),尿素窒素濃度(ウレアーゼGr.DH法),クレアチニン濃度(Jaff 法(Rate)),ALP活性(GSCC法),AST(GOT)活性(IFCC法),ALT(GPT)活性(IFCC法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド濃度(GPO・DAOS法),無機リン濃度(モリブデン酸直接法)およびカルシウム濃度(OCPC法)を測定し,A/G比を算出した.また,全自動電解質分析装置EA05(A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(イオン電極法)を測定した.
法(Rate)),ALP活性(GSCC法),AST(GOT)活性(IFCC法),ALT(GPT)活性(IFCC法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド濃度(GPO・DAOS法),無機リン濃度(モリブデン酸直接法)およびカルシウム濃度(OCPC法)を測定し,A/G比を算出した.また,全自動電解質分析装置EA05(A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(イオン電極法)を測定した.
5) 病理学検査
採血後,必要に応じて腋窩動脈を切断して放血屠殺した後,全例の器官および組織を肉眼的に観察し,各動物の脳,心臓,肝臓,腎臓,胸腺,脾臓,副腎,精巣,精巣上体,卵巣の重量を測定した.また,各器官重量を剖検日の体重で除してそれぞれの相対重量を算出した.肉眼的観察に引き続き,脳,下垂体,脊髄,眼球,甲状腺,上皮小体,心臓,気管,気管支,肺,肝臓,腎臓,胸腺,脾臓,副腎,胃,十二指腸,空腸,回腸,盲腸,結腸,直腸,精巣,精巣上体,前立腺,精嚢,卵巣,子宮,腟,乳腺,膀胱,下顎リンパ節,腸間膜リンパ節,骨格筋(下腿部),坐骨神経,大腿骨骨髄,膵臓,顎下腺,舌下腺,舌,食道,大動脈,ハーダー腺,皮膚,病変部を摘出して保存した.なお,精巣および精巣上体はブアン液に固定し(長期保存は0.1 mol/Lリン酸緩衝10 vol%ホルマリン溶液を使用),その他の器官・組織は0.1 mol/Lリン酸緩衝10 vol%ホルマリン溶液に固定した.さらに,全例の心臓,肝臓,腎臓,脾臓,副腎,精巣,精巣上体,卵巣および肉眼的観察で変化がみられた対照群の雄1例の前立腺および精嚢をパラフィン包埋して薄切し,ヘマトキシリン・エオジン染色標本を作製した.その後,光学顕微鏡を用いて,投与期間終了時の対照群および高用量群の全例および回復試験期間終了時の肉眼的観察で変化がみられた対照群の雄1例の肝臓の組織学検査を実施した.なお,本試験では,投与期間終了時の対照群と高用量群の組織学検査で,被験物質投与に起因したと考えられる変化が認められなかったため,それ以外の動物の組織学検査は実施しなかった.
5. データ解析法
体重,摂餌量および定期解剖例の血液学検査,血液生化学検査の値および器官重量は,群ごとに平均値および標準偏差を求めた.次いで,試験群の構成が対照群を含めて3群以上の場合は,Dunnett法あるいはDunnett型の検定法により多重比較を行った.一方,試験群が対照群を含め2群の場合には,Studentのt検定法あるいはAspin-Welchのt検定法を用いて有意差検定を行った.病理組織所見でグレード分けしたデータはMann-WhitneyのU検定(両側検定)法により,また,陽性グレードの合計値はFisherの直接確率検定(片側検定)法により有意差検定を行った.なお,これら対照群および被験物質投与群との間の有意差検定はいずれの場合も有意水準を5 %とした.
結果
1. 死亡例
投与期間および回復試験期間中に,対照群を含むいずれの群にも死亡例はなかった.
2. 一般状態
投与期間および回復試験期間中に,対照群を含むいずれの群にも一般状態の変化は認められなかった.
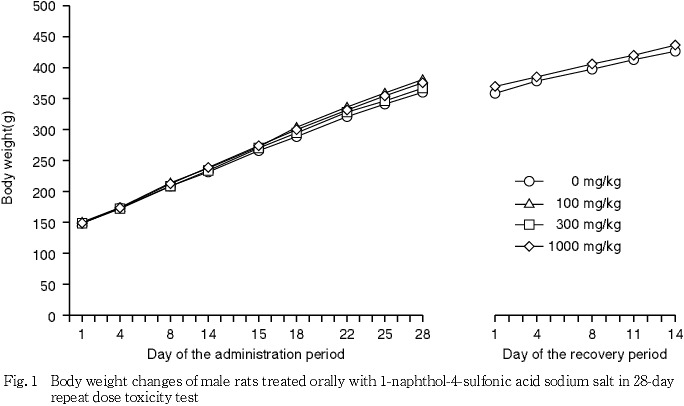
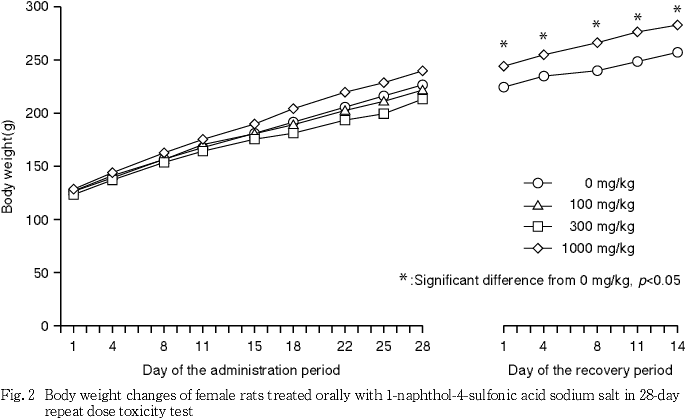
3. 体重(Fig. 1,2)
投与期間中,各被験物質投与群の雌雄で,対照群との間に有意な体重の差は認められなかった.一方,回復試験期間中では,有意な体重増加が1000 mg/kg投与群の雌でみられた.しかし,投与期間中の同群の体重に有意差は認められておらず,また用量依存的な変化もみられていないことから,回復試験期間中の体重増加は被験物質投与による影響ではないと考えられた.
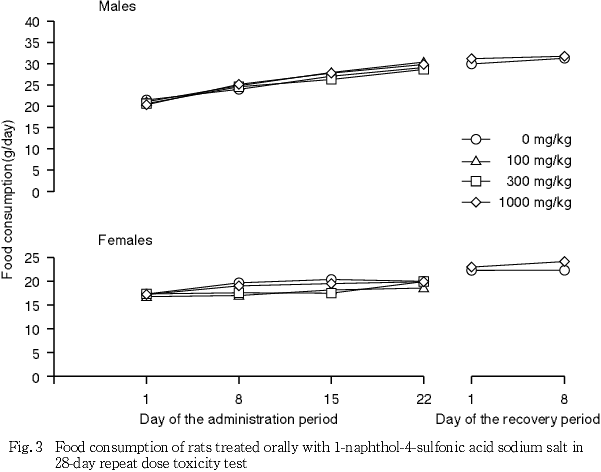
4. 摂餌量(Fig. 3)
投与期間および回復試験期間中,各被験物質投与群の雌雄で,対照群との間に有意な摂餌量の差は認められなかった.
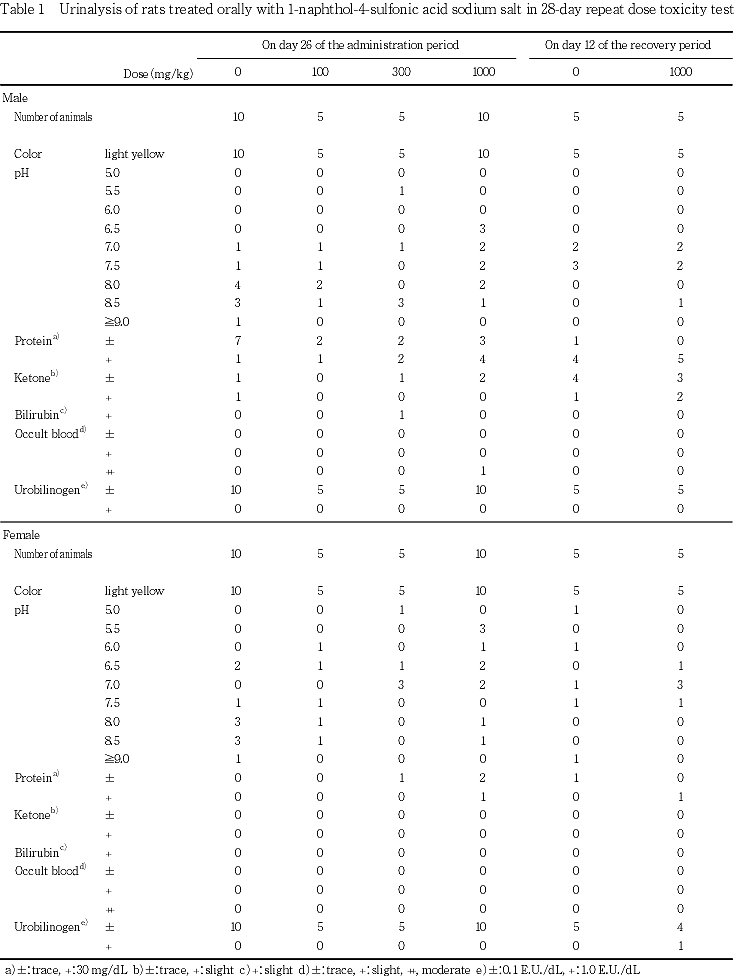
5. 尿検査所見(Table 1)
投与期間終了週の検査で,ビリルビン陽性(+)尿が300 mg/kg投与群の雄1例で,潜血反応陽性(++)尿が1000 mg/kg投与群の雄1例でみられた.これ以外に,投与期間終了週および回復試験期間終了週に,対照群を含む被験物質投与群の蛋白,ケトン体およびウロビリノーゲンで,陽性を示した尿(±あるいは+)が認められた.
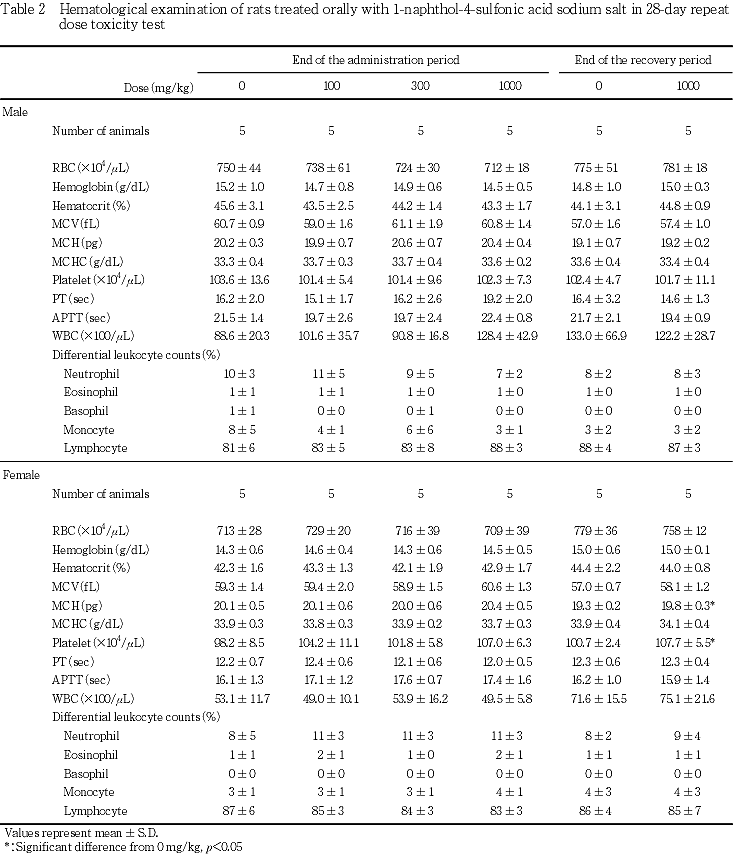
6. 血液学検査所見(Table 2)
投与期間終了時の検査では,いずれの検査項目においても,対照群と各被験物質投与群の間に有意な差は認められなかった.一方,回復試験期間終了時の検査では,平均赤血球血色素量および血小板数の有意な増加が1000 mg/kg投与群の雌でみられたが,投与期間終了時の検査では同様の変化は認められておらず,また用量依存的な変化もみられていないことから,これらの変化は被験物質投与による影響ではないと考えられた.
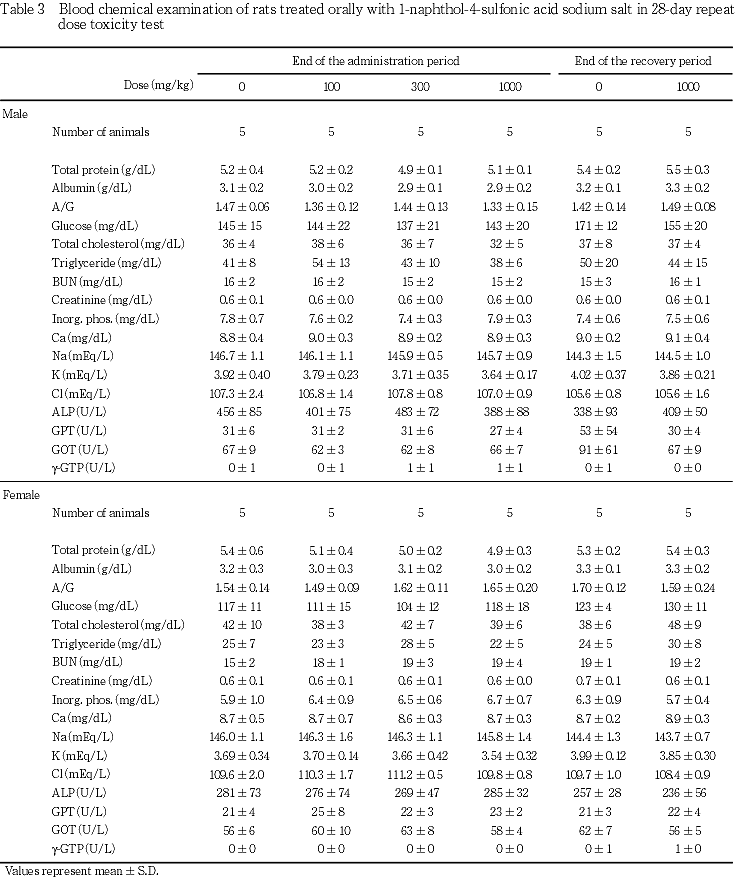
7. 血液生化学検査所見(Table 3)
投与期間終了時および回復試験期間終了時ともに,いずれの検査項目においても,対照群と各被験物質投与群の間に有意な差は認められなかった.
8. 病理学検査所見
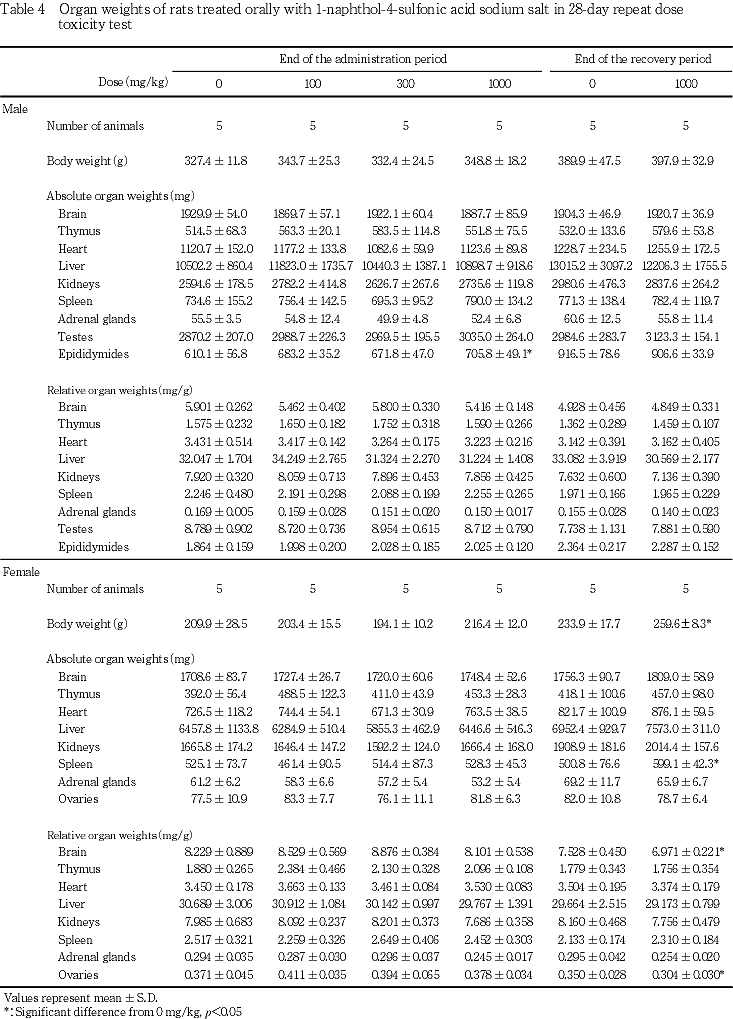
1) 器官重量(Table 4)
投与期間終了時の解剖では,精巣上体の絶対重量の有意な増加が1000 mg/kg投与群で認められた.また,回復試験期間終了時の解剖では,解剖時体重および脾臓の絶対重量の有意な増加,脳および卵巣の相対重量の有意な減少が,それぞれ1000 mg/kg投与群の雌で認められた.
2) 肉眼所見
(1) 投与期間終了時解剖例
片側副腎の小型化,前立腺および精嚢の小型化が対照群の雄各1例で観察された.このほかの対照群および被験物質投与群の雌雄ともに変化は認められなかった.
(2) 回復試験期間終了時解剖例
肝臓の大型化が対照群の雄1例で観察された.このほかの対照群および1000 mg/kg投与群の雌雄ともに変化は認められなかった.
3) 組織学検査所見(Table 5)
(1) 投与期間終了時解剖例
肉眼的に小型化がみられた対照群の雄1例の片側副腎には,皮質に限局性の鉱質沈着が観察された.また,小型化がみられた同群の雄1例の前立腺および精嚢に変化は認められなかった.
肝臓では門脈周囲性の脂肪化が対照群および1000 mg/kg投与群の雌雄でみられた.腎臓では好塩基性尿細管およびリンパ球浸潤が対照群および1000 mg/kg投与群の雌雄で,同群の雄では近位尿細管に好酸性封入体が,同群の雌では皮髄境界部の鉱質沈着が観察された.脾臓では髄外造血が対照群および1000 mg/kg投与群の雌雄で,同群の雌では褐色色素沈着も認められた.心臓では軽微な心筋の線維化が対照群および1000 mg/kg投与群の雌各1例で観察された.しかし,これらの所見はいずれも対照群と1000 mg/kg投与群の間で発生頻度および程度に有意な差は認められず,1000 mg/kg投与群の雌雄ともに被験物質投与によると考えられる変化は認められなかった.
(2) 回復試験期間終了時解剖例
肉眼的に大型化がみられた対照群の雄1例の肝臓では,小葉中心性に軽度の肝細胞の変性,壊死および肥大がみられ,門脈周囲性の軽微な脂肪化が認められた.

考察
1-ナフトール-4-スルホン酸ナトリウムを,100,300および1000 mg/kgの用量で雌雄のSprague-Dawley系ラットに28日間にわたって強制経口投与し,その後14日間の回復試験期間を設けた.
その結果,死亡例はいずれの群にも認められなかった.
尿検査では,投与期間終了週にビリルビン陽性尿あるいは潜血反応陽性尿が雄の被験物質投与群の各1例でみられたが,肝臓,腎臓および膀胱に肉眼的変化はみられず,また血液生化学検査でも溶血,肝細胞障害および腎障害を示唆する所見は認められなかった.また,ビリルビンおよび潜血反応陽性尿は少数例でみられた変化であることから,いずれも偶発的変化であると考えられた.
病理学検査では,投与期間終了時に精巣上体の絶対重量の有意な増加が1000 mg/kg投与群でみられたが,精巣上体の肉眼所見および組織学所見に異常は認められなかったことから,毒性学的意義はないと考えられた.回復試験期間終了時には,1000 mg/kg投与群の雌で,解剖時体重の増加に伴う脳および卵巣の相対重量の有意な減少がみられたほか,脾臓の絶対重量の有意な増加が認められた.しかし,脾臓の相対重量に変化はみられず,投与期間終了時に脾臓の重量変化は認められなかったことから,被験物質投与による影響ではないと考えられた.
一般状態,体重,摂餌量,血液学検査,血液生化学検査,肉眼所見および組織学所見に被験物質投与によると考えられる変化は認められなかった.
以上のように,1-ナフトール-4-スルホン酸ナトリウムを28日間反復経口投与した結果,1000 mg/kgの用量でも被験物質投与に起因したと考えられる変化は認められなかった.従って,本試験条件下における1-ナフトール-4-スルホン酸ナトリウムの無影響量は,雌雄ともに1000 mg/kg/dayであると考えられた.
| 連絡先 |
| 試験責任者: | 永田伴子 |
| 試験担当者: | 立花滋博,加藤博康,関 剛幸,古谷真美,堀内伸二,三枝克彦,稲田浩子,安生孝子 |
| (財)食品薬品安全センター秦野研究所 |
| 〒257-8523 神奈川県秦野市落合729-5 |
| Tel 0463-82-4751 | Fax 0463-82-9627 | |
| Correspondence |
| Authors: | Tomoko Nagata(Study director)
Shigehiro Tachibana, Hiroyasu Kato, Takayuki Seki, Mami Furuya, Shinji Horiuchi, Katsuhiko Saegusa, Hiroko Inada, Takako Anjo |
| Hatano Research Institute, Food and Drug Safety Center |
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan |
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |

 法(Rate)),ALP活性(GSCC法),AST(GOT)活性(IFCC法),ALT(GPT)活性(IFCC法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド濃度(GPO・DAOS法),無機リン濃度(モリブデン酸直接法)およびカルシウム濃度(OCPC法)を測定し,A/G比を算出した.また,全自動電解質分析装置EA05(A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(イオン電極法)を測定した.
法(Rate)),ALP活性(GSCC法),AST(GOT)活性(IFCC法),ALT(GPT)活性(IFCC法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド濃度(GPO・DAOS法),無機リン濃度(モリブデン酸直接法)およびカルシウム濃度(OCPC法)を測定し,A/G比を算出した.また,全自動電解質分析装置EA05(A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(イオン電極法)を測定した.







